Notch1-核转录因子κB在三阴乳腺癌组织中的表达及临床意义*
覃舒婷,莫军扬,张敏敏,唐 茜
(广西壮族自治区柳州市人民医院普外三科 545005)
Notch1-核转录因子κB在三阴乳腺癌组织中的表达及临床意义*
覃舒婷,莫军扬,张敏敏,唐茜
(广西壮族自治区柳州市人民医院普外三科545005)
[摘要]目的探讨Notch1-核转录因子κB(Notch1-NF κB)在三阴乳腺癌(TNBC)组织中的表达及临床意义。方法收集2013年6月至2014年12月住院的TNBC患者(乳腺癌组,n=66)和乳腺良性肿瘤患者(良性肿瘤组,n=62)乳腺组织标本,免疫组织化学法和Western blot法检测组织中Notch1-NF κB的表达。酶联免疫吸附试验法检测不同病理学特征的TNBC患者乳腺组织中Notch1-NF κB水平。结果免疫组织化学显示,Notch1-NF κB在乳腺癌组乳腺组织中呈高表达,在良性肿瘤组中呈微弱表达。Western blot示Notch1-NF κB在乳腺癌组中蛋白定量显著高于良性肿瘤组(P<0.05)。66例TNBC乳腺组织病理学分级和TNM分期不同,Notch1-NF κB水平均有差异,两两比较差异均有统计学意义(P<0.05)。结论Notch1-NF κB在TNBC患者乳腺组织中高表达,其水平与肿瘤的发生、发展和转移密切相关。
[关键词]乳腺肿瘤;免疫组织化学;转录因子;三阴乳腺癌;Notch1;核转录因子κB
Notch1是Notch基因编码的蛋白家族成员之一,激活后可使正常细胞向恶性细胞转化。多项研究表明Notch1影响了乳腺癌的形成和预后[1-2]。核转录因子κB(NF-κB)是一种具有多项调节功能的核转录因子,在细胞的增殖、分化和凋亡中起重要作用[3],其活性受Notch信号通路的调控[2]。目前,已有研究发现抑制Notch1-NF κB活性可以降低三阴乳腺癌(triple-negative breast cancers,TNBC)细胞的生长速度[4],但此项研究是在细胞株进行的,Notch1-NF κB在TNBC患者中的表达情况及临床意义,国内外研究甚少。本研究通过检测TNBC和乳腺良性肿瘤患者的乳腺组织中Notch1-NF κB表达及其与肿瘤分级、分期、淋巴结转移的关系,分析Notch1-NF κB表达在TNBC中的临床意义。
1资料与方法
1.1一般资料选择2013年6月至2014年12月广西柳州市第一人民医院普外三科收治的TNBC患者66例为乳腺癌组,女性,年龄26~78岁,平均(48.6±12.9)岁。同期收治的良性乳腺肿物患者62例为良性肿瘤组,女性,年龄22~67岁,平均(43.1±9.2)岁。收集石蜡标本用于免疫组织化学,收集术中乳腺组织(取自病变非坏死部位,液氮速冻,-80 ℃保存)用于Western blot和酶联免疫吸附试验(ELISA)测定。
1.2方法
1.2.1主要试剂兔抗人Notch1一抗和兔抗人NF-κB一抗购自美国Cell Signaling;BCA蛋白定量盒购自美国Thermo公司;Notch1和NF-κB水平检测采用酶联免疫吸附试验(ELISA)试剂盒购自美国R&D公司;羊抗兔二抗、多聚甲醛、石蜡、柠檬酸缓冲液和苏木素购自北京中杉金桥生物技术公司;酶标仪产自芬兰 Themo公司。
1.2.2试验方法NF-κB是由一系列相关蛋白组成,最常见的NF-κB二聚体为p65/p50,磷酸化的p65(phospho-NF-κB p65)是p65的活性形式。因此,本试验中均以phospho-NF-κB p65的检测结果代表NF-κB水平。
1.2.2.1免疫组织化学检测乳腺组织Notch1-NF κB表达采用免疫组织化学SP法检测,具体步骤按照试剂盒说明书操作。细胞膜和(或)胞膜质和(或)细胞核出现黄色或棕黄色颗粒为阳性反应。
1.2.2.2Western blot检测乳腺组织Notch1和phospho-NF-κB p65表达取约200 mg 组织剪碎,加入裂解液,冰上研磨,超声波破碎,4 ℃离心,转速10 000 r/min,时间20 min。BCA法蛋白定量,取60 μg蛋白与5×加样缓冲液混匀,100 ℃变性5 min,冷却后上样。恒压电泳2 h,4 ℃下将样品转移到聚偏二氟乙烯(PVDF)膜上,TBST洗涤3次,每次5 min。加入兔抗人Notch1一抗(1∶500)和 phospho-NF-κB p65一抗(1∶500),4 ℃过夜,TBST洗涤3次,加入羊抗兔二抗(1∶3 000),室温孵育2 h,TBST洗涤3次。加入化学发光液显色。
1.2.2.3ELISA检测乳腺组织Notch1和NF-κB水平将冻存标本置于2~8 ℃,直至融化。加入磷酸盐缓冲液(PBS),匀浆器将标本匀浆充分。离心20 min后收集上清液。BCA法蛋白定量后按照说明书操作,主要步骤为:加样、温育、配液、洗涤、加酶、显色、终止反应、测定吸光度。以标准物的浓度为横坐标,吸光度值为纵坐标,根据标准曲线计算相应的浓度。

2结果
2.1两组患者乳腺组织中Notch1和NF-κB表达差异在良性肿瘤组的乳腺组织中,Notch1和NF-κB均呈微弱表达(图1A、C),Notch1和NF-κB阳性表达率分别为21%和16%。而乳腺癌组患者的癌变组织中,可见棕褐色颗粒沉积于细胞膜和细胞质,呈Notch1高表达(图1B),阳性表达率79%;棕黄色颗粒沉积于细胞质和细胞核,呈NF-κB阳性表达(图1D),阳性表达率70%。Notch1和NF-κB在乳腺癌组织中表达的相关性:14例Notch1阴性表达病例中NF-κB阳性表达4例,52例Notch1阳性表达病例中NF-κB阳性表达39例,Spearman相关性分析显示,Notchl与NF-κB呈显著正相关(r=0.398,P=0.01)。

A:良性肿瘤组Notch1;B:乳腺癌组 Notch1;C:良性肿瘤组 phospho-NF-κB p65;D:乳腺癌组 phospho-NF-κB p65。
图1Notch1和NF-κB在乳腺组织中的表达(免疫组织化学染色,×400)
2.2两组患者乳腺组织中Notch1和NF-κB蛋白表达差异与良性肿瘤组比较,乳腺组患者乳腺组织Notch1蛋白和phospho-NF-κB p65表达显著升高(P<0.05),见图2。
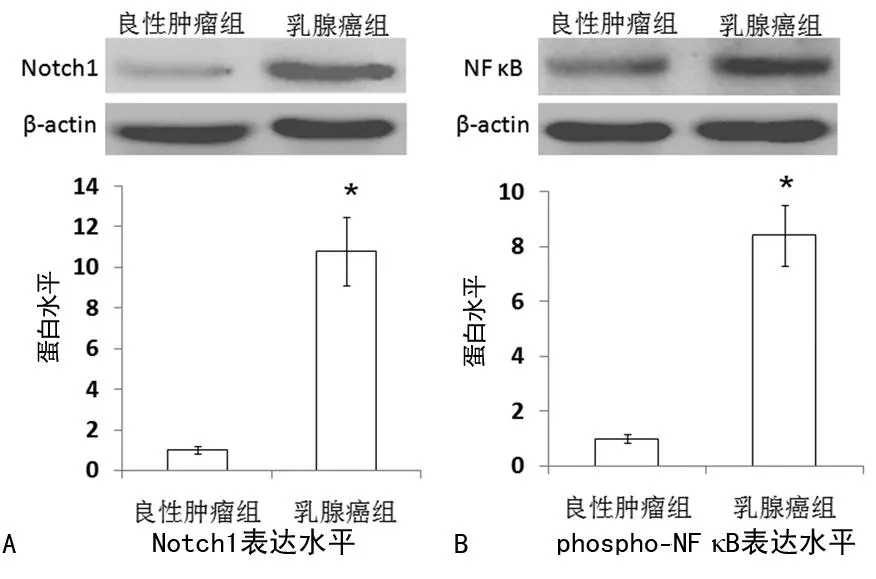
良性肿瘤组Notch1或NF-κB p65蛋白灰度值/β-actin蛋白灰度值设为1。A:Notch1在良性肿瘤和乳腺癌组织中的表达。B:phospho-NF-κB p65在良性肿瘤和乳腺癌组织中的表达。*:P<0.05,与良性乳腺癌组比较。
图2Notch1和phospho-NF-κB p65在乳腺组织中蛋白表达
2.3TNBC患者乳腺组织中Notch1-NF κB水平与临床病理特征的关系发生淋巴结转移的患者,乳腺病变组织中Notch1水平显著高于无淋巴结转移者,但和NF-κB水平二者比较差异无统计学意义(P>0.05)。病理学分级和TNM分期不同,Notch1-NF κB水平均有差异,两两比较差异均有统计学意义(P<0.05),见表1。

表1 40例TNBC患者Notch1和NF-κB水平与临床病理的关系
3讨论
乳腺癌是女性常见的恶性肿瘤,发病率在女性肿瘤中占据首位[5]。TNBC约占所有乳腺癌病理类型的15%[6],因其复发率、转移率和病死率高,预后差等特点[7],成为近年来研究热点。由于TNBC患者雌、孕激素受体均为阴性,失去了内分泌治疗的机会,目前,临床亦无治疗TNBC的特异性药物。因此,了解其发病机制从而寻找新的治疗靶点是TNBC研究亟待解决的问题。近年来,有研究发现Notch1-NF κB参与了TNBC的形成[4,8],但Notch1-NF κB活性与TNBC患者临床病理学特点之间的关系还不明确。
Notch信号途径是一条高度保守的信号通路,广泛表达于哺乳动物的多种成熟组织中[9]。大量的研究证实,Notch信号对乳腺肿瘤的发生具有重要调控作用,在不同的组织细胞中被激活后,可表现为致瘤性[10],也可表现为抑瘤性[11]。其中,多数研究认为Notchl在多种恶性肿瘤中有促癌作用[12-13]。本研究应用免疫组织化学和Western blot方法,分别从形态学和蛋白定量分析两方面观察到:TNBC患者乳腺组织中的Notchl表达显著高于良性乳腺肿物患者,这与既往的研究结果一致。为了研究Notch1的表达强弱与患者临床病理特征之间的关系,本研究应用ELISA测定了乳腺组织中Notch1的水平,发现发生淋巴结转移的患者,乳腺组织中Notch1的水平显著高于未发生淋巴结转移者。随着肿瘤病理学分级和TNM分期级别的升高,Notch1水平的增加差异有统计学意义。以上结果提示:Notch1不仅参与了TNBC肿瘤的形成,而且其表达与患者病情严重程度(淋巴结转移、病理学分级、TNM分期)具有一致性。
NF-κB,在胚胎发育、淋巴细胞的差异性凋亡、免疫和炎性反应中起重要作用[14-15]。其活性可受Notch1调节。在正常细胞内,NF-κB通常以无活性的前体形式(p50、p65、Rel B,c-Rel)存在于胞质中。Phospho-NF-κB p65,作为p65的活性形式通常代表活化的NF-κB水平。本研究将TNBC患者不同分级、分期和有无淋巴结转移等各因素之间进行乳腺组织NF-κB水平的相互比较,结果提示NF-κB在TNBC临床进展中有促进作用。
综上,Notch1和NF-κB在TNBC患者中明显高表达,Notch1-NF κB通路的激活与肿瘤的发生、发展和转移密切相关。因此,抑制Notch1-NF κB活性可能会成为TNBC治疗的一个新靶点,待进一步动物实验和临床研究的验证后,可为乳腺癌的控制或缓解提供一定的理论依据。
参考文献
[1]Hao L,Rizzo P,Osipo C,et al.Notch-1 activates estrogen receptor-alpha-dependent transcription via IKKalpha in breast cancer cells[J].Oncogene,2010,29(2):201-213.
[2]D′altri T,Gonzalez J,Aifantis I,et al.Hes1 expression and CYLD repression are essential events downstream of Notch1 in T-cell leukemia[J].Cell Cycle,2011,10(7):1031-1036.
[3]Metelev VG,Kubareva EA,Oretskaya TS.Regulation of activity of transcription factor NF-κB by synthetic oligonucleotides[J].Biochemistry(Mosc),2013,78(8):867-878.
[4]Pan H,Zhou W,He W,et al.Genistein inhibits MDA-MB-231 triple-negative breast cancer cell growth by inhibiting NF-κB activity via the Notch-1 pathway[J].Int J Mol Med,2012,30(2):337-343.
[5]Advani P,Moreno-Aspitia A.Current strategies for the prevention of breast cancer[J].Breast Cancer,2014,6:59-71.
[6] 马静,魏素菊.三阴乳腺癌的最新治疗进展[J].中国肿瘤临床,2011,38(19):1234-1238.
[7]Yadav BS,Sharma SC,Chanana P,et al.Systemic treatment strategies for triple-negative breast cancer[J].World J Clin Oncol,2014,5(2):125-133.
[8]Zhu H,Bhaijee F,Ishaq N,et al.Correlation of notch1,pAKT and nuclear NF-κB expression in triple negative breast cancer[J].Am J Cancer Res,2013,3(2):230-239.
[9]Bi P,Kuang S.Notch signaling as a novel regulator of metabolism[J].Trends Endocrinol Metab,2015,26(5):248-255.
[10]Speiser J,Foreman K,Drinka E,et al.Notch-1 and notch-4 biomarker expression in triple-negative breast cancer[J].Int J Surg Pathol,2012,20(2):139-145.
[11]Noseda M,Chang L,Mclean G,et al.Notch activation induces endothelial cell cycle arrest and participates in contact inhibition:role of p21Cip1 repression[J].Mol Cell Biol,2004,24(20):8813-8822.
[12]Kunnimalaiyaan S,Sokolowski KM,Balamurugan M,et al.Xanthohumol inhibits Notch signaling and induces apoptosis in hepatocellular carcinoma[J].PLoS One,2015,10(5):e0127464.
[13]Yao J,Zheng K,Li C,et al.Interference of notch1 inhibits the growth of glioma cancer cells by inducing cell autophagy and down-regulation of notch1-Hes-1 signaling pathway[J].Med Oncol,2015,32(6):610.
[14]Hoesel B,Schmid JA.The complexity of NF-κB signaling in inflammation and cancer[J].Mol Cancer,2013,12(12):86.
[15]Didonato JA,Mercurio F,Karin M.NF-κB and the Link between inflammation and cancer[J].Immunol Rev,2012,246(1):379-400.
doi:论著·临床研究10.3969/j.issn.1671-8348.2016.15.014
*基金项目:柳州市科学技术局(2014J030408)。
作者简介:覃舒婷(1983-),主治医师,硕士,主要从事研究乳腺癌的综合治疗。
[中图分类号]R655.8
[文献标识码]A
[文章编号]1671-8348(2016)15-2075-03
(收稿日期:2015-11-18修回日期:2016-01-15)
The expression and clinical value of Notch1-nuclear regulatory factor κB in human triple-negative breast cancer*
Qin Shuting,Mo Junyang,Zhang Minmin,Tang Qian
(Departmentofthe3rdGeneralSurgery,thePeople′sHospitalofLiuzhouCity,Liuzhou,theGuangxiZhuangAutonomousRegion545005,China)
[Abstract]ObjectiveTo detect the expression and clinical value of Notch1-nuclear regulatory factor κB(Notch1-NF κB) in human triple-negative breast cancer(TNBC).MethodsA total of 66 breast cancer patients and 62 breast benign tumor patients from general surgery department were included in this study.Immunohistochemical stain and Western-blot were employed to detect the expression of Notch1-NF κB in mammary tissue of all patients.ELISA was used to detect Notch1-NF κB content in mammary gland tissue of TNBC those of different pathological features.ResultsImmunohistochemical stain showed that Notch1-NF κB was highly expressed in mammary gland tissues of TNBC and weakly expressed in benign tumor patients.Western-blot results showed the Notch1-NF κB protein level significantly increased in mammary gland tissues of TNBC patients compared with those with benign tumor(P<0.05).The expression of Notch1-NF-kB was significantly associated with TNM stage and histological grade(P<0.05).ConclusionNotch1-NF κB was highly expressed in mammary gland tissue of TNBC patients,and their expressions were closely related with the occurrence,development and metastasis of TNBC.
[Key words]breast neoplasms;immunohistochemistry;transcription factors;triple-negative breast cancer;Notch1;nuclear regulatory factor κB

