CD4+CD25+CD127low/-调节性T细胞在晚期胃癌中的表达及意义*
钟 锐,冯 龙,兰琼玉,易烽明,蒋为民,吴建兵
(1.南昌大学医学院研究生院,南昌 330006;2.南昌大学第二附属医院肿瘤科,南昌 330006)
CD4+CD25+CD127low/-调节性T细胞在晚期胃癌中的表达及意义*
钟锐1,冯龙2△,兰琼玉2▲,易烽明2,蒋为民2,吴建兵2
(1.南昌大学医学院研究生院,南昌 330006;2.南昌大学第二附属医院肿瘤科,南昌 330006)
[摘要]目的研究CD4+CD25+CD127low/-调节性T细胞(Treg)在晚期胃癌患者外周血中的表达水平及其对化疗疗效判断的意义。方法采用流式细胞术(FCM)检测30例晚期胃癌患者和10例健康体检者外周血中CD4+CD25+CD127low/-Treg的表达水平。结果晚期胃癌患者外周血中CD4+CD25+CD127low/-Treg占CD4+ T淋巴细胞的百分比为(10.41±2.85)%,明显高于健康体检者(5.05±1.32)%(t=8.04,P<0.01),也明显高于化疗2周期后(7.07±1.45)%,(t=5.72,P<0.01)和化疗4周期后(7.30±1.65)%(t=5.17,P<0.01)。晚期胃癌患者化疗2周期后外周血中CD4+CD25+CD127low/-Treg占CD4+ T淋巴细胞的百分比为(7.07±1.45)%,与化疗4周期后(7.30±1.65)%比较,差异无统计学意义(t=0.57,P>0.05)。晚期胃癌患者外周血中CD4+CD25+CD127low/-Treg表达水平与患者性别、年龄、胃癌相关肿瘤抗原及肿瘤部位无相关性(P>0.05),低分化程度与中分化程度差异无统计学意义(P>0.05)。晚期胃癌患者化疗2周期后缓解组(完全缓解+部分缓解)外周血CD4+ T 细胞中 CD4+CD25+CD127low/-Treg的水平为(6.25±1.08)%与化疗2周期后未缓解组(病变稳定+疾病进展)的(7.98±1.27)%比较,差异有统计学意义(t= 4.02,P<0.01)。结论晚期胃癌患者外周血中CD4+CD25+CD127low/-Treg的表达水平与肿瘤缓解情况有关。
[关键词]胃肿瘤;T淋巴细胞;流式细胞术;化疗;晚期胃癌;CD4+CD25+CD127low/-调节性T细胞
胃癌是临床最常见的消化系统恶性肿瘤之一,在我国各类恶性肿瘤中胃癌的发病率和病死率均位前列,因其早期症状不明显,大约50%患者在确诊时已至晚期[1]。TNM分期中T4、N3或M1中任何一项均为晚期胃癌,而晚期胃癌患者中多数已不能彻底手术切除,失去治愈机会,以化疗为主的内科综合治疗是主要的治疗手段[2],因此对晚期胃癌化疗疗效的判断十分重要。CD4+CD25+调节性T细胞(regulatory T cell,Treg)是近些年来研究较多的具有免疫抑制功能的T细胞亚群,而免疫功能降低是发生肿瘤最关键的内因,胃癌患者免疫功能状态与其体内Treg水平密切相关[3-4]。目前,有关Treg在晚期胃癌中的表达水平与化疗疗效关系的研究较少。本研究采用流式细胞术(FCM)检测晚期胃癌患者外周血CD4+CD25+CD127low/-Treg水平及化疗前、后的变化,分析其与晚期胃癌患者化疗后缓解情况的关系,旨在探讨其对晚期胃癌患者化疗疗效判断的意义。
1资料与方法
1.1一般资料选取2013年5月至2014年10月南昌大学第二附属医院经病理确诊的初治不可切除晚期或复发转移胃癌患者30例(试验组),男18例,女12例,年龄30~75岁,平均57岁。纳入标准:(1)年龄大于18周岁,且小于或等于75周岁;(2)病理确诊的初治不可切除晚期或复发转移胃癌;(3)karnofskyckps评分大于或等于60分或ECOG评分小于或等于2分;(4)治疗前外周血常规检查满足以下条件,中性粒细胞计数大于4 000/mm3;血小板计数大于 100 000/mm3;(5)治疗前肝功能、肾功能检查满足以下条件,总胆红素小于17.1 μmol/L,天门冬氨酸氨基转移酶(AST)或丙氨酸氨基转移酶(ALT)小于2倍正常上限,血清肌酐小于132.6 μmol/L,肌酐清除率大于50 mL/min。排除标准:(1)年龄小于18周岁或大于75周岁;(2)KPS评分小于60分或ECOG评分大于2分;(3)血常规或肝功能、肾功能不符合入组标准者;(4)合并脑转移;(5)合并肠梗阻。选取同期该院健康体检者10例(健康对照组),男5例,女5例,年龄30~75岁,平均52岁。两组性别、年龄比较差异无统计学意义(P>0.05),具有可比性。
1.2试剂和仪器FACS溶血素、鼠抗人CD4-PerCP单抗、鼠抗人CD25-PE单抗、鼠抗人CD127-FITC单抗,以及其同型对照鼠抗人IgG1-PE/IgG1-FITC抗体均为美国BD公司产品;流式上样管及FACSCalibur型流式细胞仪均购自美国BD公司。
1.3方法
1.3.1治疗方案所有患者给予化疗4周期,具体化疗方案:(1)三药联合方案(改良DCF方案):第1天静脉滴注多西他赛50 mg/m2、奥沙利铂85 mg/m2、亚叶酸钙200 mg/m2,以及静脉推注氟尿嘧啶 400 mg/m2;第1~2天化疗泵持续泵入氟尿嘧啶1 200 mg/m224 h,每天1次,每14天1周期。(2)两药联合方案(XELOX方案):第1天静脉滴注奥沙利铂130 mg/m2;第1~14天口服卡培他滨1 000 mg/m2,每天2次,每21天1周期。
1.3.2治疗前基线检查、化疗期间检查及治疗后随访(1)治疗前基线检查:胸部CT平扫,腹部、盆腔增强CT/磁共振成像(MRI),心电图,血癌胚抗原(CEA),血常规,肝功能、肾功能。(2)化疗期间检查:每周期化疗前、后1周查血常规、肝功能、肾功能,每2周期化疗后复查肿瘤部位影像检查、血CEA。(3)治疗结束后随访:每2个月随访,包括体格检查,复查胸部CT平扫,腹部、盆腔增强CT/MRI,血CEA,血常规,肝功能、肾功能,直至病情进展。如怀疑病情进展,应及时复查胸部CT平扫,腹部、盆腔增强CT/MRI,血CEA。
1.3.3疗效评估2周期化疗后,根据RECIST标准(2000)评价近期疗效。(1)目标病灶的评价。完全缓解(CR):可测量目标病灶完全消失;部分缓解(PR):基线病灶最大径之和与基线状态比较,至少减少30%,无新病灶出现;疾病进展(PD):基线病灶最大径之和至少增加20%,或者新病灶;病变稳定(SD):基线病灶最大径之和有减少但未达PR或有增加但未达PD。(2)非目标病灶的评价。完全缓解(CR):所有非目标病灶消失和肿瘤标志物恢复正常。未完全缓解/病变稳定(IR/SD):一个或多个目标病灶持续存在和(或)肿瘤标志物高于正常。病变进展(PD):出现新病灶和(或)目标病灶明确进展。
1.3.4标本采集晚期胃癌患者治疗前1周内抽外周静脉血、化疗期间每2周期化疗抽外周静脉血行FCM检测CD4+CD25+CD127low/-Treg水平,同时抽取10例健康体检者清晨空腹状态下外周静脉血行FCM检测CD4+CD25+CD127low/-Treg水平作为对照。采集晚期胃癌患者及健康体检者外周静脉血置于肝素钠抗凝管中,每次采血量2 mL,采集血样置于4 ℃冰箱中临时保存等待上机做流式细胞检测。
1.3.5标本制备采集患者外周血(肝素抗凝),每次采血量 2 mL。在装有 100 μL抗凝全血的试管中分别加入5 μL鼠抗人CD4-PerCP/CD25-PE/CD127-FITC单抗混匀,室温下避光孵育15 min,加入FACS 溶血素1 mL混匀,避光放置12 min,1 500 r/min 离心 5 min,弃上清液,再次加入PBS 2 mL,1 500 r/min 离心 5 min,弃上清液,加入PBS 300 μL重悬细胞,上流式细胞仪检测。以分别加入同型鼠抗人CD4-PerCP、IgG1-PE、IgG1-FITC单抗作为阴性对照。
1.3.6外周血T细胞检测与分析采用FCM检测。FCM是用于对悬液中的微小颗粒进行计数和分选的一种生物学技术,具有兼具细胞分析与分选功能、测量速度快、可进行多参数测量等特点。本试验采用FCM对外周血T细胞进行检测与分析,检测前对仪器光路进行校准以减少各观测值的变异程度。用前向散射角(FSC)和侧向散射角(SSC)散点图分选出T淋巴细胞,在其中选择CD4+且SSC较小细胞区设门,以分析CD4+T淋巴细胞中CD25+CD127low/-Treg的水平。采用流式细胞仪FACSDiva 软件分析数据,本试验每一个样本收集分析 1×105个细胞,Treg表达水平以CD4+CD25+CD127low/-Treg在CD4+T淋巴细胞中的百分比来表示。

2结果
2.1试验组外周血中Treg水平与临床相关参数的关系试验组外周血中Treg水平在患者性别、年龄、胃癌相关肿瘤抗原(CEA、CA-199)及肿瘤部位等参数中差异无统计学意义(P>0.05),低分化程度与中分化程度差异无统计学意义(P>0.05),见表1。
2.2试验组与健康对照组外周血中Treg水平比较试验组外周血CD4+T 细胞中 CD4+CD25+CD127low/-Treg水平为(10.41±2.85)%,与健康对照组的(5.05±1.32)%比较,差异有统计学意义(t=8.04,P<0.01),见表2、图1。

A、D:淋巴细胞;B、E:CD4+T淋巴细胞;C、F:CD4+CD25+CD127low/-Treg。
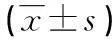
图1 试验组与健康对照组外周血中CD4+CD25+CD127low/- Treg表达水平
2.3试验组化疗前与化疗2周期后外周血Treg水平比较试验组化疗前外周血CD4+T细胞中CD4+CD25+CD127low/-Treg的水平为(10.41±2.85)%,明显高于化疗2周期后的(7.07±1.45)%,差异有统计学意义(t=5.72,P<0.01),见表3、图2。

表2 试验组与健康对照组外周血中Treg水平比较±s)

表3 试验组化疗前与化疗2周期后外周血中Treg水平比较

表4 试验组化疗前与化疗4周期后外周血中Treg水平比较
2.4试验组化疗前与化疗4周期后外周血Treg水平比较试验组化疗前外周血CD4+T 细胞中 CD4+CD25+CD127low/-Treg的水平为(10.41±2.85)%,明显高于化疗4周期后的(7.30±1.65)%,差异有统计学意义(t=5.17,P<0.01),见表4、图2。

表5 试验组化疗2、4周期后外周血中Treg水平比较
2.5试验组化疗2、4周期后外周血Treg水平比较试验组化疗2周期后外周血CD4+T 细胞中 CD4+CD25+CD127low/-Treg水平为(7.07±1.45)%,较化疗4周期后(7.30±1.65)%,差异无统计学意义(t=0.57,P>0.05),见表5、图2。
2.6化疗2周期后缓解组(CR+PR)与未缓解组(SD+PD)外周血Treg水平比较试验组化疗2周期后缓解组外周血CD4+T细胞中 CD4+CD25+CD127low/-Treg的水平为(6.25±1.08)%,较化疗2周期后未缓解组为(7.98±1.27)%,差异有统计学意义(t=4.02,P<0.01),见表6。

表6 化疗2周期后缓解与未缓解外周血中Treg水平比较

A、D、G:淋巴细胞;B、E、H:CD4+T淋巴细胞;C、F、I:CD4+CD25+CD127low/-Treg。
图2试验组化疗前与化疗2、4周期后外周血中CD4+CD25+CD127low/-Treg表达水平
3讨论
机体的免疫系统有时会因自身的免疫抗原或过度的免疫应答而攻击正常细胞导致自身免疫系统疾病的发生,而Treg的免疫负调节作用能有效地避免这种情况的发生,使机体免疫系统始终保持着平衡状态[5-6]。Treg除了具有抑制免疫反应的作用还能协助机体建立免疫耐受,维持免疫系统内稳态[7-8]。因此,维持机体内Treg正常的表达水平至关重要,若其表达水平过高则会抑制抗肿瘤免疫,过低则又易出现自身免疫损害[9]。
研究发现,CD4+CD25+Treg特异性的表达叉头样转录因子Foxp3,其作为Treg相对特异的形态和功能性标志,在CD4+CD25+Treg的发育和功能中均起到了关键作用,在Treg的发育中它直接参与了 CD4+T细胞向Treg的分化,同时在维持Treg的功能中也发挥了重要的作用[10]。但是要先固定细胞并破膜后才能检测出Foxp3,这是因为其存在于细胞内而不是表达于细胞膜表面,而且除Treg之外还有其他一些细胞也可以表达Foxp3,所以用其作为检测Treg的标记并不合适[11]。有研究表明,Treg低表达CD127与其阳性表达Foxp3与CD25均具有良好的相关关系,而体内激活的效应T细胞高表达CD127,故CD4+CD25+CD127low/-Treg能够很好地区分体内激活的效应T细胞,因此用CD4+CD25+CD127low/-作为检测Treg的标记较Foxp3更为合理[12]。
梁建明等[13]检测胃癌患者外周血中CD4+CD25+T细胞明显高于健康体检者,胃癌各期CD4+CD25+T细胞占CD4+T细胞的比率均显著高于健康对照组,胃癌患者术后外周血CD4+CD25+T细胞比率与术前相比明显降低。但目前有关Treg在晚期胃癌中的表达水平与化疗疗效关系的研究较少,而本试验结果显示晚期胃癌患者化疗2周期后缓解组外周血Treg的表达水平低于未缓解组,提示Treg在晚期胃癌中的表达水平一定程度上能够反映化疗疗效。
根据本试验结果,晚期胃癌患者外周血Treg的表达水平明显增高,提示如果能降低Treg的表达水平将有助于提高机体抗肿瘤作用。另外,本研究结果显示化疗前Treg的表达水平明显高于化疗后,但化疗2周期后与化疗4周期后变化不明显,其机制可能为化疗以后,CD4+CD25+CD127low/-Treg表达水平降低,对机体的免疫抑制作用减弱,从而增强机体免疫应答和抗瘤作用,但是需要特别注意的是,有些化疗药物也有可能造成 Treg 增殖反弹。有研究发现,在对荷瘤小鼠使用大剂量伊立替康联合氟尿嘧啶、甲酰四氢叶酸时,Treg数目在淋巴细胞恢复期显著增多[14]。目前,有关各种化疗药物对Treg各有怎样的影响方面的报道还不多,各种化疗药物对Treg的作用及其具体机制尚不明确[15]。除此之外,关于在化疗减轻肿瘤负荷的过程中,晚期胃癌患者体内的Treg是否会随着肿瘤负荷的减轻而产生数目及功能的相应变化方面的研究较少,而本试验结果显示晚期胃癌患者化疗2周期后外周血中Treg的表达水平与肿瘤缓解情况有关。
综上所述,本研究结果显示晚期胃癌患者外周血中CD4+CD25+CD127low/-Treg可能参与了胃癌的发生、发展,其表达水平在一定程度上能够反映化疗疗效,同时发现了一些值得探讨的问题,如各种化疗药物对Treg有哪些不同的影响,以及在化疗过程中化疗药物及肿瘤负荷的变化均对Treg产生影响,但是Treg表达水平的变化受哪个因素影响更大,还有待于进一步研究。
参考文献
[1]郭仁宏.2013 NCCN胃癌临床实践指南(2013.V2)要点介绍及解读[J/CD].中国医学前沿杂志(电子版),2013,12:71-78.
[2]叶延程,张玉花,薛虎,等.康艾注射液联合化疗用于晚期胃癌患者的近期疗效、安全性及对调节性T细胞水平和P21蛋白、VEGF表达的影响[J].中国药房,2015,26(6):737-740.
[3]Kondelkova K,Vokurkova D,Krejsek J,et al.Regulatory T cells (TREG) and their roles in immune system with respect to immuno-pathological,disorders [J].Acta Medica (Hradec Kralove),2010,53(2):73-77.
[4]张成娟,魏冰,徐本玲,等.胃癌患者外周血CD4+CD25+CD127low/-调节性T细胞表达临床意义分析[J].中华肿瘤防治杂志,2013,20(9):679-682.
[5]Weng J,Lai P,Lv M,et al.Bortezomib modulates regulatory T cell subpopulations in the process of acute graft-versus-host disease[J].Clin Lab,2013,59(1/2):51-58.
[6]Bremm M,Huenecke S,Lehrnbecher T,et al.Advanced flowcytometric analysis of regulatory T cells:CD127 down-regulation early post stem cell transplantation and altered Treg/CD3+CD4+-ratio in severe GvHD or relapse[J].J Immunol Methods,2011,373 (1/2):36-44.
[7]Bilate AM,Lafaille JJ.Induced CD4+Foxp3+regulatory T cells and immune tolerance[J].Annu Rev Immunol,2012,30(3):733-758.
[8]Josefowicz SZ,Lu LF,Rudensky AY.Regulatory T cells:mechanisms of differentiation and function[J].Annu Rev Immunol,2012(30):531-564.
[9]Schlecker E,Stojanovic A,Eisen C,et al.Tumor-infiltrating mono-cytic myeloid-derived suppressor cells mediate CCR5-dependent recruitment of regulatory T cells favoring tumor growth [J].J Immunol,2012,189(12):5602-5611.
[10]Hori S,Nomura T,Sakaguchi S.Control of regulatory T cells development by the transcription factor Foxp3 [J].Science,2003,299(56):1057-1061.
[11]Morgan ME,van Bilsen JH,Bakker AM,et al.Expression of FOXP3 mRNA is not confined to CD4+CD25+T regulatory cells in humans [J].Hum Immunol,2005,66(1):13-20.
[12]Liu W,Putnam AL,Xu-Yu Z,et al.CD127 expression inversely correlates with FoxP3 and suppressive function of human CD4+Treg cells [J].J Exp Med,2006,203(7):1701-1711.
[13]梁建明,孙青,钟永,等.胃癌患者外周血CD4+CD25+调节T细胞比率及表型特征研究[J].蚌埠医学院学报,2010,35(9):883-886.
[14]沈彦伟,高旭霞,李晶晶,等.肿瘤患者化疗前后外周血 NK/T 及 Treg 细胞比例分析[J/CD].中华结直肠疾病电子杂志,2012,1(1):26-30.
[15]蒋平,唐湘莲,韩绍伟.FOLFOX 方案化疗对胃癌术后患者外周血 CD4+CD25+调节性 T 细胞细胞增殖及功能的影响[J].医学研究杂志,2012,41(3):61-65.
doi:论著·临床研究10.3969/j.issn.1671-8348.2016.15.011
*基金项目:江西省教育厅科学技术研究项目(KJ201109091722)。
作者简介:钟锐(1989-),住院医师,硕士,主要从事肿瘤内科的综合治疗方面研究。△
通讯作者,E-mai:fenglong@csco.org.cn;▲
[中图分类号]R735.2
[文献标识码]A
[文章编号]1671-8348(2016)15-2065-05
(收稿日期:2015-11-18修回日期:2016-01-12)
Expression and significance of CD4+CD25+CD127low/-regulation T cells in the advanced gastric cancer*
Zhong Rui1,Feng Long2△,Lan Qiongyu2▲,Yi Fengming2,Jiang Weimin2,Wu Jianbing2
(1.MedicalCollegeofPost-GraduateSchool,NanchangUniversity,Nanchang,Jiangxi330006,China; 2.DepartmentofOncology,theSecondAffiliatedHospitalofNanchangUniversity,Nanchang,Jiangxi330006,China)
[Abstract]ObjectiveTo study the expression level and diagnostic value of CD4+CD25+CD127low/-regulatory T cells (Treg) in peripheral blood from advanced gastric cancer patients.MethodsThe expression level of CD4+CD25+CD127low/-regulatory T cells in peripheral blood from 30 advanced gastric cancer patients and 10 healthy volunteers was examined by flow cytometry (FCM).ResultsThe population of CD4+CD25+CD127low/-regulatory T cells in peripheral blood from advanced gastric cancer patients accounted for (10.41±2.85)% of CD4+T lymphocytes,which was significantly higher than those from healthy volunteers (5.05±1.32)%(t=8.04,P<0.01),advanced gastric cancer patients after 2 cycles of chemotherapy (7.07±1.45)% (t=5.72,P<0.01),and advanced gastric cancer patients after 4 cycles of chemotherapy (7.30±1.65)% (t=5.17,P<0.01).The population of CD4+CD25+CD127low/-regulatory T cells in peripheral blood from advanced gastric cancer patients after 2 cycles of chemotherapy accounted for (7.07±1.45)% of CD4+T lymphocytes,and there was no significant variations than those from advanced gastric cancer patients after 4 cycles of chemotherapy (7.30±1.65)% (t=0.57,P>0.05).There was no relationship between the expression level of CD4+CD25+CD127low/-regulatory T cells in peripheral blood from advanced gastric cancer patients and their gender,age,gastric cancer related tumor antigens and the site of the tumor (P>0.05),there was no significant variations between the expression level of CD4+CD2+CD127low/-regulatory T cells in peripheral blood from poorly differentiated group and those from moderately differentiated group (P>0.05).The population of CD4+CD25+CD127low/-regulatory T cells in peripheral blood from advanced gastric cancer patients who were remission group (CR+PR) after 2 cycles of chemotherapy accounted for (6.25±1.08)% of CD4+T lymphocytes and those from advanced gastric cancer patients who were no remission group(SD+PD) after 2 cycles of chemotherapy accounted for (7.98±1.27)%,there was difference between the remission group and the no remission group (t=4.02,P<0.01).ConclusionThere was relationship between the expression level of CD4+CD25+CD127low/-regulatory T cells in peripheral blood from advanced gastric cancer patients after 2 cycles of chemotherapy and the tumor response.
[Key words]stomach neoplasms;T-lymphocytes;flow cytometry;chemotherapy;advanced gastric cancer; CD4+CD25+CD127low/-regulatory T cells
共同通讯作者,E-mail:flylanhuacao@163.com。

