逆境胁迫对小麦幼苗生理生化指标的影响*
章 瑞(云南师范大学生命科学学院,昆明 650500)
逆境胁迫对小麦幼苗生理生化指标的影响*
章瑞
(云南师范大学生命科学学院,昆明 650500)
摘 要:对逆境胁迫下玉米和小麦用TTC染色和曙红染色,观察染色情况测定发芽率,发现干旱下发芽率下降。以小麦为材料,研究干旱胁迫下,脯氨酸(Pro)、丙二醛(MDA)、GSH和H2O2含量和抗氧化酶(POD、PPO)活性的变化.结果显示在干旱胁迫下,脯氨酸(Pro)、丙二醛(MDA)、GSH、H2O2的含量相对于对照组均有较明显的上升趋势,POD和PPO活性也表现出较大水平的提高。
关键词:逆境胁迫 小麦 生理生化
植物常遭受的有害影响之一是缺水。当植物耗水大于吸水时,组织内水分亏缺。过度水分亏缺的现象叫干旱[1]。在水分亏缺严重时,植物会出现萎蔫,光合作用减弱,严重影响农作物产量。而且,当缺水时,正常的膜双层结构被破坏,出现孔隙,渗出大量溶质,丧失选择透性。缺水时植物的另一个显著响应是由于溶质累积渗透势下降。植物在干旱胁迫下由“渗透感受器”感受外界胁迫信号,启动一系列的信号转导途径[2]。
1 材料与方法
1.1 材料及处理
玉米种子,小麦种子;正常生长的小麦幼苗,干旱逆境处理的小麦幼苗。
1.2 测定方法
(1)种子发芽率的测定。各取50粒吸胀的玉米种子和小麦种子,沿胚的中心线切成两半(严格区分两个半粒)。其中50个半粒进行TTC染色(30℃水浴 20 min),另50个半粒进行曙红染色(室温染色10 min),根据两种方法的染色情况,分别计算发芽率。
(2)脯氨酸(Pro)含量的测定。Pro的提取:分别取0.1 g实验组和对照组的幼苗→加入3 ml 3%磺基水杨酸(SSA)和少许石英砂→充分研磨→用2 ml 3%磺基水杨酸(SSA)洗研钵→5 000 rpm离心10 min→量上清液体积。
Pro的测定:上清液各2 ml→分别加入2 ml冰乙酸和2 ml茚三酮试剂→煮沸15 min→冷却后→5 000 rpm离心10 min(若没沉淀可省略此步骤)→分别测定A520。
(3)丙二醛(MDA)含量的测定。MDA的提取:分别取0.1 g实验组和对照组→加入3 ml10%TCA和少许石英砂→充分研磨→用2 ml10%TCA洗研钵→5 000 rpm离心10 min→量上清液体积。
MDA的测定:分别取上清液各2 ml→加入0.5%TBA(用10% TCA配制)2 ml→煮沸15 min→冷却后→5 000 rpm离心5 min(视沉淀有无)→分别测定OD450和OD532。

C1为可溶性糖的浓度;C2为MDA的浓度。
(4)H2O2含量的测定。H2O2提取:分别取0.1 g实验组和对照组→加入3 ml3%三氯乙酸(TCA)和少许石英砂→充分研磨→用2 mlTCA洗研钵→5 000 rpm离心10 min →量上清液体积。
测定:分别取上清液各4 ml →加入0.1%Ti(SO4)2[用20%(v/v)H2SO4配制]0.2 ml→摇匀→OD410.

图1 干旱对过氧化酶活性的影响
(5)过氧化酶(POD)活性的测定。POD的提取:分别取0.1 g实验材料→加入少许石英砂和3 ml提取液(50 mmol/L PBS,pH6.0, 内 含0.1 mmol/ LEDTA,1%PVP)→充分研磨→转入离心管中→用2 ml提取液洗研钵→5 000 rpm离心10 min→量上清液体积→用于测定POD和PPO酶活性或分装后转至-20或-80℃保存。
POD测定:取POD反应混合液(10 mmol/L愈创木酚,5 mmol/L H2O2,用PBS溶解)3 ml,加入酶液50 ul(空白调零用提取液取代),立即记时,摇匀,读出反应0.5和1.5 min时的A470。
PPO测定:取PPO反应混合液(20 mmol/L邻苯二酚,用PBS溶解)3 ml,加入酶液0.1 ml(空白调零用提取液取代),立即记时,摇匀,读出反应0.5和1.5 min时的A410。
以每分钟A值变化0.01所需要的酶液的量为一个活力单位(U),则:

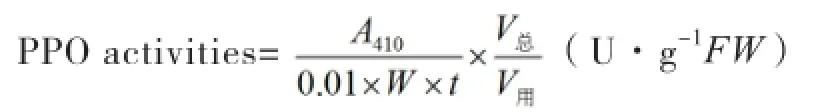
(6)GSH含量的测定。GSH的提取:分别取0.1 g实验组和对照组的幼苗→加入3 ml3%三氯乙酸(TCA)和少许石英砂→充分研磨→用2 ml3% TCA洗研钵→5 000 rpm离心10 min→量上清液体积。
GSH的测定:上清液各2 ml(空白用3% TCA代替)→分别加入0.4 ml 1MNaOH→1 ml 2 mMDTNB→25℃5 min→测定A412。
2 试验结果
2.1 不同测定方法对种子发芽率的影响
两种方法测得的小麦和玉米发芽率所得到得结果不同,TTC方法测得的小麦发芽率为94%,玉米发芽率为90%,而曙红法测得的小麦发芽率为92%,玉米发芽率为86%。造成这种现象的原因可能是因为在实验过程中人为地区分染色与未被染色的小麦存在误差,也有可能是因为沿中心线对半切开时未将胚均匀分开。但就结果而言,小麦和玉米的发芽率都较高。
2.2 干旱胁迫下对脯氨酸(Pro)含量的影响
实验测得干旱胁迫下A520=1.927,计算得干旱胁迫下H202的含量为78.5 μmol/gFW,正常情况下A410=0.023,计算得正常情况下H202的含量为0.98 μmol/gFW。实验组脯氨酸含量高于对照组,约为80倍,说明正常情况下小麦幼苗脯氨酸含量较低,但当受到干旱胁迫时小麦幼苗的脯氨酸含量明显增高,可以增加数十倍。
2.3 干旱胁迫下对丙二醛(MDA)含量的影响
实验测得干旱胁迫下A450=1.263,A532=0.192,计算得干旱胁迫下MDA的含量为0.208,正常情况下A450=0.077,A532=0.039,计算得正常情况下MDA的含量为0.531。实验组的MDA含量高于对照组,说明干旱胁迫使得MDA含量升高。
2.4 干旱胁迫下对H2O2含量的影响
实验测得干旱胁迫下A410=0.752,计算得干旱胁迫下H202的含量为38.115 μmol/gFW,正常情况下A410=0.242,计算得正常情况下H202的含量为124.08 μmol/gFW。对照组H202的含量高于实验组,且干旱胁迫下的H202含量约是正常生长的3.3倍,说明干旱胁迫使得H202含量减少。
2.5 干旱胁迫下对过氧化酶活性的影响
实验测得干旱胁迫下30 s时A470=0.643,90 s 时A470=1.872,计算得干旱胁迫下POD含量为1.97 μmol/ gFWmin-1, 测 得 正 常 情 况 下 30 s时 A470=0.258,90 s时 A470=0.623,正常情况下POD含量为0.67 μmol/ gFWmin-1, 测 得 干 旱 胁 迫 下 30 s时 A410=0.314,90 s A410=0.223, 正 常 情 况 下 30 s时 A410=0.149,90 s A410=0.205,计算得干旱胁迫下PPO含量为127.4 U·g-1FW,正常情况下PPO含量为89.6 U·g-1FW,明显的,干旱胁迫使过氧化酶含量升高。由下图可知,实验组测得的POD含量和PPO含量都比对照组的含量高。最终可知,干旱胁迫使过氧化酶含量活性升高。
2.6 干旱胁迫下对GSH含量的影响
实验测得干旱胁迫下A412=1.503,计算得干旱胁迫下GSH的含量为8.2 665 μmol/gFW,正常情况下A412=0.113,计算得正常情况下GSH的含量为0.6 215 μmol/gFW。实验组测得的GSH含量明显高于对照组,说明干旱胁迫使得GSH含量升高。
以上实验结果汇总于下图可直观看出干旱胁迫对小麦幼苗会产生一定影响。
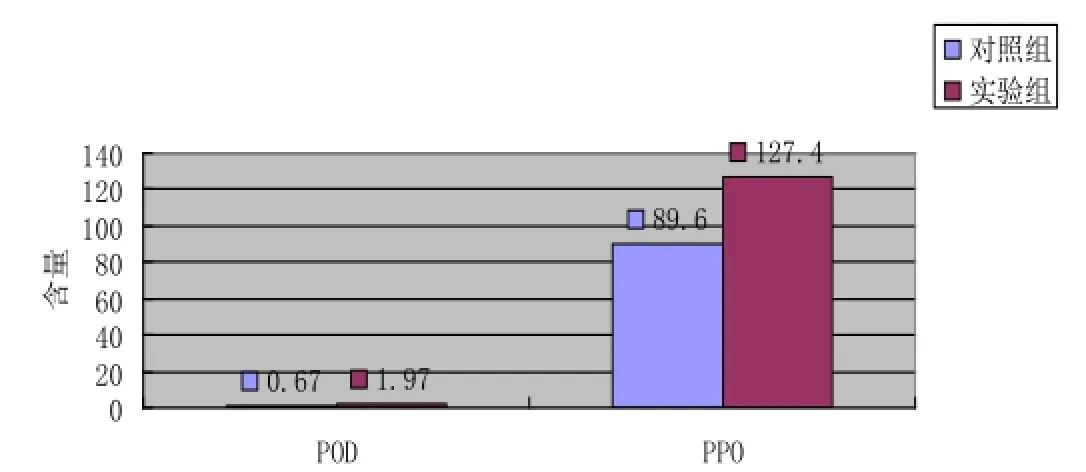
图1 干旱对过氧化酶活性的影响
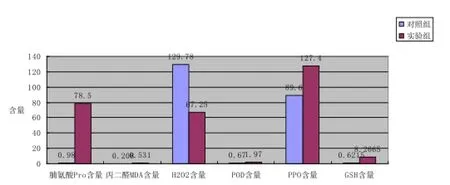
图2 干旱对小麦幼苗的影响
3 讨论与分析
在干旱胁迫下,玉米小麦的发芽率会下降。且干旱胁迫下,小麦幼苗生长受到一定抑制作用,生理生化指标发生一系列变化,表现为干旱胁迫下,小麦幼苗胚芽鞘中脯氨酸、丙二醛(MDA)、H2O2、过氧化酶(POD、PPO)、谷胱甘肽(GSH)含量在干旱胁迫下含量较正常情况下的明显升高。
植物活细胞的原生质膜具有分别透性,使得染料分子曙红不能透过,因而不能将具有生活力的种胚染色,而死的种胚,其细胞膜结构破坏,通透性增大,于是曙红便能透膜进入细胞内而将无生活力的种胚染色。
TTC是标准的氧化还原色素,溶于水后呈无色。当TTC与种胚接触时作为氢受体被还原型脱氢辅酶的氢还原,由无色TTC变成红色的TTF。TTF颜色深浅与活力成正相关。
在受到轻度干旱胁迫时,植物能够通过渗透调节降低水势,保持膨压。植物的渗透调节主要通过脯氨酸等亲和性溶质的积累而实现。脯氨酸等小分子有机物的大量积累不会破坏生物大分子的结构和功能,表现出良好的亲和性,而且具有较强的渗透调节作用,因此,是理想的渗透物质[3]。
在正常条件下,植物体内游离脯氨酸的含量并不高,约占游离氨基酸总量的百分之几。但当植物处于干旱等逆境下时组织内的游离脯氨酸水平明显提高。这是因为由于脯氨酸的分子结构及其理化性质能够保护酶的空间结构、稳定膜系统,参与叶绿素合成,消除NH3的毒害,因而提高植物的抗性[4]。
植物器官在逆境下遭受伤害,往往发生膜脂过氧化作用,丙二醛(MDA)是膜脂过氧化主要产物之一。一般认为,MDA在植物体内积累是活性氧毒害的表现,它的含量是判断膜脂过氧化程度的一个重要指标。干旱条件下,植物体内随干旱程度加重,MDA含量明显增加[4]。
H2O2活性氧自由基是植物体内破坏性很强的氧化物质,干旱条件下它的积累可直接引起非酶促膜脂过氧化作用。氧化物质含量的降低,其对植物细胞的破坏性也将下降,植物受伤害程度有可能减轻[5]。
植物在长期进化中已形成了清除活性氧自由基、抑制膜脂过氧化作用的酶促和非酶促系统,前者主要包括过氧化物酶(POD、PPO)等酶类,后者主要是谷胱甘肽(GSH)等小分子抗氧化物质。一般认为,干旱或其它逆境条件下,当植物细胞自由基的产生和清除的平衡机制被破坏后,自由基积累,会导致细胞的膜脂过氧化和脱脂化作用,造成膜系统损伤,使差向透性增大,引起代谢紊乱,严重时,植物遭受伤害[5]。
参考文献
[1] 潘瑞炽.植物生理学.北京:高等教育出版社,2008,295~297
[2] 张会,植物干旱逆境胁迫研究综述.安徽农业科学,2013,(3)
[3] 郭卫东,郑学勤.植物抗旱分子机理.西北农业大学学报,1999,27(4)102~108
[4] 常红军,刘兰霞.植物抗旱分子机理研究进展.安徽农业科学,2006,34(18):509~4 510,4 514
*基金项目:云南师范大学2014年大学生科研训练基金项目(kkx2014-12-225)

