COPD和哮喘患者血清与支气管灌洗液中IL-8,SLPI,sCD14和 sICAM-1含量比较
杨万勇,陈 波,阮福旺
(广东省东莞市光华医院检验科,东莞 523000)
COPD和哮喘患者血清与支气管灌洗液中IL-8,SLPI,sCD14和sICAM-1含量比较
杨万勇,陈波,阮福旺
(广东省东莞市光华医院检验科,东莞523000)
【摘要】目的:通过检测支气管灌洗(BAL)液与血清中趋化因子(IL-8),分泌性白细胞蛋白酶抑制剂(SLPI),可溶性细胞间粘附分子-1(sICAM-1)和sCD14含量,探讨IL-8、SLPI,sCD14和sICAM-1作为具有相似病程的哮喘和COPD患者炎症和免疫应答反应生物标志物的潜力。方法:采用酶联免疫法(ELISA)测定哮喘(n=13)与COPD (n=25)患者血清和支气管灌洗液中IL-8,SLPI,sCD14和sICAM-1含量。结果:哮喘和COPD患者BAL中IL-8和SLPI含量远高于血清中IL-8和SLPI含量,而BAL中sICAM-1和sCD14含量远低于血清中sICAM-1和sCD14含量。在测定的所有生物标志物中,COPD患者中只有BALIL-8的浓度高于哮喘患者BALIL-8的浓度。两组中,BALIL-8与SLPI相关。COPD患者中,BALsICAM-1和sCD14相关,而哮喘患者中BALsICAM-1与FEV1/FVC相关。此外,哮喘患者中血清中SLPI与sCD14相关,且血清中sICAM-1与FEV1/FVC负相关。结论:分析特定生物标志物时,选择正确的生物流体至关重要。在测定的4个生物标志物中,COPD患者中只有BALIL-8浓度高于哮喘患者BALIL-8浓度。
【关键词】哮喘;慢性阻塞性肺病;炎症标志物;支气管灌洗液;血清
气道炎症是哮喘与慢性阻塞性肺疾病(chronic obstructivepulmonarydiseases,COPD)患者基本的病理生理特征。两种疾病均与炎症反应物增加和释放相关,反应物包括细胞因子、趋化因子、蛋白酶及其抑制剂和粘附分子。最近研究表明,哮喘和COPD患者出现相似的细胞反应,且较严重哮喘患者的嗜中性粒细胞增多,较严重COPD患者的嗜酸性粒细胞增多并激活[1,2]。单核细胞/巨噬细胞是COPD炎细胞浸润的重要组成部分,单核细胞/巨噬细胞激活标志—CD14含量在哮喘急性发作患者中上升[3]。COPD患者IL-8含量高,且为嗜中性粒细胞选择性引诱因子。诱导痰中IL-8含量与嗜中性粒细胞炎症和疾病严重度相关(%预计FEV1)。研究也表明IL-8在哮喘中也扮演一定的角色。IL-8参与淋巴细胞、嗜酸性粒细胞和嗜碱性粒细胞的激活和至炎症部位的迁移[4]。粘附分子在白细胞聚集和迁移至炎症部位过程中均起到至关重要作用。哮喘气道中细胞表面细胞间粘附分子-1(ICAM-1)增多,同时发现,哮喘患者痰液中可溶性ICAM-1(sICAM-1)含量增加。蛋白酶及其抑制剂与COPD和哮喘的病理生理学和气道病理学中也有关[5]。分泌性白细胞蛋白酶抑制剂(SLPI),也称抗白细胞蛋白酶,是一种自然产生的丝氨酸蛋白酶抑制剂,由人体气道的粘膜上皮细胞、浆液细胞和支气管杯状细胞产生。研究显示,SLPI在哮喘病理生理学中十分重要,因为其表现出对与哮喘病理学相关的肥大细胞和白细胞丝氨酸蛋白酶的广谱抑制活性[6]。
因此,呼吸道炎症涉及上皮细胞、常驻巨噬细胞、嗜酸性粒细胞、嗜中性粒细胞等。同时,炎症提供多种细胞释放标志物,利用这些标志物可以跟踪与疾病相关的病理生理学变化。大多数蛋白质表达的变化与疾病病理生理学的许多层面紧密相关,包括炎症、气道重构、组织损伤和修复、粘液分泌和血浆渗透等[7]。然而,目前临床对与哮喘和COPD相关的一系列复杂细胞和炎症介质间的关系仍不清楚,这样研究者很难发现有助于预测患者预后、反应病变强度的特异性强,灵敏度高的生物标志物。众所周知,特定生物标志物的有效性在于选择合适的生物介质进行分析。本研究旨在通过比较血清和BAL液中SLPI、sICAM-1、IL-8和sCD14含量,探讨其作为哮喘和COPD患者潜在炎症标志物的潜力。
1 资料与方法
1.1研究对象COPD(n=25)和哮喘(n=13)患者为为我院呼吸内科门诊患者,年龄均在35岁以上。COPD的诊断符合中华医学会呼吸病学分会慢性阻塞性肺疾病学组2007年修订的《慢性阻塞性肺疾病诊治指南》中的诊断标准[8]。本组患者一秒用力呼气容积(FEV1)预计值百分比小于80%,一秒用力呼气容积(FEV1)/用力肺活量FVC的预计值百分比小于70%,COPD患者严重程度属于中度(n=13)到重度(n=12)(COPD阶段Ⅱ级-Ⅲ级)。本组患者包括有吸烟史的10包年以上的病人(现吸烟或之前吸烟)或接触到职业性粉尘和化学物质的不吸烟者(n=4)。哮喘的诊断符合2008年中华医学会呼吸病学分会哮喘学组制定的《支气管哮喘防治指南》中的诊断标准[9]。所有患者病程半年以上,本研究前至少一个月不摄入类固醇。本次调查前至少一个月内所有实验对象未显示出急性呼吸道感染症状。排除标准:α1-抗胰蛋白酶缺乏症和其他原因(心血管疾病、肺炎、间质性肺病、胸膜疾病、上气道阻塞、神经肌肉疾病和贫血)导致的呼吸困难和支气管癌。吸烟包年数量以烟草使用(以年为单位)和平均每天吸烟数量/20的乘积(年×平均每天吸烟数量/20)计算。
1.2肺功能测试使用德国Masterscreen肺功能仪。测定指标:用力肺活量(forcedvitalcapacity,Fvc);1s用力呼气容积(forcedexpiratoryvolumeinonesecond,FEV1);1s用力呼气容积占用力肺活量的比值(FEV1/ Fvc);最大呼气中段流量(maximalmidexpiratoryflow curve,MMEF)25%-75%;残气容积(residualvolume,RV);肺总量(totallungcapacity,TLC);残气容积与肺总量的比值(RV/TLC);CO弥散功能(diffusingcapacityof carbonmonoxide,DLCO)。所有受试者肺功能测定均给出预计值及实测值,使用实测值与预计值的比值(%)进行分析。
1.3支气管镜检查和支气管肺泡灌洗过程支气管镜检查在采血和肺功能测试后进行。支气管镜检查前至少4小时内,实验对象不可以进食或饮水。检查进行前至少10小时内实验对象不允许吸烟。为进行支气管灌洗,局部上呼吸道使用5ml2%的利多卡因麻醉。所有支气管镜检查均在早晨进行。支气管镜插至中叶段支气管,然后注入(分5次注入)37℃的20mL无菌生理盐水。注入完成后,抽吸灌洗液,收集至无菌容器中,容器负压为-40到50mmHg。随后用48μm的尼龙纱布将灌洗液过滤,随后4℃,1000r/m,离心10min。弃上清液,置于-80℃冰箱冷冻,以便于进一步研究。所有患者均进行支气管镜检查,且未出现重症并发症。
1.4血清样本患者入院后即抽取静脉血约5mL,以离心机常温下3000r/min,离心15min,收集血清0.5mL,-80℃冰箱保存备用。
1.5血清和支气管灌洗液分析IL-8,sICAM-1,sCD14和SLPI的测定使用奥地利tacanGmbH5082全自动酶标仪,采用双抗体夹心酶联免疫吸附试验(Enzyme-linkedimmunosorbentassay,ELISA)法检测。人IL-8,sICAM-1,sCD14和SLPI试剂盒购自美国R&D公司。检测过程严格按照试剂盒的说明操作。测试须进行两次,测定波长为450nm,背景校正为570nm,取每个标准和样本读数的平均数,减去零标准的平均数。IL-8,sICAM-1,sCD14和SLPI试剂盒的检测范围分别是31.2,15.6,125和62.5pg/ml。
1.6支气管灌洗液中总蛋白分析灌洗液中的蛋白质含量采用BCA法测定。
1.7统计分析使用SPSS软件18.0进行统计分析。使用Kolmogorov-Smirnov检验测试变量的正态分布。由于非正态分布变量的对数转换对正态分布无改善作用,本研究采用非参数检验。多组间进行比较时使用了秩和检验。若存在显著性差异,可使用曼-惠特尼U检验和多重比较校正法(邦弗朗尼检验法)进行组群比较。使用斯皮尔曼等级相关检验研究相关性。数据显示为均值和范围。P<0.05表示差异有统计学意义。
2 结果
2.1患者一般资料哮喘患者与 C O P D患者(P=0.026)相比相对年轻,哮喘患者中女性比男性多(男女比例分别是69.2%和8.7%),吸烟人数相对COPD患者很少。25例COPD患者中,4例不吸烟,11例曾经吸烟。与预期相符的是,与哮喘患者相比,COPD患者FEV1(FEV1预计值58.3vs.84.1,P<0.001)较低。哮喘与COPD患者病程时间(8.6±2.5vs.7.8±1.3年)、血清AAT含量(1.47±5.6vs.1.38±5.4mg/mL)和支气管灌洗液总蛋白含量并无显著差异。
2.2支气管灌洗液和血清中IL-8,SLPI,sICAM-1,sCD14含量COPD患者组中BALIL-8的含量要远高于哮喘患者组中BALIL-8含量(0.104±0.03vs.0.03± 0.01ng/mL,P=0.04)。两组患者血清IL-8含量无显著性差异,尽管COPD患者比哮喘患者IL-8平均值含量稍高(0.09±0.07vs.0.016±0.01ng/mL)。两组患者支气管灌洗液中IL-8含量要远高于血清中IL-8含量(COPD P=0.011,哮喘P=0.034)。
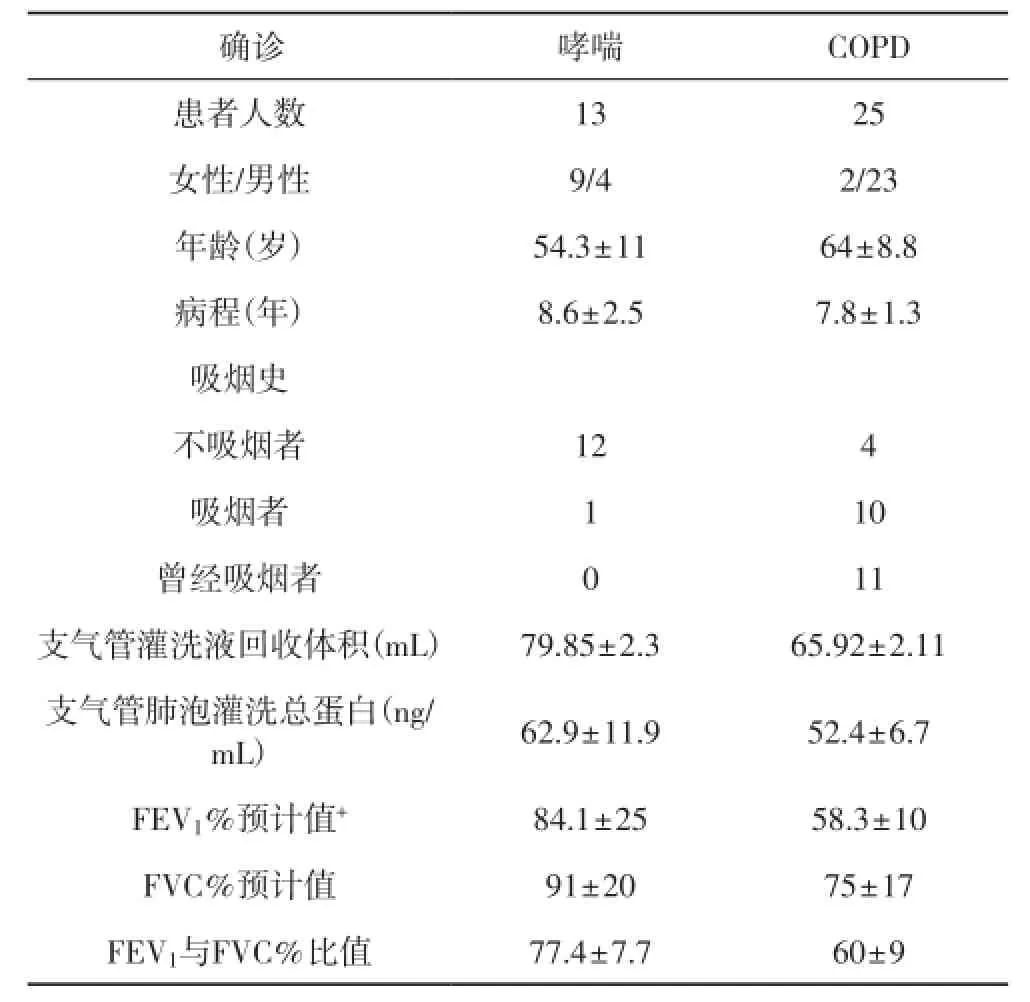
表1 患者一般资料
支气管灌洗液和血清中的SLPI,sICAM-1和sCD14含量无显著性差异。然而,COPD(72.6vs.40.3,统计学上不显著)和哮喘(64.7vs.41.95,P=0.04)组中支气管灌洗液比血清中SLPI的含量高。相反,两组患者血清中sICAM-1和sCD14含量高于支气管灌洗液中sICAM-1和sCD14的含量(分别是:COPD:152.8vs. 4pg/mL,P<0.001,哮喘:161vs.6.8,P<0.01和COPD:1531vs.363.2pg/mL,P<0.001,哮喘:1433vs.292,P<0.01)。
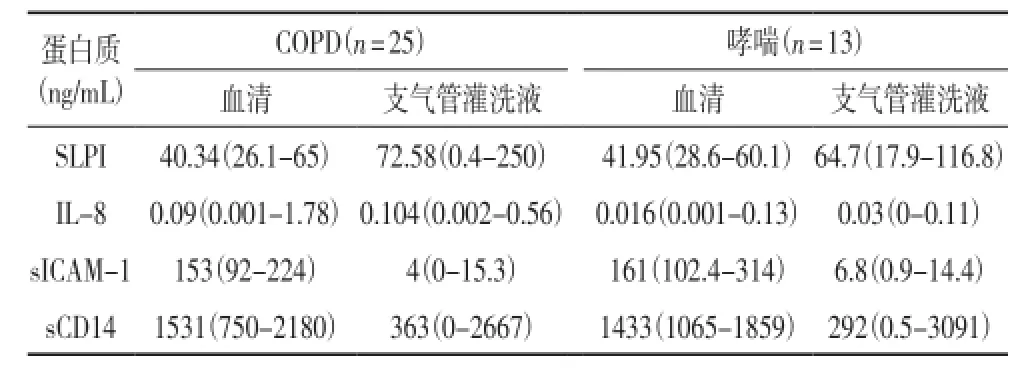
表2 血清与支气管灌洗液中所测变量的含量
2.3哮喘和COPD组生物标志物间关系哮喘患者血清中SLPI含量与血清中sCD14含量存在显著性相关关系,而BAL中SLPI含量与BAL中IL-8含量相关(P<0.05)。FEV1/FVC与血清中sICAM-1含量存在负相关关系(P<0.05),但与支气管灌洗液中sICAM-1的含量成正相关(P<0.05)。
COPD患者BAL中IL-8含量与BAL中SLPI含量显著性相关,且BAL中sICAM-1含量与BAL中sCD14相关。此外,BAL中sCD14含量与血清中SLPI含量负相关(P<0.05),血清中SLPI含量与FEV1/FVC正相关(P<0.05)。所测定的生物标志物与吸烟习惯间无关联。
3 讨论
以往研究表明COPD患者IL-8含量增加,且痰液样本中IL-8含量增加与气道细菌负荷和激活嗜中性粒细胞释放的蛋白酶相关[8,9]。近来Schulz等研究表明,COPD患者构成性的和刺激性IL-8释放要远高于“健康”吸烟者和对照组[10]。与此一致的是,本研究也发现COPD患者支气管灌洗液中IL-8含量高于哮喘患者支气管灌洗液中IL-8含量。值得注意的是,本组患者年龄、性别和吸烟习惯方面差异较大;即哮喘组大多是不吸烟女性,而COPD组主要是吸烟男性。因此,COPD患者IL-8含量高可能与上述两组间差异相关,而两组患者构成一直存在差异。目前已证实吸烟会引起培养人支气管上皮细胞释放IL-8,且非哮喘吸烟者要比不吸烟的BAL样本中嗜中性粒细胞、巨噬细胞和许多细胞因子含量高,包括IL-1β、IL-6、IL-8和单核细胞趋化蛋白-1。至今为止,吸烟对COPD患者病变的影响尚不清楚。需要指出的是,本组25例COPD患者包括4例从不吸烟和11例曾经吸烟。然而,COPD组中支气管灌洗液或血清中IL-8含量与吸烟史并无相关性,提示IL-8释放机制可能取决于多个因素,而不仅仅是吸烟。再者,BAL中IL-8含量与年龄和性别无相关关系。引发、维持和调控IL-8表达与释放的分子机制还没有完全阐明。例如,细菌内毒素和肿瘤坏死因子-α (TNF-α)可以促进上皮细胞分泌IL-8[11]。还有人认为嗜中性粒细胞弹性蛋白酶也可能促进上皮细胞分泌更多的IL-8[12]。研究显示,嗜中性粒细胞弹性蛋白酶可提高人类原代气道上皮细胞SLPI转录[13],同时,COPD和哮喘组中支气管灌洗液中IL-8和SLPI含量间存在直接相关关系。然而,与IL-8作用类似额是,SLPI可能由于细胞内毒素和细胞因子如IL-1和TNFa而上调。
由于COPD和哮喘患者的炎症发生不仅局限于气道,因此反应全身系统性炎症的生物标志物的诊断价值应该高于仅反应肺脏局部炎症的系标志物。Little等研究发现血浆细胞间粘附分子-1(sICAM-1,CD54)和支气管灌洗液中IL-8含量与慢性肺病发展和严重程度相关[14]。COPD患者血浆和支气管灌洗液中sICAM-1含量上升,急性哮喘患者血浆中sICAM-1含量也上升[15,16]。本文实验结果显示COPD和哮喘组中,血浆和支气管灌洗液中sICAM-1含量无显著性差异。然而,需要注意的是哮喘患者FEV1/FVC比值与支气管灌洗液中sICAM-1正相关,但与血浆sICAM-1负相关,这一结果较难以理解。但有研究显示未经治疗哮喘患者支气管上皮细胞ICAM-1过度表达[17]。本组哮喘患者样本采集前至少一个月未经治疗,患者病情稳定,这可能是哮喘患者sICAM-1与肺功能具有相关性的原因。COPD组,支气管灌洗液中sICAM-1与可溶性sCD14存在相关关系。sCD14是急性期蛋白,主要由激活的单核细胞/巨噬细胞和肝细胞释放。CD14可溶形式由膜相关CD14(mCD14)在细胞活化时蛋白质水解脱落产生,且可在支气管灌洗液中按比例检测到可溶性CD14。与支气管灌洗液相比,本研究结果表明血清中sCD14和sICAM-1含量更高。
一般来说,相同炎症标志物在支气管灌洗液中的信号强度强于在血液中的信号强度,但是本研究发现,哮喘和COPD组患者支气管灌洗液中IL-8和SLPI含量远高于血清中含量,而支气管灌洗液中sICAM-1和sCD14含量却远低于血清中含量。众所周知,合成SLPI的主要部位是表面上皮的克拉拉细胞和杯状细胞及粘膜下腺体浆液细胞[18,19]。因此,笔者大胆推测血浆中SLPI含量仅能部分反应气道进行性病变,因此用此来监测实际病情并不灵敏。COPD和哮喘患者中,IL-8、sICAM-1和sCD14间循环相关性和及其与局部分泌的关系仍不清楚。还有一点重要的是为避免得出生物标志物间的错误关联,选定的生物标志物必须符合该病症生化基础的现有知识。
参考文献
[1] 徐镶怀, 邱忠民. 吸入糖皮质激素在稳定期慢性阻塞性肺病中的应用[J]. 临床药物治疗杂志, 2013, 11(2): 10-13.
[2] Doerschuk C M, Alexis N E, Hansel N N, et al. Analyses Of COPD Severity Phenotypes And Emphysema In Spiromics Subjects Stratified By Sputum Granulocytes[J]. Health, 2015, 7(8): 9-11.
[3] Klaassen E M M, van de Kant K D G, Soeteman M, et al. CD14/Tolllike receptors interact with bacteria and regulatory T-cells in the development of childhood asthma[J]. European Respir J, 2014, 44(3): 799-802.
[4] 汪浩, 武晓兰, 谭红霞, 等. IL-8 和 Eotaxin 在哮喘大鼠中的表达及地塞米松的作用[J]. 安徽医科大学学报, 2012, 47(3): 270-273.
[5] Sallenave J M. The role of secretory leukocyte proteinase inhibitor and elafin (elastase-specific inhibitor/skin-derived antileukoprotease) as alarm antiproteinases in inflammatory lung disease[J]. Respir Res, 2000, 1(2): 87-92.
[6] Raundhal M, Morse C, Khare A, et al. High IFN-γ and low SLPI mark severe asthma in mice and humans[J]. J Clin Invest, 2015, 125(8): 3037-3044.
[7] Wu J, Kobayashi M, Sousa EA, et al. Differential proteomic analysis of bronchoalveolar lavage fluid in asthmatics following segmental antigen challenge[J]. Mol Cell Proteomics 2005, 4(9): 1251-64.
[8] 刘茜, 周志益, 李华, 等. 高龄慢性阻塞性肺疾病急性加重期患者IL-8, IL-6, TNF-α 水平变化与肺功能相关性研究[J]. 重庆医学, 2013, 42(17): 1938-1940.
[9] Córdoba-Lanús E, Baz-Dávila R, Espinoza-Jiménez A, et al. IL-8 Gene Variants are Associated with Lung Function Decline and Multidimensional BODE Index in COPD Patients But Not with Disease Susceptibility: A Validation Study[J]. COPD, 2015, 12(1): 55-61.
[10] Schulz C, Wolf K, Harth M, et al. Expression and release of interleukin-8 by human bronchial epithelial cells from patients with chronic obstructive pulmonary disease, smokers, and never-smokers[J]. Respiration 2003; 70(3): 254-261.
[11] 薛翠华, 高振军, 李秋萍, 等. 塞来昔布对大鼠重症急性胰腺炎血清 TNF-A, IL-1B, IL-6 及 IL-8 水平的影响[J]. 江苏大学学报(医学版), 2009, 19(6): 21-25.
[12] 揭志军, 罗勇, 徐卫国, 等. 急性肺损伤患者血清中中性粒细胞弹性蛋白酶活性的变化[J]. 中华急诊医学杂志, 2005, 14(6): 497-499.
[13] Sullivan A L, Dafforn T, Hiemstra P S, et al. Neutrophil elastase reduces secretion of secretory leukoproteinase inhibitor (SLPI) by lung epithelial cells: role of charge of the proteinase-inhibitor complex[J]. Respir Res, 2008, 9(1): 60-65.
[14] 程艳慧, 张勇, 何东初. COPD 患者血清 IL-4, IL-8, TNF-α, CC16水平变化与气道炎症损伤的探讨[J]. 临床肺科杂志, 2010, 15(5): 661-663.
[15] 荣林, 杨文东. 氨溴索注射液辅助治疗 COPD 患者血清 sE-SLT, sICAM-1 水平变化及临床疗效研究[J]. 实用心脑肺血管病杂志, 2011, 19(3): 357-358.
[16] El-Deek SE, Makhlouf HA, Saleem TH, et al. Surfactant protein D, soluble intercellular adhesion molecule-1 and high-sensitivity C-reactive protein as biomarkers of chronic obstructive pulmonary disease[J]. Med Princ Pract, 2013, 22(5): 469-474.
[17] Vignola AM, Campbell AM, Chanez P, et al. HLA-DR and ICAM-1 expression on bronchialepithelial cells in asthma and chronic bronchitis [J]. Am Rev Respir Dis, 1993; 148(3): 689-694.
[18] Jukosky J, Gosselin BJ, Foley L, et al. In vivo Cigarette Smoke Exposure Decreases CCL20, SLPI, and BD-1 Secretion by Human Primary Nasal Epithelial Cells[J]. Frontiers in Psychiatry, 2015, 6(2): 12-18.
[19] Meyer M, Kesic MJ, Clarke J, et al. Sulforaphane induces SLPI secretion in the nasal mucosa[J]. Respir Med, 2013, 107(3): 472-475.
【中图分类号】R563.9
【文献标识码】A
【文章编号】1673-016X(2016)03-0116-05
收稿日期:2016-01-10
通讯作者:杨万勇,E-mail:yangwanyong_dg@163.com
Serum and bronchial lavage fluid concentrations of IL-8, SLPI, sCD14 and sICAM-1 in patients with COPD and asthma
Yang Wan-yong, Chen Bo, Ruan Fu-wang
(Department of Laboratory , Guanghua Hospital of Dongguan, Dongguan 523000, China)
[Abstract]Objectvie To quantify bronchial lavage (BAL) fluid and serum levels of chemokine (IL-8), secretory leukocyte protease inhibitor (SLPI), soluble intracellular adhesion molecules-1 (sICAM-1) and sCD14, as surrogate markers of inflammatory and immune response in asthma and chronic obstructive pulmonary disease (COPD) patients with similar disease duration time. Methods Biomarkers in serum and BAL fluid from asthma (n =13) and COPD (n=25) patients were detected by ELISA . Results We found that in asthma and COPD groups the concentrations of IL-8 and SLPI are significantly higher in BAL fluid than in serum, while levels of sICAM-1 and sCD14 in BAL fluid are significantly lower than in serum. Of these 4 measured biomarkers, only the BAL IL-8 was higher in COPD patients when compared to asthma. In both groups, BAL IL-8 correlated with SLPI. In patients with COPD the BAL sICAM-1 correlated with sCD14, while in asthma patients BAL sICAM-1 correlated with FEV1/FVC. Moreover, in asthma patients the serum SLPI correlated with sCD14 and serum sICAM-1 negatively correlatedwith FEV1/FVC. Conclusion Our findings point to the importance of selecting a correct biological fluid when analyzing specific biomarkers, and also show that of 4 measured biomarkers, only the BAL IL-8 was higher in COPD patients when compared to asthma.
[Key words]asthma; COPD; inflammatory biomarkers; bronchial lavage fluid; serum

