甲基托布津对醉马草种带内生真菌的灭菌活性
李娜娜,赵玉凤,夏 超,钟 睿,张兴旭
(草地农业生态系统国家重点实验室 兰州大学草地农业科技学院,甘肃 兰州 730020)
甲基托布津对醉马草种带内生真菌的灭菌活性
李娜娜,赵玉凤,夏 超,钟 睿,张兴旭
(草地农业生态系统国家重点实验室 兰州大学草地农业科技学院,甘肃 兰州 730020)
摘要:以中国西北天然草原的常见有毒植物——醉马草(Achnatherum inebrians)为研究材料,进行了内吸式杀菌剂——70%甲基托布津(thiophanate methyl)对醉马草种传内生真菌灭菌活性及种子萌发和幼苗生长影响的研究。结果表明,100倍甲基托布津可100%杀灭醉马草种传内生真菌,但该处理会显著降低(P<0.05)醉马草幼苗的发芽指数,而对其它测量指标不造成显著影响(P>0.05);其次为200倍药剂浸泡处理6 h,内生真菌杀灭率仅为61.2%,该处理种子发芽和幼苗生长与100倍药剂处理相比差异显著 (P<0.05)。因此,若不考虑对种子发芽指数造成的影响,甲基托布津稀释100倍、浸种2 h为剔除醉马草种传内生真菌的最佳方法。
关键词:内生真菌;醉马草;内吸式杀菌剂;发芽率;灭菌率
禾草内生真菌(fungal endophyte or endophytic fungi)是指能够在禾草中度过大部分或全部的生命周期,但不使宿主植物显示任何外部症状的一大类真菌[1-2]。根据已有的报道,许多冷季型禾草均被Epichlo⊇属内生真菌所侵染,目前,对禾草内生真菌共生体系的研究,多集中于高羊茅属(Festuca)和黑麦草属(Lolium)。前人的研究表明,内生真菌的侵染可有效提高宿主植物的生物[3-8]和非生物[9-12]抗性,但同时也会诱导宿主植物产生对家畜有毒的生物碱,危害家畜健康,给畜牧业生产带来损失[13-14]。
醉马草(Achnatheruminebrians)为禾本科(Gramineae)芨芨草属(Achnatherum)的多年生草本植物,是我国北方天然草原主要的烈性毒草之一,主要分布在甘肃、新疆、内蒙古、青海、西藏、宁夏、四川、陕西等省(区),河北、山东和浙江也有少量分布[15]。该类禾草生长环境恶劣,在过牧的亚高山草原及高山草原有较大面积的分布[15]。在这类地区,采食醉马草引起的家畜中毒事件时有发生。20世纪90年代,美国和新西兰学者先后从采自我国的醉马草种子中发现了内生真菌,但均未对醉马草内生真菌进行分类学鉴定,直到2004年,我国学者才将分离于甘肃醉马草的内生真菌定名为甘肃内生真菌(Epichlo⊇gansuense)[16]。在随后对醉马草-内生真菌展开的系统研究表明,内生真菌的侵染是造成共生体植物产生有毒生物碱并最终引起家畜中毒的主要原因。同时,内生真菌的侵染也会不同程度地提高醉马草植株对干旱[17-18]、盐碱[17,19]、重金属[20-22]、低温[23-24]、病害[25-28]和虫害[29]等胁迫的抗性。以上研究均表明,无论是对于醉马草内生真菌本身,还是从醉马草内生真菌共生体的整体出发来看,醉马草-内生真菌都具备了较强的研究和利用价值。但不同于高羊茅(Festucaarundinacea)和黑麦草(Loliumperenne),野生醉马草植株具有极高的带菌率。2000年,Nan和Li调查了我国西北草原20个野生醉马草种群,发现其带菌率近乎达到100%[30]。因此,如何有效获取不带菌(endophyte-free,E-)植株,就成为研究和利用醉马草-内生真菌过程中的一个关键问题。目前,仍采用高温、高湿的方法[31]灭除醉马草种子中的内生真菌,此方法虽对内生真菌有较好的杀灭效果,但不可避免地改变了种子的活力,使带菌(endophyte-infected,E+)/不带菌种子在开展研究之初即产生了不可忽略的差异,会对研究结果的准确性带来影响。甲基托布津(thiophanate methyl)是一种强力杀菌剂,具有内吸性强、高效低毒、安全广谱,可与多种杀虫剂、杀螨剂混用等优点,并具有保护和治疗作用,可以防治多种病害,对环境影响较小,对人、畜、天敌和植物都很安全。因此,本研究选取甲基托布津(ghiophanate methyl),设置不同稀释倍数和浸泡时间来处理醉马草种子,以期找到一个合适的稀释倍数和处理时间,能够有效杀灭醉马草种带内生真菌,同时又不对其种子萌发和幼苗生长造成显著影响。
1材料与方法
1.1材料
供试醉马草种子于2013年采自甘肃省肃南县(101°01′ E、38°35′ N,海拔3 297 m),种子通过苯胺蓝染色,镜检测定醉马草种子的侵染率为100%。有效成分70%的甲基托布津(江苏龙灯化学有限公司)由甘肃省农业科学院提供。
1.2试验方法
1.2.1甲基托布津浓度与时间处理本研究采用甲基托布津浓度和时间双因素处理,将甲基托布津用蒸馏水分别稀释100、200、400、600和800倍,并设置蒸馏水处理为对照组(CK),同时设置2、4、6、8和10 h共5个浸泡时间梯度,共计30个处理。取等量种子分别置于不同稀释浓度的甲基托布津药剂中浸泡,期间不断用玻璃棒搅拌,防止药剂产生沉淀。在浸泡2、4、6、8和10 h时分别将种子取出,用蒸馏水冲洗干净,备用。
1.2.2杀菌剂对醉马草种子发芽及幼苗生长影响2014年3月25日采用玻璃培养皿(直径90 mm)进行醉马草种子发芽试验。每皿垫入两层滤纸,将100粒经过不同处理的醉马草种子分别摆放于湿润的滤纸上,随机放入光照周期为16 h光照︰8 h黑暗,温度为25 ℃的培养箱(GXZ-128/158,中国)中,逐日取出统计发芽种子数,加水使滤纸保持湿润后,随机放回培养箱中。整个发芽试验于4月8日结束。其中,每个处理设置5个重复,共计130皿。从每皿中随机选取10株幼苗,分别测量其根苗长及干鲜重,幼苗干重由鲜重经80 ℃烘干至恒重获得。
1.2.3杀菌剂对醉马草种传内生真菌的杀菌率2014年3月25日,以蛭石为培养基质(经120 ℃高温灭菌5 h),将经过不同处理用于发芽试验的同一批醉马草种子栽种于塑料杯(直径75 mm,高度100 mm)中,每杯10株,每个处理4杯。置于光照周期为16 h光照∶8 h黑暗的培养箱中随机摆放,并定期随机调整位置。每日浇水使蛭石保持湿润,待幼苗发芽长出第2片真叶后,开始定量浇灌1/2 Hoagland营养液(表1)。盆栽两个月后,参照Li等[16-17]方法对醉马草幼苗进行带菌率检测。
1.2.4醉马草植株幼苗发芽率、发芽指数的计算每天记录种子发芽数,并连续记录14 d,胚芽突破种皮超过1 mm即为萌发,按照以下公式计算种子发芽率(G)和发芽指数(Gi):
发芽率(G)=发芽数/种子总数×100%;
发芽指数(Gi)=∑(Gt/Dt)。
式中:Gt为第t日的发芽数,Dt为发芽天数[32];
杀菌率(η)=N/No×100%。
式中:η为杀菌率(%),No为幼苗总株数,N为检测后不带菌幼苗数。
1.2.5统计分析试验数据用Microsoft Excel 2013录入并作图。醉马草E+和E-植株幼苗杀菌率、发芽率、发芽指数、苗长、根长和干鲜重的结果均用平均数值加标准误表示。采用SPSS 17.0(Ver. 17.0,SPSS Inc.,Chicago,IL,USA)统计分析软件对上述指标进行单因素和双因素方差分析(ANOVA),采用Duncan法进行多重比较差异显著性。
2结果与分析
2.1甲基托布津对醉马草种传内生真菌杀菌率的影响
从甲基托布津浓度看,稀释100倍对醉马草种传内生真菌具有显著(P<0.05)的杀灭效果,杀菌率达到100%,其它稀释浓度之间的杀菌效果无显著差异(P>0.05)。从浸泡时间看,所有稀释倍数对醉马草种子进行6 h的浸泡处理后达到最大的杀菌效果之后呈现降低的趋势(图1)。
2.2甲基托布津对醉马草种子发芽率及发芽指数的影响
醉马草种子发芽率受浸泡时间(P=0.002)和甲基托布津稀释倍数的影响显著(P=0.025),同时,受浸泡时间和甲基托布津稀释倍数互作的影响亦显著(P=0.011)(表2)。从浸种时间的角度分析,浸种10 h时醉马草种子萌发受到抑制,发芽率显著低于浸种2和8 h,除此之外,其余不同浸种时间对醉马草种子萌发未产生显著影响(P>0.05)(图2)。从甲基托布津稀释浓度角度分析,各浸种时间下,稀释100倍甲基托布津处理种子的发芽率均为最低,其中,浸种4和

表1 Hoagland营养液配方Table 1 Nutritional components of Hoagland’s solution

图1 甲基托布津对醉马草种传内生真菌杀菌率的影响Fig. 1 The sterilizing rate of different thiophanate methyl concentrations and processing times
注:100×、200×、400×、600×和800×分别表示稀释倍数,不同大写字母表示不同浸种时间之间差异显著(P<0.05),不同小写字母表示同一浸种时间不同浓度之间差异显著(P<0.05)。下同。
Note: 100×, 200×, 400×, 600× and 800× are diluted 100, 200, 400, 600 and 800 times, respectively. Different capital letters indicate significant difference among different seed soak times at 0.05 level. Different lower letters indicate significant difference among different dilution multiple at the same seed soak time at 0.05 level. The same below.

表2 甲基托布津对醉马草种子发芽率、发芽指数、根苗长和干鲜重的双因素方差分析Table 2 Two-way analysis of variance treated by difference concentration and time on seed germination rate, germination index, the length of root/seedling and fresh/dry weight of Achnatherum inebrians
注:T=浸泡时间, D=稀释倍数。
Note: T=soaking time, D=dilution multiple.
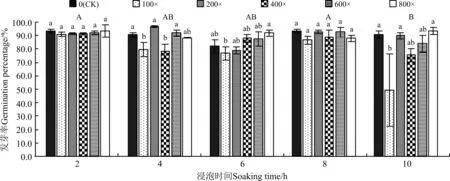
图2 甲基托布津不同处理浓度和处理时间对醉马草种子发芽率的影响Fig.2 Effect of different thiophanate-methyl concentrations and processing times on seed germination percentage of Achnatherum inebrians
10 h后,其发芽率显著低于CK组(P<0.05)。另外,甲基托布津稀释400倍浓度处理种子的发芽率在浸种4 h时,也显著低于除稀释100和800倍浓度外其余稀释浓度处理醉马草种子的发芽率(P<0.05)。
醉马草种子的发芽指数受浸泡时间的影响显著(P=0.012),且受杀菌剂稀释倍数的影响也显著(P=0.000),但是,浸泡时间和杀菌剂稀释倍数的互作效应不显著(P=0.226)(表2)。浸种2-8 h,醉马草种子的发芽指数变化不显著(P>0.05),但浸种10 h后,醉马草种子发芽指数显著低于(P<0.05)浸种2至6 h。浸种2、6和8 h时,稀释100倍甲基托布津处理的种子发芽指数均显著低于其它不同稀释处理组(P<0.05),但其它处理间醉马草种子发芽指数差异不显著(P>0.05);浸种4 h时,稀释200倍甲基托布津处理种子的发芽指数显著高于稀释100和400倍甲基托布津处理种子的发芽指数(P<0.05),与其它处理间均无显著差异(P>0.05);浸种10 h时,稀释100倍甲基托布津处理种子的发芽指数除显著低于CK组外(P<0.05),与其它各处理组间均无显著差异(P>0.05),且其它处理组与CK组间差异不显著(P>0.05)(图3)。

图3 甲基托布津不同处理浓度和处理时间对醉马草种子发芽指数的影响Fig.3 Effect of different thiophanate-methyl concentrations and processing times on seed germination index of Achnatherum inebrians
2.3甲基托布津对醉马草幼苗根、苗长的影响
醉马草种子经甲基托布津处理后,萌发幼苗苗长受种子浸泡时间的影响显著(P=0.000),且受甲基托布津稀释倍数的影响也显著(P=0.048),同时,浸泡时间和杀菌剂稀释倍数的互作效应也显著影响苗长(P=0.033)(表2)。从浸种时间的角度来看,与浸种2 h相比,浸种4至10 h后,醉马草幼苗生长受到显著抑制。浸种4至10 h处理的醉马草种子发芽后,其幼苗苗长显著低于(P<0.05)浸种2 h处理醉马草种子发芽后幼苗苗长。从杀菌剂稀释倍数角度来看,浸种2、4和10 h时,与CK相比,其它稀释浓度的甲基托布津处理并未对幼苗苗长造成显著影响(P>0.05);但浸种6 h时,与CK相比,稀释100倍浓度甲基托布津处理的种子萌发后,幼苗苗长显著降低(P<0.05);浸种8 h时,情况较为复杂,经稀释400倍浓度甲基托布津处理的种子萌发后的苗长最高,显著高于(P<0.05)经稀释100、200倍浓度甲基托布津处理的种子萌发后幼苗苗长(图4)。
醉马草种子经甲基托布津处理后,幼苗根长受种子浸泡时间的影响显著(P=0.014),受杀菌剂稀释倍数的影响不显著(P=0.666),二者互作的效应也不显著(P=0.597)。由双因素方差分析结果得出,经甲基托布津处理的种子萌发后幼苗根长仅受到种子浸泡处理时间的显著影响。因此,仅需从浸种时间对幼苗根长的变化进行分析。随着浸种时间的增加,幼苗的根长基本呈现出下降的趋势。其中,浸种10 h处理的种子萌发后幼苗的根长显著短于除4 h外的(P<0.05)其它浸泡时间处理种子后幼苗的根长(图5)。
2.4甲基托布津对醉马草幼苗干、鲜重的影响
醉马草种子经甲基托布津处理后,萌发幼苗的干、鲜重受种子浸泡时间的影响均不显著(P=0.750,P=0.653),受杀菌剂稀释倍数的影响显著(P=0.012,P=0.026),二者的互作效应亦不显著(P=0.307,P=0.704)。
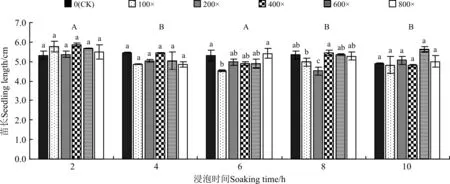
图4 甲基托布津不同处理浓度和处理时间对醉马草幼苗苗长的影响Fig. 4 Effect of different thiophanate-methyl concentrations and processing times on seedling length of Achnatherum inebrians

图5 甲基托布津不同处理时间对醉马草幼苗根长的影响Fig.5 Effect of different thiophanate-methyl processing times on root length of Achnatherum inebrians
注:不同小写字母表示不同浸种时间之间差异显著(P<0.05)。
Note: Different lower case letters indicate significant difference among different seed soaking times at 0.05 level.

图6 甲基托布津不同处理浓度对醉马草幼苗鲜重的影响Fig.6 Effect of different thiophanate-methyl concentrations on fresh weight of Achnatherum inebrians
注:不同小写字母表示不同稀释倍数之间差异显著(P<0.05)。图7同。
Note: Different lower case letters indicate significant difference among different dilution multiples at 0.05 level. The same in Fig.7.

图7 甲基托布津不同处理浓度对醉马草幼苗干重的影响Fig.7 Effect of different thiophanate-methyl concentrations on dry weight of Achnatherum inebrians
3讨论与结论
本研究探讨了内吸式杀菌剂——甲基托布津对醉马草内生真菌的杀菌作用。目前,国内剔除种子内生真菌的方法主要有杀菌剂法[32-33]和湿热法[31]两种。之前,李春杰[31]曾对醉马草内生真菌共生体在不同温度和湿度处理下的生物学和生态学特性进行过探讨,也创建了针对醉马草种子的湿热灭菌法。姚祥等[34]使用两种杀菌剂对中华羊茅(Festucasinensis)种传内生真菌的研究发现,不同稀释倍数的杀菌剂对中华羊茅种传内生真菌有不同的效果。但有关杀菌剂对醉马草内生真菌杀菌的研究还未见报道。国际上,Latch和Christensen[35]、Harvey等[36]和Gundel等[37]以内吸式杀菌剂对多年生黑麦草(Loliumperenne)内生真菌的杀菌进行了研究,均取得了显著的杀菌效果。
在尝试使用杀菌剂剔除醉马草种传内生真菌之前,醉马草的无菌种子均通过高温、高湿法获得。但前人的研究成果表明,虽然高温高湿条件对种传内生真菌有较好的杀灭效果,但都不可避免地改变了种子活力。60 ℃高温处理羽茅(Achnatherumsibiricum)虽有较好的杀菌效果,但处理后的种子幼苗在生长初期根系生长受到了抑制[38]。高温高湿条件对多花黑麦草(Loliummultiflorum)的种传内生真菌有很好的杀灭效果,但是植物种子活力也出现了不同程度的下降[37]。
甲基托布津是一种高效广谱内吸式低毒杀菌剂,对多种植物病毒有预防和治疗作用,是目前我国生产量和使用量均较大的一种杀菌剂。按照化学结构分类,甲基托布津属于取代苯类的杀菌剂,但它在植物体内转化为多菌灵,所以也可归为苯并咪唑类杀菌剂。甲基托布津的杀菌机理与多菌灵相同,主要是通过干扰真菌有丝分裂中纺锤体的形成影响细胞分裂,从而起到杀灭真菌的作用[38]。甲基托布津主要用于叶面喷雾,也可用于土壤处理,残效期为5~7 d,对环境影响较小,对人、畜、天敌和植物都很安全。稀释300~500倍的内吸式杀菌剂甲基托布津和苯醚甲环唑浸种中华羊茅(Festucasinensis)8 h是剔除中华羊茅种传内生真菌的最佳方法[34]。本研究与其结果有一定区别,本研究中,醉马草种传内生真菌的最佳杀灭方法为将甲基托布津稀释100倍、浸种2 h(或稀释200倍、浸种6 h)。这可能与不同物种间植物种子的特异性有关。用40%咪鲜胺乳油2.5 mL·kg-1处理多年生黑麦草种子,虽然种子中的内生真菌被完全剔除,但种子的发芽率也由94%降到了74%[36]。但用40%咪鲜胺乳油以0.25 g·kg-1的剂量处理多年生黑麦草种子,其萌发后幼苗带菌从90%降低到15%,同时种子发芽率还保持在90%以上[35]。这与本研究结果较为相似,本研究利用稀释100倍的甲基托布津浸种2 h的处理方法,处理后可将内生真菌从醉马草种子中完全剔除,灭菌率达100%。虽然该处理显著地降低了(P<0.05)醉马草种子的发芽指数,但并未对种子的发芽率和后续幼苗的生长造成显著影响。
与国内外杀灭内生真菌的研究结果相比,本研究所筛选的70%甲基托布津稀释100倍后浸种2 h的杀菌方法效果良好且不会对种子的发芽率和种子萌发后幼苗的后续生长产生显著影响。同时,甲基托布津作为一种高效低毒的广谱内吸式杀菌剂,广泛应用于多种作物,对植物具有保护和治疗作用[39],利用合理不会对环境造成负面影响,可放心使用[40-41]。
参考文献References:
[1]南志标,李春杰.禾草-内生真菌共生体在草地农业系统中的作用.生态学报,2004,24(3):605-616.
Nan Z B,Li C J.Roles of the grass-Neotyphodiumassociation in pastoral agriculture systems.Acta Ecologica Sinica,2004,24(3):605-616.(in Chinese)
[2]Kuldau G,Bacon C.Clavicipitaceous endophytes:Their ability to enhance resistance of grasses to multiple stresses.Biological Control,2008,46:57-71.
[3]Meister B,Krauss J,Härri S A,Schneider M V,Müller C B.Fungal endosymbionts affect aphid population size by reduction of adult life span and fecundity.Basic and Applied Ecology,2006,7:244-252.
[4]Härri S A,Krauss J,Müller C B.Extended larval development time for aphid parasitoids in the presence of plant endosymbionts.Ecological Entomology,2009,34:20-25.
[5]Saari S,Helander M,Faeth S H,Saikkonen K.The effects of endophytes on seed production and seed predation of tall fescue and meadow fescue.Microbial Ecology,2010,60:928-934.
[6]Vignale M V,Astiz-Gassó M M,Novas M V,Iannone L J.Epichlo⊇ endophytes confer resistance to the smutUstilagobullatain the wild grassBromusauleticus(Trin.).Biological Control,2013,67:1-7.
[7]Mastukara K,Shiba T,Sasaki T,Yoshida K,Matsumura M.Dynamics ofNeotyphodiumuncinatumand N-formyllolinein Italian ryegrass,and their relation to insect resistance in the field.Journal of Applied Microbiology,2014,116:400-407.
[8]Thom E R,Popay A J,Waugh C D,Minneé E K M.Impact of novel endophytes in perennial ryegrass on herbage production and insect pests from pastures under dairy cow grazing in northern New Zealand.Grass and Forage Science,2014,69:191-204.
[9]Malinowski D P,Belesky D P,Lewis G C.Abiotic stresses in endophytic grasses.In:Robert C A,West C P,Spiers D E.(eds).Neotyphodiumin Cool-season Grasses.Oxford,UK:Blackwell Publishing Ltd.,2005:187-199.
[10]Müller C B,Krauss J.Symbiosis between grasses and asexual fungal endophytes.Current Opinion in Plant Biology,2005,8:450-456.
[11]Schardl C L,Grossman R B,Nagabhyru P,Faulkner J R,Mallik U P.Loline alkaloids:Currencies of mutualism.Phytochemistry,2007,68:980-996.
[12]Oberhofer M,Güsewell S,Leuchtmann A.Effects of natural hybrid and non-hybridEpichlo⊇ endophytes on the response ofHordelymuseuropaeusto drought stress.New Phytologist,2014,201:242-253.
[13]Bacon C W,Porter J K,Robbins J D,Luttrell E S.Epichlo⊇ typhina from toxic tall fescue grasses.Applied and Environmental Microbiology,1977,34:576-581.
[14]Fletcher L R,Harvey I C.An association ofLoliumendophyte with ryegrass staggers.New Zealand Veterinary Journal,1981,29:185-186.
[15]史志诚.中国草地重要有毒植物.北京:世界图书出版公司,1997:166-176.
Shi Z C.Important Poisonous Plants of China Grassland.Beijing:China Agriculture Press,1997:166-176.(in Chinese)
[16]Li C J,Nan Z B,Paul V H,Dapprich P D,Liu Y.A newNeotyphodiumspecies symbiotic with drunken horse grass (Achnatheruminebrians) in China.Mycotaxon,2004,90:141-147.
[17]Li C J,Li F,Gou X Y,Nan Z B.Effects of abiotic stresses onAchnatheruminebriansby symbiotic endophyte ofNeotyphodiumgansuense.In:Multifunctional Grasslands in Changing World.Guangzhou:Guangdong People’s Publishing House,2008:819.
[18]李飞.内生真菌对醉马草抗旱性影响的研究.兰州:兰州大学硕士论文,2007.
Li F.Effects of endophyte infection on drought resistance to drunken horse grass (Achnatheruminebrians).Master Thesis.Lanzhou:Lanzhou University,2007.(in Chinese)
[19]缑小媛.内生真菌对醉马草耐盐性的影响研究.兰州:兰州大学硕士论文,2007.
Gou X Y.Effect of Neotyphodium endophyte on salt tolerance to drunken horse grass (Achnatheruminebrians).Master Thesis.Lanzhou:Lanzhou University,2007.(in Chinese)
[20]Zhang X X,Li C J,Nan Z B.Effects of cadmium stress on growth and anti-oxidative systems inAchnatheruminebrianssymbiotic withNeotyphodiumgansuense.Journal of Hazardous Materials,2010,175:703-709.
[21]Zhang X X,Fan X M,Li C J,Nan Z B.Effects of cadmium stress on seed germination,seedling growth and antioxidative enzymes inAchnatheruminebriansplants infected with aNeotyphodiumendophyte.Plant Growth Regulation,2010b,60:91-97.
[22]张兴旭,南志标,李春杰.内生真菌提高禾草耐重金属胁迫的研究进展.草业科学,2014,31(8):1466-1474.
Zhang X X,Nan Z B,Li C J.Research progress of improved resistance of the grass to the heavy metal stress by endophyte.Pratacultural Science,2014,31(8):1466-1474.(in Chinese)
[23]陈娜.醉马草遗传多样性及内生真菌对其抗寒性影响.兰州:兰州大学硕士论文,2008.
Chen N.Genetic diversity of drunken horse grass (Achnatheruminebrians) and effects of its endophyte infection on cold tolerance.Master Thesis.Lanzhou:Lanzhou University,2011.(in Chinese)
[24]陈娜.内生真菌提高醉马草低温萌发能力的分子机制.兰州:兰州大学博士论文,2011.
Chen N.Molecular mechanism involved in low temperature resistance of endophyte-infected drunken horse grass during seed germination.PhD Thesis.Lanzhou:Lanzhou University,2011.(in Chinese)
[25]Li C J,Zhang X X,Li F,Nan Z B,Schardl C L.Disease and pest resistance of endophyte infected and non-infected drunken horse grass.In:Popay A,Thom E R.(eds).Proceedings of the 6th International Symposium on Fungal Endophytes of Grasses.Dunedin,New Zealand:New Zealand Grassland Association,2007:111-114.
[26]Zhang X X,Wu Y P,Nan Z B.Antifungal activity of petroleum ether extracts fromAchnatheruminebriansinfected withNeotyphodiumgansuense.Science China Life Sciences,2014,57:1234-1235.
[27]Zhang X X,Xia C,Li C J,Nan Z B.Chemical composition and antifungal activity of thevolatile oil fromEpichlo⊇ gansuensis,endophyte-infected and non-infectedAchnatheruminebrians.Science China Life Sciences,2015,58:512-514.
[28]Xia C,Zhang X X,Christensen M J,Nan Z B,Li C J.Epichlo⊇ endophyte affects the ability of powdery mildew (Blumeriagraminis) to colonise drunken horse grass (Achnatheruminebrians).Fungal Ecology,2015,16:26-33.
[29]Zhang X X,Li C J,Nan Z B,Matthew C.Neotyphodiumendophyte increasesAchnatheruminebrians(drunken horse grass) resistance to herbivores and seed predators.Weed Research,2012,52:70-78.
[30]Nan Z B,Li C J.Neotyphodiumin native grasses in China and observations on endophyte/host interactions.In:Paul V D,Dapprich P D.(eds).Proceedings of the 4th InternationalNeotyphodium/Grass Interactions Symposium.Paderborn,Soest,Germany:The 4th InternationalNeotyphodium/Grass Interactions Symposium,2000:41-50.
[31]李春杰.醉马草-内生真菌共生体生物学与生态学特性的研究.兰州:兰州大学博士论文,2005.
Li C J.Biological and ecological characteristics ofAchnatheruminebrians/Neotyphodiumendophyte symbiont.PhD Thesis.Lanzhou:Lanzhou University,2005.(in Chinese)
[32]余群,张建全,柴琦,马红梅,魏佳宁,苏黎.硅肥对草地早熟禾种子萌发及幼苗生长的影响.草业科学,2015,32(1):94-100.
Yu Q,Zhang J Q,Chai Q,Ma H M,Wei J N,Su L.Effects of silicon fertilizer on seed germination and growth of Kentucky bluegrass.Pratacultural Science,2015,32(1):94-100.(in Chinese)
[33]朱敏杰,张丽红,任安芝,高玉葆.用丙环唑杀除羽茅内生真菌.南开大学学报,2013,46:88-93.
Zhu M J,Zhang L H,Ren A Z,Gao Y B.Eliminating the endophytic fungi inAchnatherumsibiricumby propiconazole.Acta Scientiarum Naturalium Universitatic Nankaiensis,2013,46:88-93.(in Chinese)
[34]姚祥,李秀璋,朱小晓,李春杰.两种杀菌剂对中华羊茅种传内生真菌的影响.草业科学,2013,30(10):1517-1522.
Yao X,Li X Z,Zhu X X,Li C J.Effects of two fungicides onNeotyphodiumseed-borne fungal endophyte ofFestucasinensis.Pratacultural Science,2013,30(10):1517-1522.(in Chinese)
[35]Latch G C M,Christensen M J.Ryegrass endophyte,incidence and control.New Zealand Journal of Agriculture Research,1982,25:443-448.
[36]Harvey I C,Fletcher L R,Emms L M.Effects of several fungicides on theLoliumendophyte in ryegrass plants,seeds and in culture.New Zealand Journal of Agricultural Research,1982,25:601-606.
[37]Gundel P E,Martinez-Ghersa M A,Batista W B.Dynamics ofNeotyphodiumendophyte infection in ageing seed pools:Incidence of differential viability loss of endophyte,infected seed and non-infected seed.Annals of Applied Biology,2010,156:199-209.
[38]李夏,韩荣,任安芝,高玉葆.高温处理构建不感染内生真菌羽茅种群的方法探讨.微生物学通报,2010,37:1395-1400.
Li X,Han R,Ren A Z,Gao Y B.Using high-temperature treatment to construct endophyte-freeAchnatherumsibiricum.Microbiology China,2010,37:1395-1400.(in Chinese)
[39]Gundel P E,Martinez-Ghersa M A,Garibaldi L A,Ghersa C M.Viability ofNeotyphodiumendophytic fungus and endophyte-infected and noninfectedLoliummultiflorumseeds.Botany,2009,87:88-96.
[40]桂炳中.多菌灵、苯菌灵和甲基托布津的科学使用.科学种养,2008(2):7.
[41]许圭南.70%甲基托布津可湿性粉剂通过部级技术鉴定.精细与专用化学品,1988,11:38.
Xu G N.70% thiophanate-methyl WP through ministerial technical appraisal.Fine and Specialty Chemicals,1988,11:38.(in Chinese)
(责任编辑武艳培)
DOI:10.11829/j.issn.1001-0629.2015-0680
*收稿日期:2015-12-04接受日期:2016-03-04
基金项目:国家基础研究发展计划“973”(2014CB138702);国家自然科学基金(31402132);中央高校基本科研业务费(Lzujbky-2016-12、lzujbky-2016-177、Lzujbky-2016-192);教育部创团队发展计划项目(IRT13019)
通信作者:张兴旭(1983-),男,甘肃临泽人,副教授,硕导,博士,研究方向为禾草内生真菌及其次生代谢产物学。E-mail:xxzhang@lzu.edu.cn
中图分类号:S432
文献标志码:A
文章编号:1001-0629(2016)7-1306-09*
Corresponding author:Zhang Xing-xuE-mail:xxzhang@lzu.edu.cn
Effects of thiophanate methyl on seed borneEpichlo⊇ fungal endophyte ofAchnatheruminebrians
Li Na-na, Zhao Yu-feng, Xia Chao, Zhong Rui, Zhang Xing-xu
(State Key Laboratory of Grassland Agro-ecosystems, College of Pastoral Agriculture Science and Technology, Lanzhou University, Lanzhou 730020, China)
Abstract:Achnatherum inebrians, a common toxic perennial bunchgrass in natural grassland of northwest China, was studied to explore the effect of systemic fungicide, thiophanate methyl(Tm), on fungal endophyte of A. inebrians at different concentrations and soak times. Tm had five concentrations and five distinct soak times respectively. The results of fungicide experiment indicated that the Tm diluted 100 times (100 Tm) was the most effective, but it significantly (P<0.05) decreased the germination index of seeds. Except the 100 Tm, the 200 times dilution Tm combined with 8 h treatment was considered to be the most effective which reduced the seeds infection rate of fungal endophyte from 100% to 38.8%, and did not significantly (P>0.05) affect the growth of seedlings. In conclusion, without regard to the seed germination index, the most effective way to kill the seed borne fungal endophyte was 100 times dilution Tm combined with 2 h treatment.
Key words:endophyte; Achnatherum inebrians; systemic fungicide; germination rate; disinfection rate
李娜娜,赵玉凤,夏超,钟睿,张兴旭.甲基托布津对醉马草种带内生真菌的灭菌活性.草业科学,2016,33(7):1306-1314.
Li N N,Zhao Y F,Xia C,Zhong R,Zhang X X.Effects of thiophanate methyl on seed borneEpichlo⊇ fungal endophyte ofAchnatheruminebrians.Pratacultural Science,2016,33(7):1306-1314.
第一作者:李娜娜(1991-),女,甘肃静宁人,在读硕士生,研究方向为禾草-内生真菌共生体。E-mail:linn15@lzu.edu.cn

