炭载Pt基催化剂上甘油氧化反应路径的探究
董 华,雷佳契,段学志,钱 刚,周兴贵
华东理工大学化学工程联合国家重点实验室,上海 200237
炭载Pt基催化剂上甘油氧化反应路径的探究
董 华,雷佳契,段学志,钱 刚,周兴贵
华东理工大学化学工程联合国家重点实验室,上海 200237
结合透射电镜(TEM)和X射线光电子能谱(XPS)等表征技术,比较研究了碳纳米管(CNTs)负载的单金属Pt和双金属Pt-Sb催化剂的结构及其非碱性条件下催化甘油氧化反应的性能与路径。结果表明:Sb的引入对催化剂的粒径以及Pt电子性质的影响较小,但Sb可能选择性沉积在Pt原子表面形成空间位阻,控制甘油的转化向有利于其仲羟基氧化的方向进行,从而改变了反应的选择性和路径。Pt/CNTs催化剂主要选择性氧化甘油的伯羟基生成甘油醛(GLYD)和甘油酸(GLYA),GLYA再进一步氧化生成羟基丙酮酸(HPYA)和亚酒石酸(TA);Pt-Sb/CNTs催化剂则优先氧化甘油的仲羟基生成二羟基丙酮(DHA),DHA进一步氧化生成HPYA;两种反应路径下生成的HPYA和TA最终都会氧化断键生成乙醇酸(GLYCA)等产物。
甘油氧化 炭载Pt基催化剂 反应路径
甘油具有伯位和仲位两种羟基官能团,是一种最具应用和发展前景的生物质转化平台化合物。甘油的转化途径主要有氧化、氢解、脱水、重整和酯化反应等[1]。其中,以负载型贵金属为催化剂、分子氧或空气为氧化剂在非碱性水溶液中氧化甘油制备二羟基丙酮(DHA)被认为是一条经济、绿色的工艺路线,具有潜在的工业应用价值。DHA作为一种重要的化工原料,用于化妆品可对皮肤具有防晒功效;作为药物,可用于糖尿病的辅助治疗;此外DHA还可用作果蔬及肉制品的保鲜剂[2]。目前,DHA主要通过微生物发酵法制备,但该法时间长、目标产物收率低。
近年来,已有大量文献报道了贵金属(Au、Pd、Pt)在助剂(Bi、Sb、Ag等)修饰的作用下可以选择性催化氧化甘油制备DHA[3-12]。Kimura等[5]最早研究发现单金属Pt/AC催化剂上甘油氧化生成DHA的选择性最高只有10%,而经过Bi修饰后该催化剂上DHA的选择性得到显著提高。Liang等[7]的研究结果也表明Pt-Bi/CNTs催化剂可以高选择性地催化氧化甘油生成DHA,但同时他们也发现DHA的选择性随着甘油转化率的升高而不断降低。Nie等[8]首次报道了Pt-Sb双金属催化剂用于甘油氧化反应,发现转化率达到90%时,仍然维持了较高的转化频率(TOF = 229.0 h-1)、DHA选择性(51.4%)以及C3总选择性(90.6%),表明Pt-Sb双金属催化剂能够维持较高的DHA选择性并有效抑制反应过程中C—C键的断裂。由此可见,Pt-Sb双金属催化剂是氧化甘油制备DHA的高效且稳定的催化剂。
甘油的催化氧化是一个复杂的反应体系,包括多个平行和串联反应,可以生成DHA、甘油醛(GLYD)和甘油酸(GLYA)等多种产物,并且最终的产物分布取决于催化剂以及反应条件的选择。为了更好地控制甘油催化氧化反应的方向,尽可能地提高目标产物的收率,认识和理解不同催化剂上甘油氧化反应的路径显得尤其重要。因此,本工作将比较研究碳纳米管(CNTs)负载的Pt及Pt-Sb催化剂上甘油在非碱性条件下氧化反应的路径,以期为最大化地提高DHA的收率提供一定的指导。
1 实验部分
1.1 催化剂的制备
以原始的CNTs(纯度99.8%,且两端闭合)为载体、氯铂酸和三氯化锑为活性组分前驱体,通过等体积共浸渍法制备单金属Pt/CNTs和双金属Pt-Sb/CNTs催化剂。Pt/CNTs催化剂中Pt的负载量为5%(质量分数),Pt-Sb/CNTs双金属催化剂中Pt、Sb的负载量分别为5%、1%。浸渍后的样品在室温下静置12 h,然后置于80 ℃烘箱内干燥12 h,最后经过H2还原活化以及钝化处理后待用。
1.2 催化剂的表征
1.2.1 物理吸附(N2-BET)
采用ASAP 2010(Micromeritics,美国)型物理吸附仪来表征催化剂的结构性质(孔径、孔容、比表面积等)。样品(0.1 g)首先在200 ℃和133 Pa条件下真空脱气6 h,然后在液氮(-196 ℃)环境中进行测定。
1.2.2 透射电镜(TEM)
采用JEM 2100(JOEL,日本)型透射电镜观察催化剂颗粒大小及形貌。仪器操作电压为200 kV,点分辨率为0.23 nm,线分辨率为0.14 nm。样品制备过程如下:取少量样品置于无水乙醇中,经超声充分分散,取一定量的悬浮液滴加到微栅上,待乙醇挥发后进行TEM表征。
1.2.3 X射线光电子能谱(XPS)
采用Axis Ultra DLD(Kratos,日本)X射线光电子能谱仪表征催化剂的电子性质。仪器采用Al Kα靶,高压14.0 kV,功率300 W,通能93.9 eV,分析室真空度为1.33×10-7Pa。分别采集样品的0~1 200 eV的全扫描谱,以及Pt、Sb和C元素的窄扫描谱。以C 1s(284.6 eV)为基准校正各金属元素的结合能。
1.3 甘油氧化反应考评
1.3.1 甘油氧化反应
在三口烧瓶中加入0.1 g/mL的甘油水溶液30 mL和一定量的新鲜催化剂,在不断搅拌的条件下将其温度升至60 ℃并保持恒温,通入O2(流量为150 mL/min),同时开启冷凝水,进行反应并开始计时。每隔1 h取样,样品经0.22 μm针头式过滤器过滤后用超纯水稀释至所需倍数,进入高效液相色谱分析。反应结束后,分离催化剂和反应液,称量剩余反应液的质量,计算转化率与选择性。
1.3.2 产物分析
考虑到甘油及其氧化产物均不易挥发,本实验采用Agilent 1100 series高效液相色谱对其进行分析。色谱柱为BP-OA,2000-0(Æ300 mm×7.8 mm),柱温80 ℃;流动相为磷酸水溶液(w)0.1%,0.5 mL/min;选择灵敏度较高的二极管阵列(DAD)检测器检测甘油的氧化产物,通过对不同紫外光波段的扫描,发现在波长210 nm处各产物的紫外吸收峰最强,因此,本实验选择210 nm的波长对产物进行分析。由于甘油不吸收紫外光,因此采用串联的示差检测器(RID)对其进行检测。
首先采用高效液相色谱分别检测甘油氧化产物及其标样的DAD响应信号,并比较其对应的保留时间,从而确定各物质的归属。图1为甘油氧化产物标样的色谱图,产物按出峰顺序依次为草酸、亚酒石酸、甘油酸、甘油醛、乙醇酸和二羟基丙酮,从图中可以看出几种产物标样的色谱峰之间都达到了基线分离,表明在此色谱操作条件下产物的分离效果较好。在此基础上,使用外标法计算液相产品中各组分的浓度。
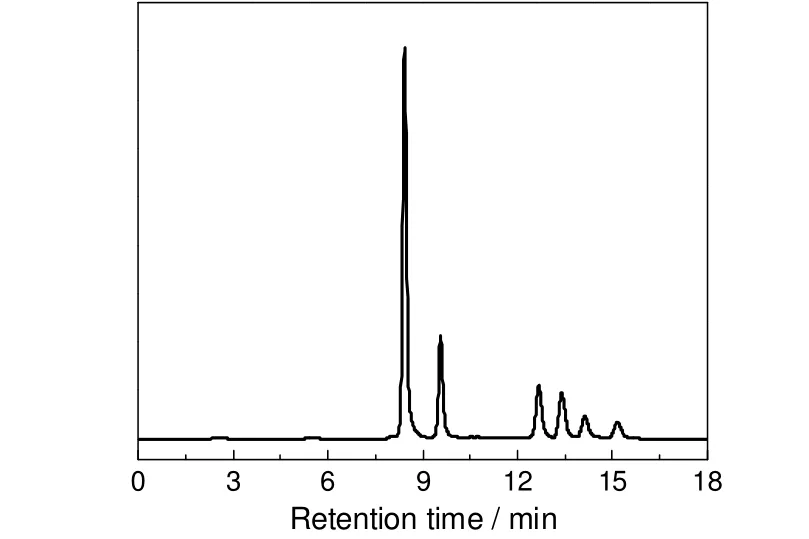
图1 甘油氧化反应产物标样的HPLC分析图谱Fig.1 HPLC chromatogram for standard sample of glycerol oxidation products
2 结果与讨论
2.1 催化剂的物理性质
由表1中列出的CNTs载体与单金属5Pt/CNTs和双金属5Pt-1Sb/CNTs催化剂的比表面积可以看出,相比于CNTs,负载后的5Pt/CNTs和5Pt-1Sb/CNTs催化剂的比表面积有所降低,但两种催化剂的比表面积相近,且绝大多数为外比表面积。由于本研究采用的碳纳米管为两端闭合的,且在使用前未经任何预处理,因此可以认为催化剂金属活性位主要位于碳纳米管的外表面,在催化过程中可以被充分利用。

表1 CNTs及5Pt/CNTs和5Pt-1Sb/CNTs催化剂的比表面积Table 1 The specific surface area for CNTs, 5Pt/CNTs and 5Pt-1Sb/CNTs catalysts
图2为单金属5Pt/CNTs和双金属5Pt-1Sb/CNTs催化剂的TEM图及其对应的粒径分布,其中催化剂平均粒径由下式计算得到:ni表示具有特征粒径为di的颗粒的数目。
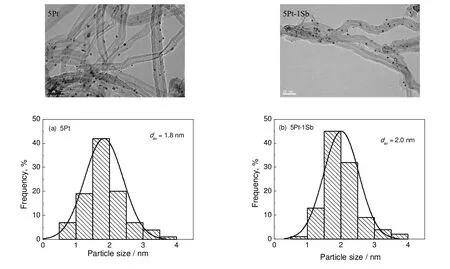
图2 催化剂的透射电镜结果及相应的粒径分布Fig.2 TEM images and the corresponding size distribution for catalysts
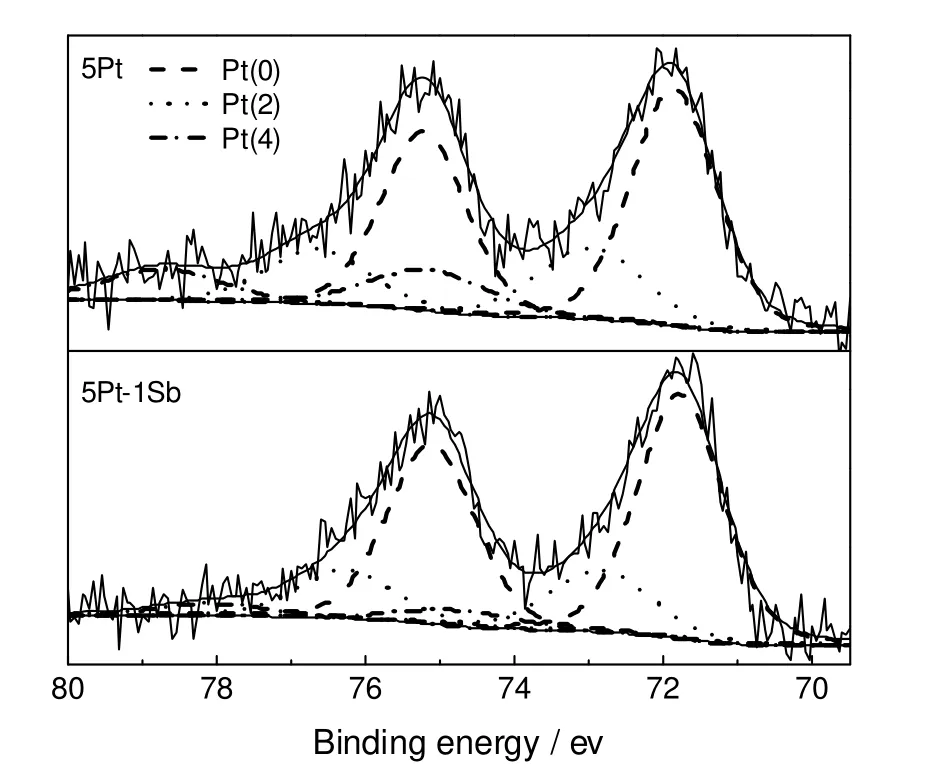
图3 催化剂的XPS图谱Fig.3 XPS analysis for catalysts
由图2可知,两种催化剂颗粒均高度分散于载体表面,对应的粒径大小都呈现正态分布,且粒径分布较窄。根据统计,5Pt/CNTs和5Pt-1Sb/CNTs催化剂颗粒平均大小分别为1.8 nm和2.0 nm,可见,少量Sb的引入并没有导致催化剂粒径的明显变化,两种催化剂具有相似的粒径分布。
2.2 催化剂的电子性质
采用XPS进一步分析了催化剂的电子性质,结果如图3所示。可以看出,两种催化剂中Pt都存在三种价态,分别为Pt(0)、Pt(2)和Pt(4),其中零价态的Pt占有较大的比例。单金属5Pt/CNTs催化剂中零价态Pt的4f7/2分裂轨道的结合能为71.9 eV,而双金属5Pt-1Sb/CNTs催化剂中相应的结合能为71.8 eV,出现了轻微地结合能负位移,表明Sb的引入并没有显著改变Pt的电子结构与性质。然而,Sb修饰后的Pt-Sb/CNTs双金属催化剂中Pt(4)的含量却明显降低,表明Sb的引入一定程度上促进了Pt的还原。
2.3 甘油氧化反应路径的探索
图4为两种催化剂上甘油氧化主要产物DHA、GLYA和GLYD的选择性随甘油转化率的变化关系。结果发现:相同转化率时,相比较于单金属5Pt/CNTs催化剂,双金属5Pt-1Sb/CNTs催化剂上甘油氧化生成DHA的选择性大幅增加,GLYD和GLYA的选择性则大大降低。

图4 单金属5Pt/CNTs和双金属5Pt-1Sb/CNTs催化剂上甘油氧化结果Fig.4 Glycerol oxidation over 5Pt/CNTs and 5Pt-1Sb/CNTs catalysts
由此可见,助剂Sb的引入大大提高了目标产物DHA的选择性,即Sb修饰后的5Pt-1Sb/CNTs催化剂更有利于优先氧化甘油的仲羟基,从而生成更多的DHA。上述催化剂结构表征的结果表明单金属5Pt/CNTs和双金属5Pt-1Sb/CNTs催化剂具有相似的比表面积和粒径,且Pt的电子性质并未由于Sb的引入而发生明显变化,因此,两种催化剂上甘油氧化反应中目标产物DHA选择性的显著差异可能主要是由于Sb对Pt的空间位阻效应[5]所致,即Sb原子可能选择性沉积在Pt原子表面并形成亚单原子层,其空间位阻作用使得甘油的吸附朝有利于其仲羟基氧化的方向进行,从而大幅度提高了双金属5Pt-1Sb/CNTs催化剂上DHA的选择性。另外,实验中还发现,单金属5Pt/CNTs催化剂上氧化甘油生成的GLYD会快速转化为GLYA,从而导致GLYD的选择性急速下降。进一步地分析了两种催化剂上甘油氧化反应过程中产物DHA的浓度随时间的变化关系,如图5所示。由图可知,在双金属5Pt-1Sb/CNTs催化剂上,当反应进行到2 h左右,反应液中DHA的浓度达到峰值,继续反应,DHA的浓度开始下降,表明DHA逐步转化为其它产物。因此,适时地控制反应的进程,减少DHA的进一步转化,可以最大化地得到目标产物DHA。而在单金属5Pt/CNTs催化剂上,随着反应的进行,DHA的浓度几乎保持不变,但由图5可知,5Pt/CNTs催化剂上DHA的选择性逐渐降低,由此可见,DHA可能处于动态的生成与再转化的平衡过程。
为了深入地探索5Pt-1Sb/CNTs催化剂上甘油氧化反应的路径,分别采用DHA和GLYA为反应底物作进一步研究,结果如图6所示。
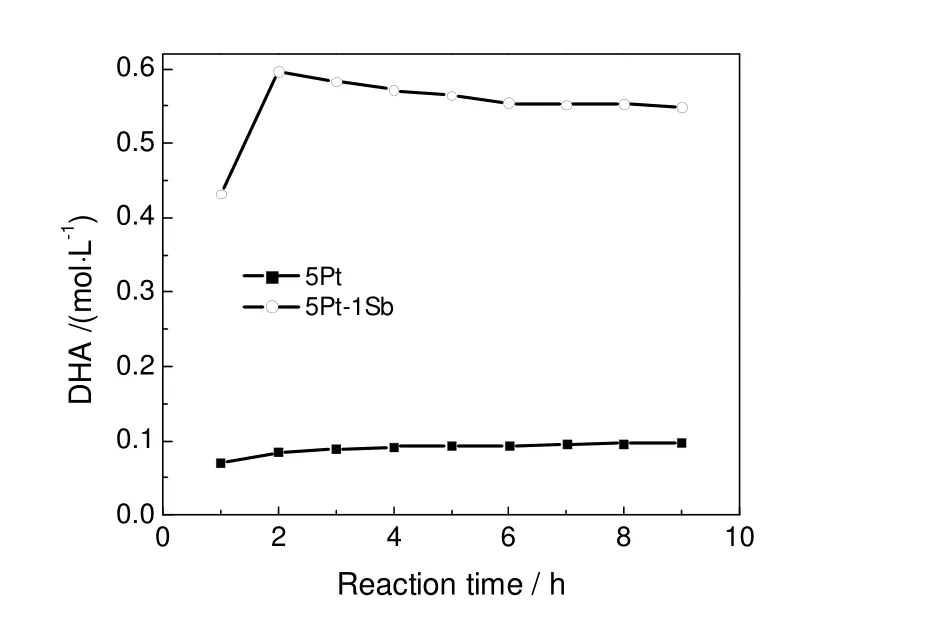
图5 DHA的浓度随时间的变化关系Fig.5 Change of DHA concentration with reaction time
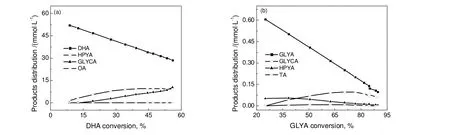
图6 催化剂5Pt-1Sb/CNTs上DHA(a)和GLYA(b)氧化产物分布Fig.6 Product distribution for DHA(a) and GLYA(b) oxidation over 5Pt-1Sb/CNTs catalyst
由图6(a)可知,反应起始时DHA主要转化生成羟基丙酮酸(HPYA),且随着反应的进行,HPYA的浓度基本保持不变,表明HPYA生成的同时又可能被氧化成其它产物。此外,反应过程中可以检测到较多的乙醇酸(GLYCA)以及微量的草酸(OA),并且GLYCA的浓度随着DHA的转化逐渐增加,表明反应过程中DHA的氧化产物HPYA会进一步氧化断键生成GLYCA等C2产物。5Pt-1Sb/CNTs催化剂上GLYA的转化情况如图6(b)所示:反应起始时,GLYA主要氧化生成HPYA以及少量的亚酒石酸(TA),但HPYA不稳定,会快速氧化断键转化成GLYCA,且反应后期GLYCA的浓度也开始下降,表明GLYCA也可能深度氧化断键生成C1产物,如CO等。
类似地,研究了单金属5Pt/CNTs催化剂上DHA、GLYD和GLYA氧化反应的产物分布,结果如表2所示。DHA的氧化产物主要以HPYA为主,HPYA会进一步氧化生成GLYCA和少量的OA,这与5Pt-1Sb/CNTs催化剂上的反应产物分布类似。GLYD在反应过程中不稳定,会快速转化成GLYA。而GLYA的主要氧化产物为HPYA,同时也会生成少量的TA。此外,以上C3产物会进一步深度氧化断键生成GLYCA。

表2 单金属Pt/CNTs催化剂上DHA、GLYD和GLYA氧化反应的产物分布Table 2 Products distribution for DHA, GLYD and GLYA oxidation over Pt/CNTs catalyst
基于以上讨论,构建了单金属Pt/CNTs和双金属Pt-Sb/CNTs催化剂在非碱性条件下催化甘油氧化反应的路径,如图7所示。其中,实线代表双金属Pt-Sb/CNTs催化剂上甘油氧化反应的路径,该催化剂有利于氧化甘油的仲羟基生成DHA,并进一步氧化生成HPYA,而HPYA会深度氧化断键生成GLYCA等C2产物;虚线代表单金属Pt/CNTs催化剂,该催化剂主要氧化甘油的伯羟基生成GLYD,而GLYD会快速转化生成GLYA,并进一步氧化生成HPYA和TA,生产的C3产物会深度氧化断键生成C2和C1产物。
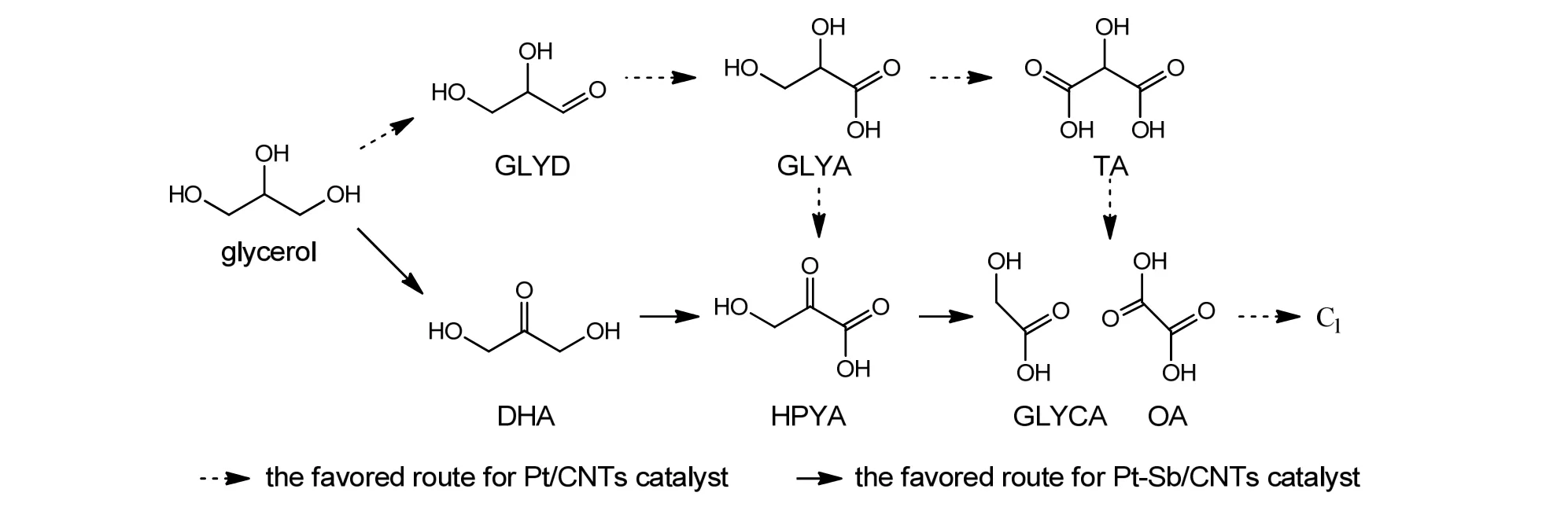
图7 单金属Pt/CNTs和双金属Pt-Sb/CNTs催化剂上甘油氧化反应路径的探索Fig.7 Possible reaction pathway for glycerol oxidation over Pt/CNTs and Pt-Sb/CNTs catalysts
3 结 论
本工作系统研究了单金属Pt/CNTs以及助剂Sb修饰后的双金属Pt-Sb/CNTs催化剂上甘油在非碱性条件下氧化反应的性能及可能的路径。TEM和XPS等表征技术以及反应考评结果表明,Sb的引入对催化剂的粒径及Pt电子性质的影响较小,但Sb可能对Pt形成空间位阻,控制甘油的转化向有利于其仲羟基氧化的方向进行,从而显著改变了反应的选择性。进一步地,结合反应中间产物DHA、GLYD和GLYA的考评结果,初步提出了甘油氧化反应的路径:单金属Pt/CNTs催化剂主要选择性氧化甘油的伯羟基生成GLYD,GLYD会快速转化成GLYA,并进一步氧化生成HPYA以及TA;双金属Pt-Sb/CNTs催化剂优先氧化甘油的仲羟基生成DHA,DHA进一步氧化生成HPYA。以上两种反应路径生成的HPYA和TA最终都会氧化断键生成GLYCA等C2产物和C1产物。两种催化剂上甘油氧化反应路径的比较研究为最大化地提高DHA的收率提供了一定的指导。
[1] Zhou C H C, Beltramini J N, Fan Y X, et al. Chemoselective catalytic conversion of glycerol as a biorenewable source to valuablecommodity chemicals [J]. Chem Soc Rev, 2008, 37(3):527-549.
[2] Katryniok B, Kimura H, Skrzyńska E, et al. Selective catalytic oxidation of glycerol: perspectives for high value chemicals [J]. Green Chem, 2011, 13(8):1960-1979.
[3] Hirasawa S, Watanabe H, Kizuka T, et al. Performance, structure and mechanism of Pd-Ag alloy catalyst for selective oxidation of glycerol to dihydroxyacetone [J]. J Catal, 2013, 300:205-216.
[4] Brett G L, He Q, Ceri H, et al. Selective oxidation of glycerol by highly active bimetallic catalysts at ambient temperature under base-free conditions [J]. Angew Chem Int Ed, 2011, 50(43):10136-10139.
[5] Kimura H, Tsuto K, Wakisaka T, et al. Selective oxidation of glycerol on a platinum-bismuth catalyst [J]. Appl Catal A: Gen, 1993,96(2):217-228.
[6] Hu W, Knight D, Lowry B, et al. Selective oxidation of glycerol to dihydroxyacetone over Pt-Bi/C catalyst: optimization of catalyst and reaction conditions [J]. Ind Eng Chem Res, 2010, 49(21):10876-10882.
[7] Liang D, Cui S Y, Gao J, et al. Glycerol oxidation with oxygen over bimetallic Pt-Bi catalysts under atmospheric pressure [J]. Chin J Catal, 2011, 32(11):1831-1837.
[8] Nie R, Liang D, Shen L, et al. Selective oxidation of glycerol with oxygen in base-free solution over MWCNTs supported PtSb alloy nanoparticles [J]. Appl Catal B: Environ, 2012, 127:212-220.
[9] Zalineeva A, Serov A, Padilla M, et al. Self-supported PdxBi catalysts for the electrooxidation of glycerol in alkaline media [J]. JACS,2014, 136(10):3937-3945.
[10] Hu W, Lowry B, Varma A. Kinetic study of glycerol oxidation network over Pt-Bi/C catalyst [J]. Appl Catal B: Environ, 2011,106(1):123-132.
[11] Worz N, Brandner A, Claus P. Platinum-Bismuth-catalyzed oxidation of glycerol: kinetics and the origin of selective deactivation [J]. J Phys Chem C, 2009, 114(2):1164-1172.
[12] Villa A, Campisi S, Chan-Thaw C E, et al. Bismuth modified Au-Pt bimetallic catalysts for dihydroxyacetone production [J]. Catal Today, 2015, 249:103-108.
Reaction Pathways for Glycerol Oxidation over Carbon Nanotubes Supported Pt Based Catalysts
Dong Hua, Lei Jiaqi, Duan Xuezhi, Qian Gang, Zhou Xinggui
State Key Laboratory of Chemical Engineering, East China University of Science and Technology, Shanghai 200237, China
Comparative studies of the structure and catalysis of the oxidation of glycerol over Pt/CNTs and Pt-Sb/CNTs catalysts under base-free conditions were performed and the corresponding possible reaction pathways were proposed by using the transmission electron microscopy (TEM), X-ray photoelectron spectroscopy (XPS) and other characterization techniques. The addition of Sb to the catalyst has been found to have almost no effects on the particle size and electronic properties of Pt. However, Sb may be selectively deposited on the surface of Pt atom and sterically control the conversion of glycerol in an orientation favorable to its secondary hydroxyl group, thus changing the selectivity of the reaction path. The monometallic Pt/CNTs catalyst preferred to oxide the primary hydroxyl groups of glycerol, generating glyceraldehyde (GLYD) and then glyceric acid (GLYA), which was further oxidized into hydroxypyruvic acid (HPYA) and tartronic acid (TA), while the bimetallic Pt-Sb/CNTs catalyst favored for the oxidation of the secondary hydroxyl group of glycerol, generating dihydroxyacetone (DHA) and was further transformed into HPYA. Both the produced HPYA and TA during the two reaction routes could eventually be oxidized to glycolic acid (GLYCA) and other products by the cleavage of C-C bond.
glycerol oxidation; carbon nanotubes supported Pt based catalysts; reaction pathway
TQ203.2
A
1001—7631 ( 2016 ) 03—0217—07
2016-03-31;
2016-05-19。
董 华(1989—),男,硕士研究生;钱 刚(1974—),男,副研究员,通讯联系人。E-mail:carlqg@ecust.edu.cn。

