CCAAT/增强子结合蛋白同源蛋白与钙联蛋白在内侧颞叶癫痫模型小鼠海马中的表达
沙志强,沙龙泽,许 琪
中国医学科学院基础医学研究所 北京协和医学院基础学院 生物化学与分子生物学系医学分子生物学国家重点实验室,北京 100005
·论著·
CCAAT/增强子结合蛋白同源蛋白与钙联蛋白在内侧颞叶癫痫模型小鼠海马中的表达
沙志强,沙龙泽,许琪
中国医学科学院基础医学研究所北京协和医学院基础学院生物化学与分子生物学系医学分子生物学国家重点实验室,北京 100005
摘要:目的观察CCAAT/增强子结合蛋白同源蛋白(CHOP)及钙联蛋白(CNX)在内侧颞叶癫痫小鼠海马区域中表达的时间和空间分布。方法采用海人酸(KA)诱导内侧颞叶癫痫小鼠模型,免疫印迹和免疫荧光技术检测CHOP和CNX在急性期(12、24 h)小鼠海马CA3区的表达量及分布差异,并与注射PBS的正常小鼠进行对照。结果免疫印迹检测结果显示,KA注射后12 h小鼠海马中的CHOP(F=1.136,P=0.4069)和CNX表达量(F=2.378,P=0.2087)与对照组差异没有统计学意义,KA注射后24 h注射侧海马中的CHOP(F=8.510,P=0.0362)和CNX表达量(F=6.968,P=0.0497)明显高于对照组。免疫荧光结果显示,KA注射后12 h CHOP的表达主要集中于CA3区,注射后24 h 在CA1和CA3区表达水平均升高;KA注射后24 h CHOP蛋白(F=24.480,P=0.0057)和CNX蛋白(F=7.149,P=0.0478)的表达量显著高于对照组。结论伴随着癫痫发作的产生,CHOP蛋白表达量上升,提示神经元内质网应激水平不断增加,可能需要更多CNX作为分子伴侣帮助更多未折叠蛋白完成折叠过程。
关键词:内侧颞叶癫痫;内质网应激;CCAAT/增强子结合蛋白同源蛋白;钙联蛋白
ActaAcadMedSin,2016,38(3):265-270
内侧颞叶癫痫(medial temporal lobe Epilepsy,mTLE)是一种常见的神经系统疾病,以脑部神经元的过度同步化放电和自发反复性的癫痫发作为主要临床表现[1],也是常见的药物难治性癫痫[2],其反复性发作的致病灶位于硬化的海马。尽管mTLE的临床表现各有不同,但仍具有以下相似的病理表现:(1)神经元丢失,尤其是CA1和CA3的椎体神经元;(2)胶质细胞增生;(3)门区苔状纤维发芽[3]。其超微结构的变化表现为:(1)胞浆浓缩,细胞内细胞器减少;线粒体膨胀,内质网扩张;(2)核膜模糊,染色质浓缩,部分与核膜融合;(3)出现凋亡小体的[4]。目前对于癫痫发生过程中细胞内环境改变的分子机制尚不十分清楚,因此,探寻细胞内环境改变潜在的蛋白表达模式对研究mTLE的发生及发展有着重要的意义。
CCAAT/增强子结合蛋白同源蛋白(CCAAT/enhancer-binding protein homologous protein,CHOP)是经典的内质网应激标志物之一,可通过形成异源二聚体与靶基因结合参与细胞分化、凋亡及炎症等过程[5- 8]。Sokka等[9]研究发现,利用海人酸(kainic acid,KA)诱导的癫痫大鼠模型可引起海马神经元内质网应激现象,而真核起始因子2α(eukaryotic initiation 2α,eIF2α)磷酸化抑制剂能有效降低KA诱导的内质网应激效应及神经元凋亡,提示内质网应激效应参与了由谷氨酸受体激活介导的细胞毒性产生过程,进而可能参与癫痫发生过程。钙联蛋白(calnexin,CNX)作为细胞中重要的类凝集素伴侣分子,参与了许多重要的生物学功能,包括辅助糖蛋白的折叠和装配,并参与内质网蛋白质量控制系统及内质网相关蛋白的降解途径,可缓解内质网应激及调节细胞内钙离子稳态。Murphy等[10]通过体外实验发现,离体海马培养在培养基中加入KA后,CNX表达量会随着细胞凋亡进程而显著增加,提示CNX参与了细胞凋亡进程,同时也可能与mTLE的病理表现相关。本研究观察了癫痫模型鼠海马中CHOP及CNX的表达量和空间分布情况,初步探究了两种蛋白与癫痫发生的关系。
材料和方法
材料SPF级C57BL/6雄性8周龄小鼠24只(北京维通利华有限公司),体重18~20 g;电动10%水合氯醛溶液(北京协和医院),KA(美国Sigma公司),Alex488 anti-Rabbit二抗(美国Invitrogen公司),CNX(美国Stressgen公司);CHOP(美国Bioworld公司);DAPI(美国Invitrogen公司);进样器(中国,深圳沃瑞德科技有限公司),手持式颅骨钻(中国,深圳沃瑞德科技有限公司),脑力体定位仪(深圳瑞沃德生命科技有限公司),LEICA EG1150H包埋机、LEICA RM2255 石蜡切片机、LEICA荧光倒置显微镜(美国Leica公司)。
癫痫小鼠模型的建立及分组用100 μl 10%水合氯醛溶液经腹腔注射小鼠,10 min后按住小鼠腿部无震颤性动作后视为麻醉成功。将小鼠固定于立体定位仪,门齿置于门齿钳,双耳插入耳杆,使其两端平衡。将小鼠头部毛发剪净,剪开头皮,用3%双氧水清洗头皮黏膜,暴露头骨,以前卤点为原点,于前卤点后2.0 mm、矢状线旁向右1.8 mm用黑色marker笔标注。将微型电动颅钻的档位调成4号档,用镊子将周围头皮拉开,使电钻垂直于颅骨钻开直径约1 mm的孔洞,随后将微量进样针缓慢插入脑组织,深度为2.3 mm,注入50nl PBS(对照组,n=3)或200ng KA(实验组,n=3),注射后留针2 min防止药物回流。抽出进样针,缝合头皮,适量涂抹青霉素软膏防止感染,随即将小鼠置于37 ℃热台上,待其恢复放回笼中。
免疫荧光检测注射药物12、24 h后,将小鼠用4%多聚甲醛进行心脏灌流处理,然后取脑,并放入4%多聚甲醛48 h,然后换80%乙醇浸泡48 h,包埋切片。在进行免疫荧光检测,先脱蜡至水,然后在柠檬酸-柠檬酸钠溶液中高温高压抗原修复5 min,待溶液温度降至室温后,取出切片加入3%BSA室温封闭1 h。加入用1%BSA稀释的一抗,4 ℃孵育过夜,然后用加入1‰Tween- 20的0.01 mol/L PBS清洗3×15 min,加入用1%BSA稀释的二抗,室温孵育1 h,然后再次用1‰Tween- 20的0.01 mol/L PBS清洗3×15 min,加入用0.01 mol/L PBS稀释的DAPI核染料,室温孵育5 min,最后用0.01 mol/L PBS清洗后,封片、拍照。
免疫印迹检测将蛋白样品与上样缓冲液混合,上样至电泳。浓缩胶电泳电压 80V,电泳时间约10 min,当样品至分离胶时,调节电压至120V,电泳时间约1.5 h。采用湿法转膜(NC膜),恒流 300 mA,4 ℃转膜1 h。转膜后将膜从电转槽中取出,浸没于事先配置好的封闭液中,室温摇荡1 h。一抗和抗体稀释液按照 1∶1000 的比例配置,将 NC 膜放入抗体稀释液,4 ℃孵育过夜。用TBST进行3×15 min洗膜,然后用NC方法二抗稀释液,室温孵育1 h,再次用TBST进行3×15 min洗膜,最后采用ECL法曝光显影。
统计学处理免疫荧光和免疫印迹实验结果采用Image J软件进行荧光强度与灰度值分析。采用Prism5.0统计软件,组间比较采用ANOVA分析,P<0.05为差异有统计学意义。
结果
造模情况对照组小鼠注射PBS后生命活动正常,未发现明显的行为学异常及癫痫样发作。实验组小鼠注射KA几分钟后即呈现面部肌肉抽搐等表现;麻醉缓解后,小鼠呼吸急促,表现出节律性点头样发作、咀嚼及磨牙等行为,注射KA 20 min后出现前肢抽搐性发作,随后渐渐减弱,1.5~3 h后渐渐恢复正常。
CHOP在癫痫发作急性期的表达免疫印迹结果显示,KA注射后12 h小鼠海马中的CHOP表达量略高于对照组小鼠,但差异没有统计学意义(F=1.136,P=0.4069);KA注射后24 h注射侧海马中的CHOP表达量明显高于对照组(F=8.510,P=0.0362)(图1A、B)。免疫荧光结果显示,KA注射后12 h CHOP的表达主要集中于CA3区(图1C、D);注射后24 h CHOP蛋白不仅在CA1与CA3区表达水平升高(F=24.480,P=0.0057),表达CHOP的神经元数量也增加,在门区及齿状回颗粒下层(subgranular zone,SGZ)区域同时也有低水平表达(图2)。
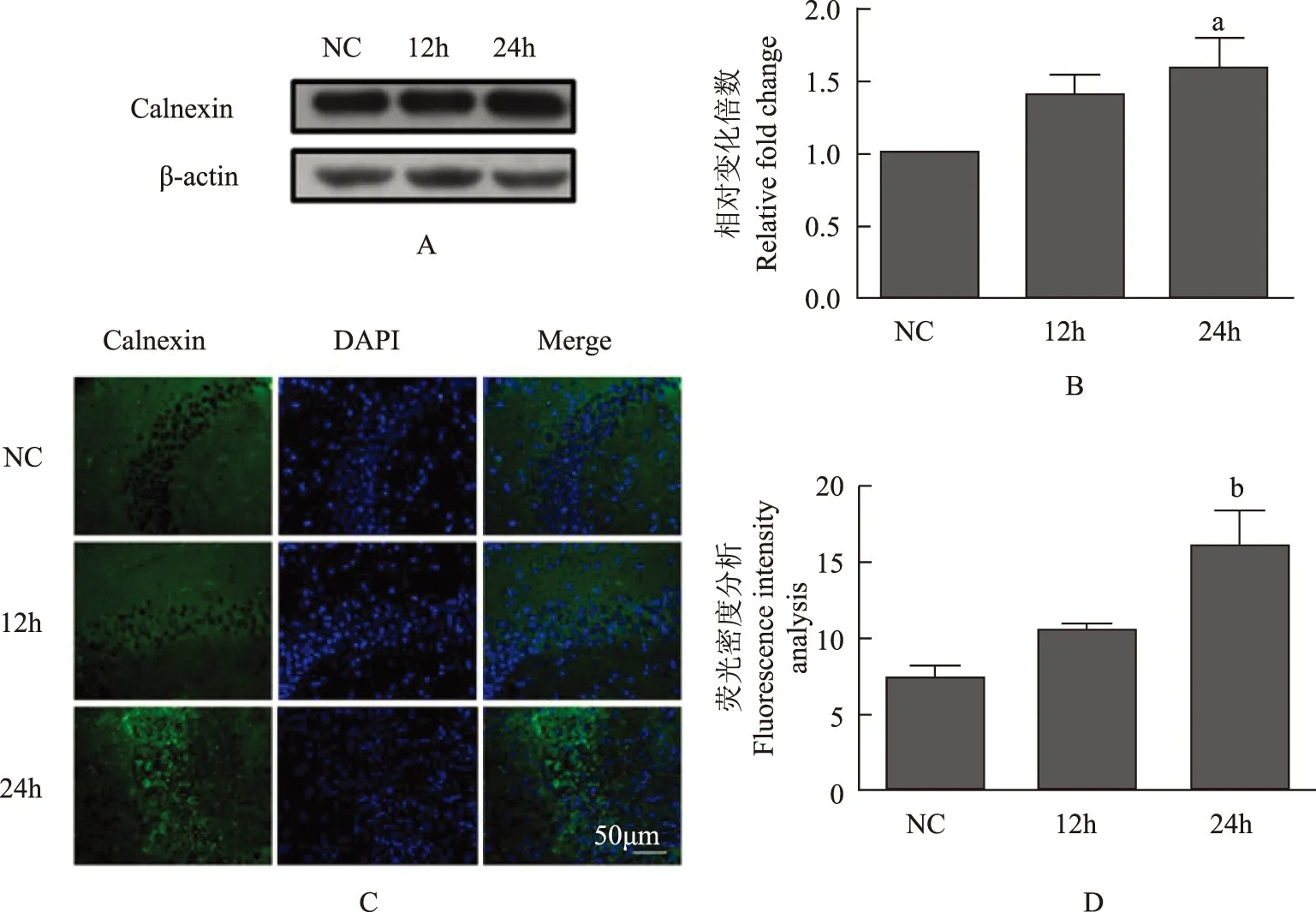
CNX在癫痫发作急性期的表达免疫印迹结果显示,KA注射后12 h小鼠海马中的CNX表达水平与对照组差异没有统计学意义(F=2.378,P=0.2087),注射后24 h CNX表达量则显著高于对照组(F=6.968,P=0.0497)(图3A、B)。免疫荧光结果显示,KA注射后24 h CNX在CA3区的表达量显著高于对照组(F=7.149,P=0.0478)(图3C、D)。
讨论
长期癫痫反复发作可伴随神经元坏死、丢失及胶质细胞增生和海马硬化等病理表现。已有研究表明,反复癫痫发作1 h或惊厥发作0.5 h以上都会产生神经元不可逆性损伤。内质网应激在神经系统疾病,如帕金森、老年痴呆和阿尔茨海默病等中的作用已有广泛研究[11]。Kitao等[12]研究发现,内质网应激同样参与了谷氨酸诱导的兴奋性脑损伤。Sokka等[9]在体内外实验中均发现,CHOP蛋白在KA注射后24 h的癫痫大鼠海马CA3区表达量显著增加。Chen等[13]利用戊四唑(pentylenetetrazol,PTZ)诱导的癫痫大鼠模型,在mRNA和蛋白水平也得出类似结论,即注射12 h后,CHOP在 mRNA水平达到峰值,而24 h时蛋白水平才达到最大值。Engel等[14]通过杏仁核注射KA诱导癫痫小鼠模型发现,CHOP蛋白表达量在注射后8 h达到峰值,在注射后24 h又逐渐降低至注射开始时的水平,推测这可能是由于不同建模方法所导致的。本研究通过海马注射KA药物诱导癫痫小鼠模型,在蛋白及组织学层面验证注射KA后24 h,CHOP的表达量显著增强,但在空间表达分布却呈现出与Chen等[13]实验结果不一致之处,即:注射KA后12 h,CHOP的表达主要集中于CA3区,而Chen等[13]在PTZ建立的癫痫鼠模型中未发现12 h时间点CHOP表达量上调的迹象;在注射后24 h,CHOP蛋白不仅在CA1和CA3区表达水平升高,且表达CHOP的神经元数量也增加,同时门区及SGZ区域的神经元细胞中也有低水平表达,而Chen等[13]在注射药物24 h后只观察到海马CA3区CHOP表达量上调,并未发现其他区域表达上调现象。尽管如此,以上结果仍提示内质网应激参与了谷氨酸诱导的兴奋性神经元损伤的过程。

与对照组比较,aF=8.510,P=0.0362;bF=0.3907,P=0.7000;cF=24.480,P=0.0057
aF=8.510,P=0.0362;bF=0.3907,P=0.7000;cF=24.480,P=0.0057 compared with the control group
A. KA注射后12和24 h,CHOP蛋白在小鼠海马注射侧表达量升高;B.免疫印迹结果统计分析;C.KA注射后12和24 h,CHOP蛋白在注射侧海马CA3区中的染色情况;D. 免疫荧光结果统计分析
A. increased expression level of CHOP in the hippocampus 12 h and 24 h after KA injection;B. statistical analysis of Western blotting findings;C. immunostaining of CHOP in the CA3 of hippocampus 12 h and 24 h after KA injection;D. statistic analysis of immunofluorescence determination results
图 1KA注射后12和24 h,注射侧海马CA3区域中 CHOP表达量的免疫印迹及免疫荧光强度分析(n=3)
Fig 1Western blot analysis and fluorescence intensity analysis of CHOP expression level in the CA3 of hippocampus 12 h and 24 h after KA injection(n=3)
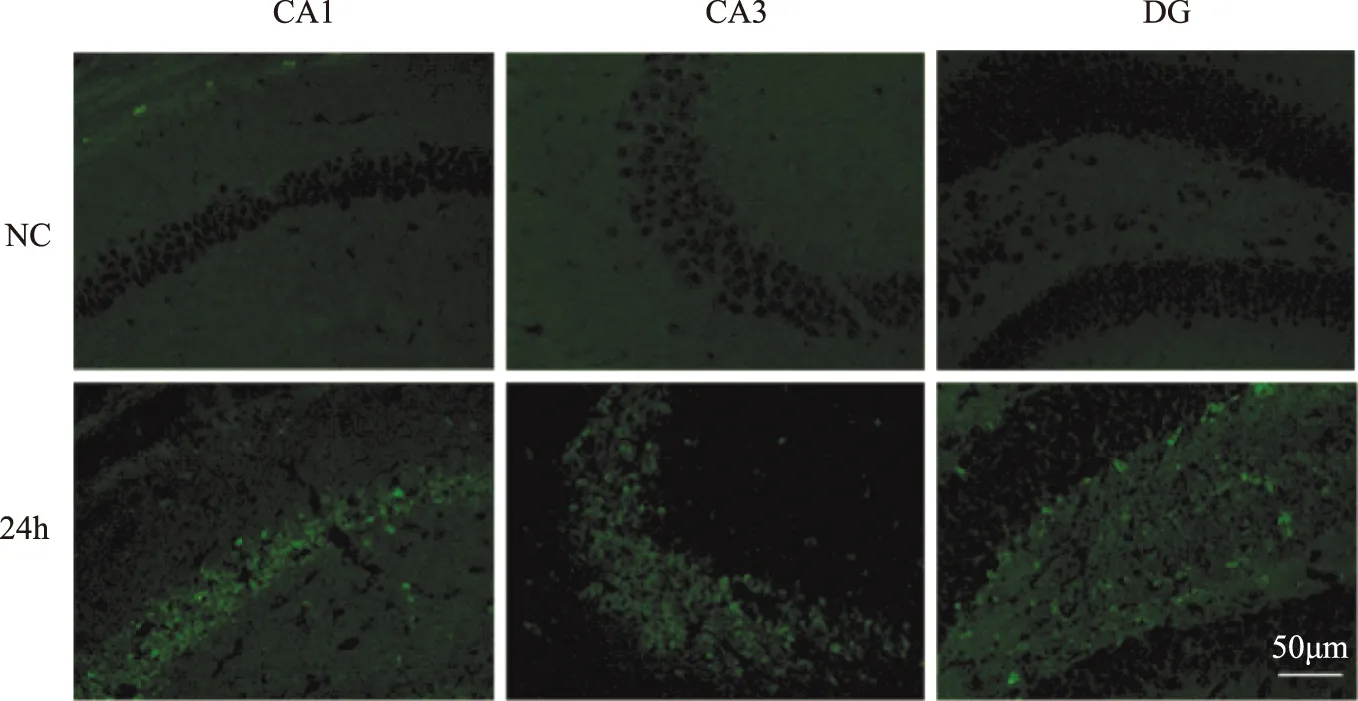
图 2CHOP蛋白在KA注射24 h后注射侧海马区域的空间表达分布
Fig 2Spatial distribution of CHOP in the hippocampus 24 h after KA injection
与对照组比较,aF=6.968,P=0.0497;bF=7.149,P=0.0478
aF=6.968,P=0.0497;bF=7.149,P=0.0478 compared with the control group
A. KA注射后12和24 h,钙联蛋白在小鼠海马注射侧表达量升高;B.免疫印迹结果统计分析;C.KA注射后12和24 h,钙联蛋白在小鼠注射侧海马CA3区中的染色情况;D. 免疫荧光结果统计分析
A. increased expression level of calnexin in the hippocampus 12 h and 24 h after KA injection in the mTLE mouse models;B. statistical analysis of Western blotting findings;C. immunostaining of calnexin in the CA3 of hippocampus 12 h and 24 h after KA injection;D. statistic analysis of immunofluorescence determination results
图 3KA注射后12 h与24 h,注射侧海马CA3区域中的 Calnexin表达量免疫印迹及免疫荧光强度分析(n=3)
Fig 3Western blot analysis and fluorescence intensity analysis of calnexin expression level in the CA3 of hippocampus 12 h and 24 h after KA injection(n=3)
CNX作为内质网中重要的分子伴侣参与了内质网蛋白质的合成过程,具有重要的生物学功能。当细胞中未折叠蛋白数量增加时,CNX可延长与错误折叠蛋白或未成熟折叠蛋白的结合时间,并使其停留于内质网中完成正确折叠。当细胞内钙离子稳态失衡或在外界极端条件刺激下导致的过多蛋白分泌及未成熟折叠的蛋白增加时,都可以形成内质网应激,应激信号传入细胞核时,会引起一些诱导细胞凋亡的基因表达。Murphy等[10]利用体外培养海马组织发现,在培养基中加入KA 24 h后,海马中的CNX蛋白表达量升高,提示CNX可能作为一种保护性适应参与的癫痫发生进程。本研究结果显示,KA注射24 h急性期癫痫小鼠海马中CNX表达量显著高于对照组,与以往结果一致,提示CNX可能参与了神经元损伤修复及保护性适应过程。但本研究还显示,KA注射后12 h CHOP表达量上调的同时,CNX并没有及时表达升高,且在注射后24 h只在CA3区表达略有升高,而在CA1区表达量并未显著高于对照组,提示CNX可能并非是首要感受未折叠蛋白或协助完成蛋白加工折叠过程的分子伴侣。
综上,本研究结果显示,在癫痫小鼠模型的急性期中,CHOP和CNX的表达量随着癫痫发生时间的推移而显著上调,提示在神经元丢失进程中有内质网应激反应的参与,同时CNX也可能参与了神经元保护性适应及损伤修复等过程。
参考文献
[1]Engel J Jr. Mesial temporal lobe epilepsy:what have we learned[J]. Neuroscientist,2001,7(4):340- 352.
[2]Lee YJ,Kang HC,Bae SJ,et al. Comparison of temporal lobectomies of children and adults with intractable temporal lobe epilepsy[J]. Childs Nerv Syst,2010,26(2):177- 183.
[3]D’Souza B,Miyamoto A,Weinmaster G. The many facets of Notch ligands[J]. Oncogene,2008,27(38):5148- 5167.
[4]Rickert CH. Cortical dysplasia:neuropathological aspects[J]. Childs Nerv Syst,2006,22(8):821- 826.
[5]Bek MF,Bayer M,Muller B,et al. Expression and function of C/EBP homology protein (GADD153) in podocytes[J]. Am J Pathol,2006,168 (1):20- 32.
[6]Xu C,Bailly-Maitre B,Reed JC. Endoplasmic reticulum stress:cell life and death decisions[J]. J Clin Invest,2005,115 (10):2656- 2664.
[7]Li X,Huang HY,Chen JG,et al. Lactacystin inhibits 3T3-L1 adipocyte differentiation through induction of CHOP- 10 expression[J]. Biochem Biophys Res Commun,2006,350 (1):1- 6.
[8]Endo M,Mori M,Akira S,et al. C/EBP homologous protein (CHOP) is crucial for the induction of caspase- 11 and the pathogenesis of lipopolysaccharide-induced inflammation[J]. J Immunol,2006,176 (10):6245- 6253.
[9]Sokka AL,Putkonen N,Mudo G,et al. Endoplasmic reticulum stress inhibition protects against excitotoxic neuronal injury in the rat brain[J]. J Neurosci,2007,27(4):901- 908.
[10]Murphy N,Bonner HP,Ward MW,et al. Depletion of 14- 3- 3 zeta elicits endoplasmic reticulum stress and cell death,and increases vulnerability to kainate-induced injury in mouse hippocampal cultures[J]. J Neurochem,2008,106 (2):978- 988.
[11]Lindholm D,Wootz H,Korhonen L. ER stress and neurodegenerative diseases[J]. Cell Death Differ,2006,13 (3):385- 392.
[12]Kitao Y,Ozawa K,Miyazaki M,et al. Expression of the endoplasmic reticulum molecular chaperone (ORP150) rescues hippocampal neurons from glutamate toxicity[J]. J Clin Invest,2001,108 (10):1439- 1450.
[13]Chen J,Zheng G,Guo H,et al. Role of endoplasmic reticulum stress via the PERK signaling pathway in brain injury from status epilepticus[J]. J Mol Neurosci,2014,53 (4):677- 683.
[14]Engel T,Sanz-Rodgriguez A,Jimenez-Mateos EM,et al. CHOP regulates the p53-MDM2 axis and is required for neuronal survival after seizures[J]. Brain,2013,136 (Pt 2):577- 592.
基金项目:国家自然科学基金(31222031)和协和青年科研基金(2012J09)Supported by the National Natural Sciences Foundation of China (31222031) and the Union Youth Science & Research Fund (2012J09)
通信作者:许琪电话:010- 69156432,电子邮件:xuqi@pumc.edu.cn
中图分类号:R43
文献标志码:A
文章编号:1000- 503X(2016)03- 0265- 06
DOI:10.3881/j.issn.1000- 503X.2016.03.004
Corresponding author:XU QiTel:010- 69156432,E-mail:xuqi@pumc.edu.cn
(收稿日期:2015- 01- 26)
Expressions of CCAAT/enhancer-binding Protein Homologous Protein and Calnexin in the Hippocampus of a Mouse Model of Mesial Temporal Lobe Epilepsy
SHA Zhi-qiang,SHA Long-ze,XU Qi
State Key Laboratory of Medical Molecular Biology,Department of Biochemistry and Molecular Biology,Institute of Basic Medical Sciences,CAMS and PUMC,Beijing 100005,China
ABSTRACT:ObjectiveTo explore the temporal and spatial distribution of CCAAT/enhancer-binding protein homologous protein (CHOP) and calnexin (CNX) in the dentate gyrus of mesial temporal lobe epilepsy (mTLE) mouse model. MethodsWe used kainic acid (KA) to induce acute phase (12 h and 24 h) mTLE mouse models and performed Western blotting and immunofluorescence to detect the different expressions and distribution pattern of CHOP and CNX in CA3 of the hippocampus. ResultsCompared with the controls,the expressions of CHOP(F=1.136,P=0.4069) and CNX (F=2.378,P=0.2087) did not increase in CA3 of hippocampus 12 h following KA injection in the acute phase of mTLE mouse models,whereas the expressions in CA1 and CA3 of hippocampus 24 h after injection were significantly higher (F=8.510,P=0.0362;F=6.968,P=0.0497,respectively). As shown by immunofluorescence analysis,CHOP was expressed mainly in CA3 of hippocampus 12 h after KA injection,and increased in CA1 and CA3 24 h after KA administration. Compared with the controls,the expressions of CHOP(F=24.480,P=0.0057) and CNX (F=7.149,P=0.0478) were significantly higher 24 h after KA injection.ConclusionsThe expression of CHOP increases along with the progression of seizures,indicating the increased level of endoplasmic reticulum stress. An increasing number of CNX,which serves as molecular chaperone,may be needed to facilitate the unfolded protein to complete the folding process.
Key words:mesial temporal lobe epilepsy;endoplasmic reticulum stress;CCAAT/enhancer-binding protein homologous protein;calnexin

