miRNA失控表达在乳腺癌耐药中的研究进展
许雷来朱星瑜谢璐帆谢小红
miRNA失控表达在乳腺癌耐药中的研究进展
许雷来1朱星瑜1谢璐帆1谢小红2
乳腺癌:化疗耐药;microRNA;失控表达
乳腺癌是世界第二大常见肿瘤,是女性最常见的肿瘤。2012年新发肿瘤中乳腺癌占25%[1]。化疗、内分泌治疗及靶向治疗联合的综合治疗是乳腺癌的主要治疗方式之一。据报道,治疗过程中约有70%的乳腺癌患者对化疗、内分泌治疗出现耐药性[2]。无论是原发耐药还是继发耐药都会大大影响乳腺癌患者的无病生存时间(disease-free survival,DFS)及总生存时间(overall survival,OS)。microRNA(miRNA)是一种非编码的小分子RNA,与乳腺癌的发生、发展、侵袭及转移密切相关。有证据表明miRNA在乳腺癌治疗药物敏感性方面有着决定性的调控作用,其具体机制的探索可为研发新的治疗药物提供方向[3]。本文对miRNA在乳腺癌耐药中的研究进展进行综述。
1 乳腺癌耐药机制
1.1 药物转运化疗药物的耐药机制与药物转运和代谢的蛋白密切相关,被称为ATP结合盒蛋白家族(ATP-binding cassette,ABC),其主要成员ABCA~ABCG分别调控12种药物转运相关蛋白,包括P-糖蛋白(P-glycoprotein,P-gp)、多药耐药相关蛋白1(MDR-associated protein 1)。这些蛋白在癌细胞对药物的吸收、清除中起重要作用。乳腺癌耐药的患者往往高表达ABC蛋白[4]。
1.2 DNA修复一般细胞的DNA损伤后细胞周期随即停滞并进行DNA修复,待DNA修复后细胞周期恢复正常。在肿瘤细胞中,由于细胞周期检验点反应缺陷,当肿瘤细胞遭受化疗药物损伤时,可通过激活周期检验点反应阻滞细胞周期进程,加强损伤修复,导致耐药表型的产生[5]。
1.3 细胞凋亡许多化疗药物被证明是通过诱导细胞发生凋亡从而发挥抗肿瘤作用,而这一过程的核心环节是胱天蛋白酶(caspases)的活化。死亡受体被激活后促发了caspase级联反应,形成死亡诱导信号复合体(death-inducing signaling complex)触发细胞凋亡。整个过程受到肿瘤坏死因子家族(外源性)和Bcl-2家族(内源性)的调控,为肿瘤耐药的发生提供可能[6]。
1.4 肿瘤干细胞(CSCs)和上皮间质转化(EMT)乳腺癌干细胞(BCSCs)是一群未分化、具有自我更新、多系分化潜能并以CD44+/CD24-为表型的细胞。传统的化疗药物主要针对增殖旺盛的细胞,而肿瘤干细胞多处于G0期,不合成DNA或进行细胞分裂,因而能够逃避化疗药物的杀伤而得以存活,存活的干细胞分裂生成祖细胞。一旦化疗,祖细胞受周围环境中相关因子的激活进入细胞周期,分裂分化成肿瘤细胞及化疗耐药表型[7]。上皮间质转化(EMT)即上皮细胞在胚胎发育过程中或病理状态下转化为具有间充质特点的间叶细胞的现象。有证据表明EMT与肿瘤干性密切相关,进一步研究发现,体外发生EMT的细胞表现出肿瘤干细胞的特性[8-9]。
2 miRNA功能及生物起源
目前认为miRNA是一个内源性19~22号核苷酸长链非编码RNA分子,在基因调控表达方面起到了巨大的作用[10]。miRNA成熟过程大致概括起来为[11]:(1)通过RNA聚合酶II在不同区域转录mRNA基因形成pri-miRNA;(2)经过核酸内切酶RNaseⅢDrosha及其辅助因子DGCR8的识别和作用后形成60~75nt的miRNA前体(pre-miRNA);(3)pre-miRNA被细胞质中的Dicer酶切割成20~25nt双链的miRNA,我们称之为miRNA:miRNA*配对分子(miRNA*为miRNA的互补序列);(4)成熟的miRNA从miRNA:miRNA*配对分子分离,与核糖核酸组合形成沉默诱导复合体(miRISC),并结合于靶mRNA而发挥基因负调控作用。其主要机制有两种:(1)对靶mRNA剪切:miRNA与靶mRNA完全互补或几乎完全互补,miRNA引导Ago-2对靶mRNA进行特异性切割,通常在植物中存在这种机制;(2)对靶mRNA翻译的阻遏:miRNA与靶mRNA不完全互补,进行不完全互补结合从而抑制mRNA的翻译,一般在大多数动物体内存在。比较特别的是在人体中,miRNA不止能在翻译的起始和延伸阶段抑制翻译过程,而且可以诱导靶mRNAs的脱腺苷化帽子结构的去除和降解。
3 乳腺癌中miRNA失控表达
miRNA根据其表达水平可分为上调型和下调型,也被称为癌基因和抑癌基因。研究表明,miRNA在乳腺癌的复发、侵袭、转移中起到非常重要的作用[12]。miRNA在乳腺癌中不同的表达水平影响着化疗药物的药效,提示miRNA可作为乳腺癌耐药的治疗靶点,见表1。
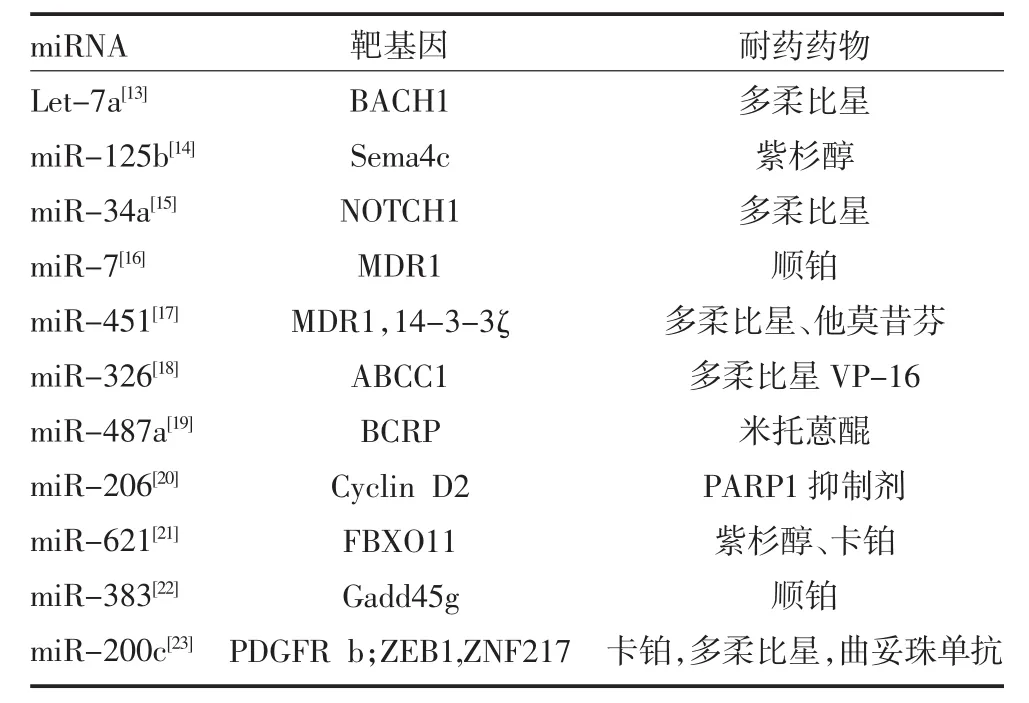
表1 乳腺癌耐药相关miRNA
4 miRNA参与乳腺癌耐药机制
4.1 miRNA与ABC转运蛋白
4.1.1 miRNA与P-糖蛋白(P-glycoprotein,P-gp)P-gp由ABCB1基因编码,其过表达导致多药耐药(MDR)的发生,并与紫杉烷类及蒽环类化疗药物耐药密切相关[23]。ABCB1启动子区的低甲基化及组蛋白修饰的改变造成了ABCB1表达的上升,使得越来越多的乳腺癌细胞发生耐药。研究[24]发现,相比较于常规MCF-7细胞系,P-gp在多柔比星(DOX)耐药的乳腺癌细胞系MCF-7/DOX中表达水平更高。对MCF-7/DOX细胞进行miRNA芯片检测,结果发现miR-451表达下调。通过细胞转染miR-451增加其表达后,MCF-7/DOX对DOX的药物敏感性上升。主要机制可能是通过靶标ABCB1 3’-UTR,导致P-gp蛋白表达下调。
4.1.2 miRNA与MRP-1多药耐药相关蛋白(MRPs)属于ABC跨膜转运蛋白超家族的一个亚组,其成员主要为MRP1-9,分别有ABCC1-9基因编码[25]。Liang等[18]发现相比较于VP-16非耐药MCF-7细胞系,VP-16耐药MCF-7/VP中MRP1存在过表达。与此同时发现在MCF-7/VP细胞系中miR-326表达下调。通过细胞转染miR-326,可明显抑制MCF-7/VP细胞系中MRP1的表达,增加乳腺癌细胞对VP-16的敏感性,可见miR-326为MRP1的靶标[18]。
4.1.3 miRNA与BCRP乳腺癌耐药蛋白(BCRP)属于ABC转运蛋白家族的G亚家族成员,是介导MDR的关键蛋白之一,参与多种药物的吸收、分布和排泄。BRCP具体介导的ATP依赖性泵出化疗药物有米托蒽醌(MX)、拓扑替康、7-乙基-10-羟基喜树碱(SN-38)[25]。BRCP被发现在MX耐药的乳腺癌细胞系MCF-7/MX中表达上调,同时RT-PCR显示miR-487a在该细胞系中表达下调。荧光素酶报告分析结果显示miR-487a通过靶标BRCP的mRNA的3’端,下调BRCP的表达,最终增加MX在细胞中的积累,增加细胞毒性,减少耐药[19]。
4.2 miRNA与DNA修复乳腺癌易感基因1(BRCA1)通过调控同源重组(homologous recombination,HR)修复DNA损伤,有证据显示BRCA1基因突变与乳腺癌的发生密切相关,更进一步的研究发现,BRCA1蛋白功能的丧失会导致包括乳腺癌在内的多种肿瘤的发生[26]。使用聚腺苷二磷酸-核糖聚合酶(poly-ADP-ribose polymerase,PARP)抑制剂处理BRCA1突变的乳腺癌细胞后,能显著导致肿瘤细胞的死亡,此现象被称之为合成致死性(synthetic lethality)。但在野生型BRCA1细胞中PARP抑制剂无法引起细胞死亡,原因可能是野生型并未丧失同源重组的能力。另外,Sasaki等[13]研究发现在BRCA1突变的三阴性乳腺癌(TNBC)中,吉西他滨联合PARP1能够抑制乳腺癌细胞的增殖及促进细胞的凋亡。更进一步研究发现,miR-206在BRCA1突变的TNBC中表达上调而在野生型中表达明显降低。miR-206过表达能调节细胞周期蛋白D2(cyclin D2)造成细胞周期停滞,导致TNBC耐药的发生。由此提示,miR-206调节细胞周期的机制在PARP1抑制剂治疗野生型BRCA1型乳腺癌起到至关重要的作用。
4.3 miRNA与细胞凋亡多种miRNA被报道参与到细胞的增殖、凋亡过程[25]。目前紫杉醇+卡铂(PTX/CBP)化疗方案是较为有效的新辅助化疗(NAC)方案之一,然而其有效机制尚未明确。研究[20]表明miR-621过表达能够增加乳腺癌细胞系和异种移植肿瘤中细胞的凋亡,增加化疗敏感性。更进一步的研究发现,miR-621负调控FBXO11的表达。可见,miR-621可通过抑制FBXO11的表达,从而促进细胞凋亡,提高化疗疗效。顺铂因能通过DNA交联促进细胞凋亡而被广泛用于化疗。Zhao等[21]发现,过表达miR-383能够增加细胞对顺铂的凋亡敏感性。进一步研究发现,Gadd45g为miR-383的靶基因。过表达Gadd45g能够逆转miR-383相关的顺铂敏感性增加。可见miR-383可能通过Gadd45g介导增加化疗药效。
近年来,在药物引起肿瘤细胞凋亡的研究中,活性氧(reactive oxygen species,ROS)的作用被广泛关注。ROS是由细胞发生氧化磷酸化时产生,在正常细胞内维持在稳定的范围。由于肿瘤细胞的抗氧化酶活性相较于正常细胞低,所以清除ROS的能力较正常细胞低,但同时肿瘤细胞产生的ROS却又往往高于正常细胞。细胞内ROS的聚集是一把双刃剑,ROS的适度升高可促进细胞增殖,而高水平ROS可介导凋亡因子Bax的活化,促进细胞凋亡[27]。Serguienko等[28]发现在let-7a转染的MDA-MB-231细胞系中,DOX发挥强大的抗肿瘤功能,明显高于未转染的细胞系。然而,转染细胞系经过抗氧化剂N-乙酰基-半胱氨酸(N-acetyl-cysteine)处理后,DOX抑制细胞增殖能力明显下降。可见let-7a在上调ROS方面具有重大意义。
4.4 miRNA与EMT多项研究证实化疗药物可能引起细胞发生EMT,导致乳腺癌细胞耐药。TGF-β通过诱导EMT在多种肿瘤耐药中发挥重要作用。Bai等[22]通过体外药物诱导方法建立乳腺癌赫赛汀耐药(TR)细胞株。通过miRNA芯片技术,发现miR-200c在TR细胞株中表达下调。对于野生型细胞株,使用miR-200c抑制剂处理后。MTT实验结果显示野生型细胞株对赫赛汀产生耐药。更进一步研究发现,TR细胞转染miR-200c可以降低TR细胞TGF-βmRNA水平与TGF-β信号通路激活水平。研究还发现,miR-200c的直接靶向转录抑制因子(ZEB1)与转录激活因子锌指蛋白(ZNF217),调控TGF-β信号通路的激活水平。敲除ZNF217和ZEB1后的TR细胞株对赫赛汀的耐药性明显降低。Yang等[14]发现在紫杉醇耐药的细胞株中,下调miR-125b的表达能够使细胞表现出间充质细胞的特征,而过表达miR-125b后,细胞表现出反间充质细胞特征并且对紫杉醇的敏感性增加。
4.5 miRNA与乳腺癌干细胞目前,乳腺癌干细胞(BCSC)与乳腺癌耐药相关已得到普遍证实。多柔比星耐药株MCF-7/DOX中被证实具有大量的BC SC[29]。Park等[15]在此基础上发现MCF-7/DOX中miR-34a表达水平降低,但其靶基因NOTCH1表达上调。恢复细胞中miR-34a的表达,能够降低细胞对多柔比星的耐药性。对转移性乳腺癌细胞株进行肿瘤干细胞的miRNA表达谱分析,结果提示miR-7低表达的细胞更容易发生骨转移、脑转移。更进一步的研究发现,miR-7能够通过降低靶基因KLF4 mRNA水平来抑制乳腺癌干细胞自我更新,从根本上降低了乳腺癌干细胞转移、侵袭的可能性。提示miR-7可能作为干细胞型乳腺癌耐药的治疗靶点[29]。
5 miRNA与乳腺癌耐药的防治
5.1 miRNA与乳腺癌耐药预测研究表明,miRNA具有预测乳腺癌耐药的潜力,但如何快速、简便的提取miRNA是一个大难题。既往对miRNA的研究都局限于细胞内的活动。Lawrie等[30]发现循环miRNA能在血清中稳定存在,并且表达程度与弥散性B细胞淋巴瘤患者的存活率呈负相关,这为临床上miRNA简便检测提供可能。更进一步的研究发现,1mL血浆中即可提供足够miRNA用于检测,并且可用于判断是正常组织还是肿瘤组织。这些研究充分说明外周血中miRNA表达谱的检测可在将来作为一项常规检查用于乳腺癌的治疗。
5.2 miRNA与乳腺癌耐药的治疗尽管诸多体内外研究[31-32]提示miRNA用于抗癌治疗具有较好的应用前景,但到目前为止仍是一个巨大的挑战。为了避免miRNA药物在体内的快速降解和排泄,寻找一种能稳定将药物送至靶组织的新的药物转运载体是必要的。近年研究表明,纳米材料可作为新型药物载体,其具有高度靶向定位的优势,显著提高药物的利用率,减少药物用量,并且能实现对药物的释放控制。另外,以纳米颗粒作为药物载体还能降低药物对靶向位置的副作用,减小对其他非靶器官的毒性作用,并且成本较其他方法更低廉[33-34]。Ekin等[35]已成功运用纳米金作为载体,将miR-145寡核苷酸成功载入乳腺癌细胞株中。
6 展望
越来越多的研究证实miRNA与乳腺癌耐药密切相关。改变乳腺癌细胞中miRNA原有的表达水平可以增强细胞对化疗药物的敏感性。此外,由于乳腺癌具有不同的分子亚型,临床上亟需一个miRNA分子谱,用于临床乳腺癌患者耐药预测,使患者最大化的从化疗中获益。随着miRNA对乳腺癌耐药机制研究的不断深入及miRNA相关药物载体的研制,相信在未来基于miRNA的靶向药物能够用于乳腺癌的治疗,获得显著的疗效。
[1]Ferlay J,Soerjomataram I,Dikshit R,et al.Cancer incidence and mortality worldwide:sources,methods and major patterns in GLOBOCAN 2012[J].Int J Cancer,2015,136(5):E359-E386.
[2]顾玺,张文海.miRNA在乳腺癌化疗耐药中的作用[J].中国肿瘤临床,2014,41(08):538-541.
[3]Zheng T,Wang J,Chen X,et al.Role of microRNA in anticancer drug resistance[J].Int J Cancer,2010,126(1):2-10.
[4]Wu Q,Yang Z,Nie Y,et al.Multi-drug resistance in cancer chemotherapeutics:mechanisms and lab approaches[J]. Cancer Lett,2014,347(2):159-166.
[5]Kutanzi KR,Yurchenko OV,Beland FA,et al.MicroRNA-mediated drug resistance in breast cancer[J].Clin Epigenetics,2011,2(2):171-185.
[6]邱磊.MiR-375增加肿瘤坏死因子对人口腔鳞癌细胞杀伤活性及机制研究[J].浙江中西医结合杂志,2015,25(2):120-123.
[7]Wang J,Yang M,Li Y,et al.The Role of MicroRNAs in the Chemoresistance of Breast Cancer[J].Drug Dev Res,2015,76(7):368-374.
[8]Pinto CA,Widodo E,Waltham M,et al.Breast cancer stem cells and epithelial mesenchymal plasticity-Implications for chemoresistance[J].Cancer Lett,2013,341(1):56-62.
[9]Mitra A,Mishra L,Li S.EMT,CTCs and CSCs in tumor relapse and drug-resistance[J].Oncotarget,2015,10,6(13):10697-10711.
[10]李元元,韩艳秋,周顺卿,等.循环microRNA作为潜在肿瘤标记物在妇科恶性肿瘤中的研究进展[J].中国妇幼保健,2014,29(35):5950-5952.
[11]张超,庞全海.siRNA与miRNA在生物体基因调控中沉默机制的比较[J].中国生物化学与分子生物学报,2012,28(5):393-398.
[12]Takahashi RU,Miyazaki H,Ochiya T.The Roles of MicroRNAs in Breast Cancer[J].Cancers(Basel),2015,7(2):598-616.
[13]Sasaki A,Tsunoda Y,Tsuji M,et al.Decreased miR-206 expression in BRCA1 wild-type triple-negative breast cancer cells after concomitant treatment with gemcitabine and a Poly(ADP-ribose)polymerase-1 inhibitor[J].Anticancer Res,2014,34(9):4893-4897.
[14]Yang Q,Wang Y,Lu X,et al.MiR-125b regulates epithelial-mesenchymal transition via targeting Sema4C in paclitaxel-resistant breast cancer cells[J].Oncotarget,2015,6(5):3268-3279.
[15]Park EY,Chang E,Lee EJ,et al.Targeting of miR34a-NOTCH1 axis reduced breast cancer stemness and chemoresistance[J].Cancer Res,2014,74(24):7573-7582.
[16]Pogribny IP,Filkowski JN,Tryndyak VP,et al.Alterations of microRNAs and their targets are associated with acquired resistance of MCF-7 breast cancer cells to cisplatin[J].Int J Cancer,2010,127(8):1785-1794.
[17]Bergamaschi A,Katzenellenbogen BS.Tamoxifen downregulation of miR-451 increases 14-3-3ζ and promotes breast cancer cell survival and endocrine resistance[J].Oncogene,2012,31(1):39-47.
[18]Liang Z,Wu H,Xia J,et al.Involvement of miR-326 in chemotherapy resistance of breast cancer through modulating expression of multidrug resistance-associated protein 1[J].Biochem Pharmacol,2010,79(6):817-824.
[19]Ma MT,He M,Wang Y,et al.MiR-487a resensitizes mitoxantrone(MX)-resistant breast cancer cells(MCF-7/ MX)to MX by targeting breast cancer resistance protein(BCRP/ABCG2)[J].Cancer Lett,2013,339(1):107-115.
[20]Xue J,Chi Y,Chen Y,et al.MiRNA-621 sensitizes breast cancer to chemotherapy by suppressing FBXO11 and enhancing p53 activity[J].Oncogene,2016,35(4):448-458.
[21]Zhao L,Gu H,Chang J,et al.MicroRNA-383 regulates the apoptosis of tumor cells through targeting Gadd45gp[J]. PLoS One,2014,9(11):e110472.
[22]Bai WD,Ye XM,Zhang MY,et al.MiR-200c suppresses TGF-β signaling and counteracts trastuzumab resistance and metastasis by targeting ZNF217 and ZEB1 in breast cancer[J].Int J Cancer,2014,135(6):1356-1368.
[23]史敏,吕建鑫,潘波,等.microRNA与乳腺癌耐药相关性的研究进展[J].实用临床医药杂志,2014,18(23):221-224.
[24]李智敏,罗喜平,王泽华,等.微小RNA-451在乳腺癌细胞中的表达及其与耐药的关系[J].肿瘤,2012,32(12):982-986.
[25]Videira M,Reis RL,Brito MA.Deconstructing breast cancer cell biology and the mechanisms of multidrug resistance[J].Biochim Biophys Acta,2014,1846(2):312-325.
[26]Garofalo M,Croce CM.MicroRNAs as therapeutic targets in chemoresistance[J].Drug Resist Updat,2013,16(3 -5):47-59.
[27]Sosa V,Moliné T,Somoza R,et al.Oxidative stress and cancer:an overview[J].Ageing Res Rev,2013,12(1):376-390.
[28]Serguienko A,Grad I,Wennerstrm AB,et al.Metabolic reprogrammingof metastatic breast cancer and melanoma bylet-7a microRNA[J].Oncotarget,2015,6(4):2451-2065.
[29]Calcagno AM1,Salcido CD,Gillet JP,et al.Prolonged drugselection of breast cancer cells and enrichment of cancerstem cell characteristics[J].J Natl Cancer Inst,2010,102(21):1637-1652.
[30] Lawrie CH,Gal S,Dunlop HM,et al.Detection of elevatedlevels of tumour -associated microRNAs in serum of patientswith diffuse large B-cell lymphoma[J].Br J Haematol,2008,141(5):672-675.
[31]Okuda H,Xing F,Pandey PR,et al.miR-7 suppresses brain metastasis of breast cancer stem-like cells by modulatingKLF4[J].Cancer Res,2013,73(4):1434-1444.
[32]徐臣光,陈静,许践刚,等.血清miRNA 作为结直肠癌患者诊断标志物的价值研究[J].肿瘤学杂志,2015,(5):405-410.
[33]Yan LX,Wu QN,Zhang Y,et al.Knockdown of miR-21 inhuman breast cancer cell lines inhibits proliferation,invitro migration and in vivo tumor growth[J].Breast CancerRes,2011,13(1):R2.
[34]洪锦勇,尹红梅,沈阳,等.表面化学修饰纳米金粒子对肝癌细胞增殖和迁移的影响[J].生物医学工程学杂志,2015,32(2):373-379.
[35]Ekin A,Karatas OF,Culha M,et al.Designing a gold nanoparticle-based nanocarrier for microRNA transfectioninto the prostate and breast cancer cells[J].J Gene Med,2014,16(11-12):331-335.
(收购:2015-12-17 修回:2016-02-20)
浙江省自然科学基金资助项目(No.LY12H16008);浙江省大学生科技创新活动计划暨新苗人才计划(No.2015R410026)
1浙江中医药大学(杭州310053);2浙江中医药大学附属第一医院乳腺外科(杭州310006)
谢小红,E-mail:xxh666857@163.com

