烯丙基醚脱烯丙基保护研究进展
唐剑耀,刘红星,2,黄初升,2
(1.广西师范学院化学与材料科学学院,广西 南宁 530001;2.西南民族药协同创新中心(广西师范大学),广西 桂林 541001)
综述与进展
烯丙基醚脱烯丙基保护研究进展
唐剑耀1,刘红星1,2,黄初升1,2
(1.广西师范学院化学与材料科学学院,广西 南宁 530001;2.西南民族药协同创新中心(广西师范大学),广西 桂林 541001)
摘 要:烯丙基用作胺基和羟基的保护基时,既能够在温和的条件下引入,又能够在温和的反应条件下选择性地脱去,同时对那些对酸碱敏感的基团并没有影响,因此被广泛应用于有机合成中。本文主要综述了近十年来利用烯丙基醚来脱烯丙基的机理及方法。
关键词:烯丙基;脱保护基;选择性
在有机合成中羟基保护是一个重要的问题,传统的保护酚羟基、醇羟基的方法是形成酯键(如乙酸酯,苯甲酸酯)、醚键(如甲基醚,苄基醚、烷硅醚)或者形成缩醛、缩酮,但是这些保护基要么在酸性或者碱性条件下容易脱去保护而没有选择性,要么在比较苛刻的条件下没有选择性。如氯甲基甲醚保护酚羟基,在酸性条件下其他对酸敏感的不稳定基团容易受到影响,而酯基无论在碱性还是酸性条件下都不稳定。然而有些反应条件下不可避免酸碱条件,而烯丙基醚包括烯丙基芳香醚和烷基烯丙基醚,在温和的强酸、强碱下都是稳定的,而且脱保护时具有选择性。脱烯丙基具有反应条件温和,产率高,其他酸碱敏感基团不受影响等优点[1],被广泛应用于具有生物活性的有机物如甾体、黄酮类化合物、多肽、糖类等的有机合成中[2-5]。Tsuji[6]和M.Trost[7]提出以化学计量的钯的络合物作为催化剂,与烯丙基形成π-络合物而脱除烯丙基,大大推动了烯丙基保护基在有机合成中的应用,到目前为止,很多脱烯丙基的方法都是钯与烯丙基形成π-络合物而脱去烯丙基。
通讯联系人:刘红星(1954-),女,湖北武汉人,教授,从事天然产物化学研究,E-mail:172278191@qq.com
1 钯催化脱烯丙基
1.1 钯/碳催化
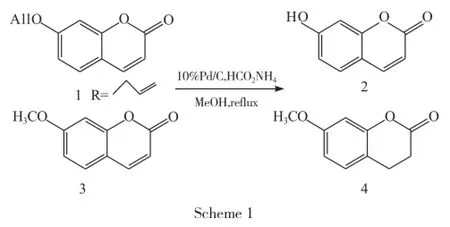
芳香烯丙基醚在Pd/C催化下,氢源(如氢气、甲酸胺等)还原脱去烯丙基。虽该反应条件温和,但芳香烯丙基醚分子内同时有不饱和碳碳双键时,反应条件控制不好,容易把碳碳双键还原为饱和碳碳单键。如Nemai C.Ganguly等[8]以20个烯丙基芳香醚在10% Pd/C为催化剂,HCO2NH4为氢源,CH3OH为溶剂下进行脱烯丙基保护,以70%~98%的产率得到目标产物,同时对一些可还原的官能团如-CHO、-COCH3、-CO2Et 和-NHCOCH3等并没有影响,但是底物分子含有-NO2的芳香烯丙基醚脱去烯丙基的同时,-NO2被还原为-NH2。化合物1既有烯丙基又有α,β-不饱和双键,在烯丙氧基保护进行脱保护时,由于烯丙氧基为末端烯,位阻相对较小,首先脱去烯丙基,然后再对α,β-不饱和双键碳碳双键加成。如化合物3用此方法进行时,也可以对α,β-不饱和双键进行加成生成化合物1~4(Scheme 1)。
芳香烯丙基醚在Pd/C催化时,由于氢源如氢气、甲酸胺等还原脱去烯丙基存在一定的缺点,特别是底物中除了烯丙氧基之外还含有末端烯烃或者是-NO2,这时在没有氢源的Pd/C催化下也可以顺利脱去烯丙基。如Li Qun Shen等合成天然甾体Krempene B,选用烯丙基而非苄基保护酚羟基,关键一步的脱烯丙基保护,以5% Pd/C为催化剂,甲醇作溶剂,对甲苯磺酸作用72 h,以90%产率得到目标的天然产物Krempene B,而对末端碳碳双键并没有影响(Scheme 2)。该方法适用于对酸不敏感的芳香烯丙基醚脱烯丙基保护。

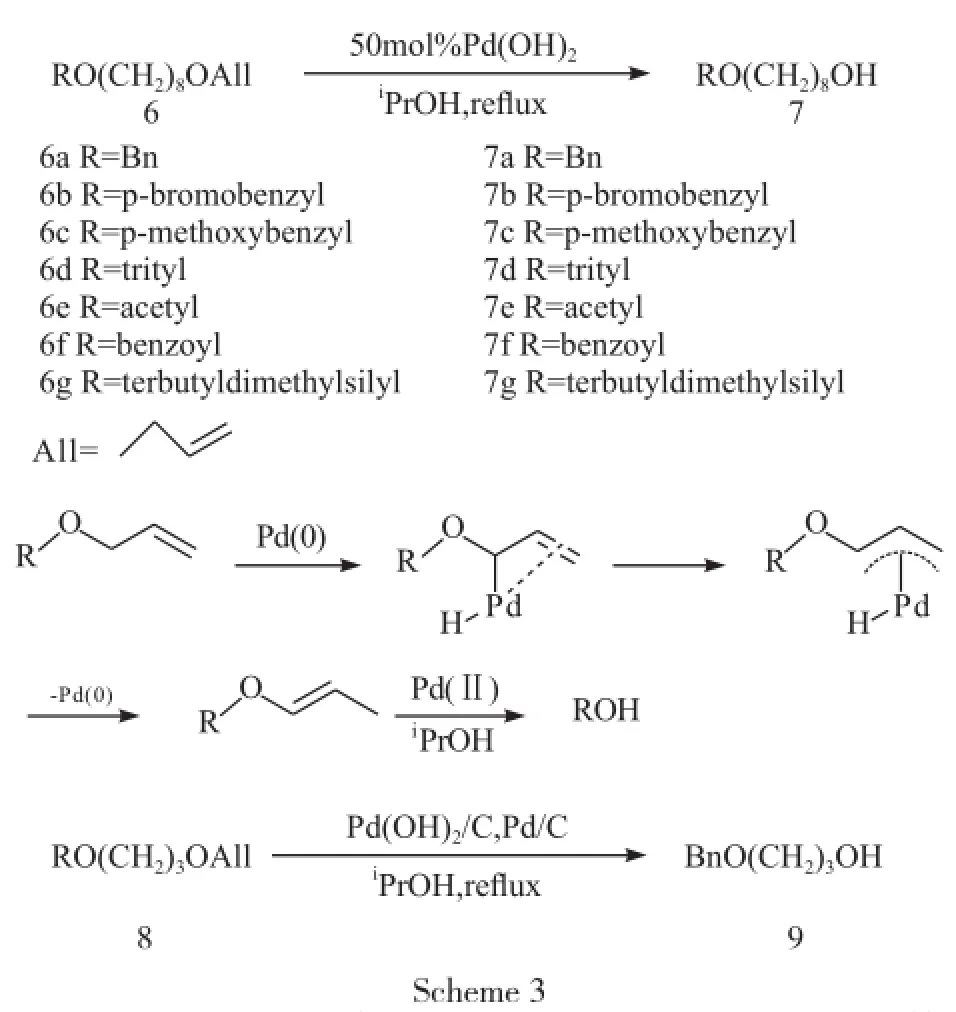
以上两种方法都存在一定的不足,要么对碳碳双键发生加成反应,要么对酸敏感基团不稳定。Alson Mart等[9]对底物含有对酸碱敏感基团的烷基烯丙基醚进行脱烯丙基保护时,以50 mol%甚至100 mol% Pd(OH)2/C为催化剂,甲醇、异丙醇、叔丁醇等作为溶剂,在没有氢源的条件下进行脱烯丙基保护,发现以56%~94%产率只得到脱掉烯丙基后的相应的醇,并提出反应机理为:烯丙基在零价钯的作用下异构化,然后在价钯氧化脱去,得到脱去烯丙基的产物。由于所用的催化剂量较大,又进行改进,把50 mol% Pd(OH)2换成Pd(OH)2/C和Pd/C 各10 mol%,如化合物8脱烯丙基保护,得到化合物9(Scheme 3)。
1.2 钯配合物催化
钯碳催化是液固两相反应,脱烯丙基保护时不利于反应,而钯配合物如Pd(PPh3)4、PdCl2(PPh3)2等可以溶于溶剂中,使其更有利于钯与烯丙基形成π-络合物,从而促进脱除烯丙基反应进行。Alexandre Martinez等[10]在合成大环催化剂的重要中间体11,芳香烯丙基醚10脱烯丙基保护时,在Pd(PPh3)4催化下,MeOH为溶剂,K2CO3为碱,以86%产率得到脱保护物质11(见Scheme 4)。该方法的反应条件对于脱烯丙基比较温和,对底物含有-CHO、-CN、-NO2等容易氧化和还原的基团的物质进行脱烯丙基保护时,对这些基团并没有影响[11]。Young Ho Seo[12-13]在合成具有热休克蛋白抑制作用的天然产物butein时,用烯丙基保护酚羟基的查尔酮12,关键一步烯丙基脱保护,在PdCl2(PPh3)2、NH4HCO2以及微波作用下,以48%产率得到天然产物butein(Scheme 4)。

Hirokazu Tsukamoto等[14]对底物含其他对酸碱敏感基团的烷基烯丙基醚,在2当量的1,3-甲基巴比妥酸(DMBA)、Pd(PPh3)4(5mol%)、以甲醇为溶剂的条件下,室温反应成功脱去烯丙基保护基,以78%~100%的高产率得到目标产物而不影响其他基团;同时发现化合物13含有硫原子,在DMBA/ Pd(PPh3)4/CH3OH体系中成功脱去烯丙基,而并没有使催化剂Pd(PPh3)4中毒失去活性,得到化合物14(Scheme 5)。分子内同时含有烯丙基、2-甲基-1-烯丙基、异戊烯基作为醇羟基保护基,在DMBA/Pd(PPh3)4/CH3OH体系中,可以通过控制反应温度来有序进行脱保护得到相应的醇。Guilhem Mora等[15]在复杂的钯配合物催化和苯胺作用下,脱去烯丙基醚中的烯丙基得到相应的酚和醇,并探究了其脱保护的机理。

2 碘催化脱烯丙基
钯催化剂虽然能有效选择性地脱去烯丙醚中的烯丙基,但价格比较高,使用会受到一定限制,可以在合适的溶剂中用碘催化脱去芳香烯丙基醚中的烯丙基。B. R. Nawghare等[16]尝试用烯丙基保护酚羟基的查尔酮15,在20 mol% I2/DMSO、130℃条件下一步转化为脱保护的黄酮化合物16,结果并没有得到化合物16。当把碘单质的量增至1.1当量时,以72%产率得到16(见Scheme 6),并提出关环和脱烯丙基的机理。并且该I2/DMSO、130℃体系脱含有醛基或者是不饱和碳碳双键的芳香烯丙基醚中的烯丙基时,对醛基和不饱和碳碳双键并没有影响。

Vivek Humne等[17]把溶剂换为聚乙醇400 (PEG-400),即查尔酮在体系I2/PEG-400中更加温和地反应生成黄酮,且溶剂PEG-400可以反复回收利用,对查尔酮脱烯丙基关环得到黄酮几乎没有影响。Shankaraiah G. Konda等[18]用10 mol% I2/PEG-400,室温搅拌选择性脱去烯丙基醚中的烯丙基保护基而不影响烯丙胺基,并且对反应用过的溶剂进行多次回收PEG-400循环使用,发现对脱烯丙基产率影响不大,并提出反应机理。该方法反应试剂便宜易得,反应条件不需要无水无氧苛刻条件,在室温即可进行且产率高,溶剂可以反复回收使用,几乎不影响产率。Vivek T. Humne等[19]将化合物17脱烯丙基,在酸性的20mol% I2/DMSO 100℃得到脱氢脱烯丙基的产物19,而在酸性的20mol% I2/DMSO 60℃或者I2/PEG-400室温下,得到只脱烯丙基而不脱氢的化合物18。无论酸性的20mol% I2/DMSO、100℃体系还是酸性20mol% I2/DMSO、60℃或者I2/PEG-400,对容易被氧化的醛基都没有影响(Scheme 7),说明酸可以催化碘脱烯丙基。M. Nagaraju[20]用I2-DMSO体系对化合物22进行脱烯丙基时发现产率太低,而在NaI/DMSO、130℃体系作用下,以99%的高产率得到目标产物23,而且该NaI/DMSO、130℃反应体系对含有苄基、叔丁基、甲基保护基的烯丙基芳香醚脱烯丙基保护没有影响(Scheme 7)。

3 其他方法
Gärtner D等[21]在1mol% FeCl2/EtMgCl/m-xylene -THF体系中在20℃下反应1h,成功使芳香烯丙基醚脱烯丙基保护基,该方法脱烯丙基保护的缺点是:由于EtMgCl是个很活泼的亲核试剂,会与大部分亲电基团如醛基、酯基等发生反应而没有选择性,同时反应条件比较苛刻,要求无水无氧。
Mangilal.Chouhan等[22]对化合物25在NiCl2· 6H2O/NaBH4/CH3OH体系0℃下反应5~10min,以93%高产率得到化合物26,说明该反应体系能选择性地脱去烯丙基而不还原氰基,化合物27虽然在NiCl2·6H2O/NaBH4/CH3OH的反应条件可以脱去保护酚羟基中的苄基,但该化合物的酚羟基的保护基既有苄基又有烯丙基,可以选择性地先脱去烯丙基(Scheme 8)。该方法脱芳香烯丙基醚,不需要无水无氧苛刻条件而且反应试剂便宜易得,反应时间短,产率高。

4 总结与展望
由于烯丙基醚对酸碱比较稳定且容易选择性引入和脱除,近年来主要发展有钯催化和碘催化烯丙基醚选择性脱除烯丙基。其中钯催化用量少,具有较好的选择性,可脱去烯丙基而不影响其他官能团,但其价格较昂贵,使用时会受到一定的限制。I2/ PEG-400体系由于其只需要催化量,就可以在温和条件下选择性脱除烯丙基而不影响其他官能团,且PEG-400是环保溶剂,可以反复循环回收利用,几乎不影响脱除烯丙基的产率,则更适合工业绿色环保生产。合成天然产物时不可避免地要使用不同的保护基,因此在同一分子中采用不同方法,选择性地引入和脱去烯丙基而不影响其他基团,特别是含有多羟基的化合物如黄酮、糖类等,就显得非常重要。相信烯丙基作为保护基将会在有机合成中得到更广泛的应用。
参考文献:
[1]Wuts P G M, Greene T W. Greene's protective groups in organic synthesis[M]. John Wiley & Sons, 2006.
[2]Shen L Q, Huang S Y, Tang Y, et al. The first synthesis of Krempene B[J]. Steroids, 2012, 77(13): 1398-1402.
[3]Aponte J C, Verástegui M, Málaga E, et al. Synthesis,cytotoxicity, and anti-Trypanosoma cruzi activity of new chalcones[J]. Journal of medicinal chemistry, 2008, 51(19): 6230-6234.
[4]Wu H P, Lu T N, Hsu N Y, et al. Absolute Stereochemical Assignment of SCH 71450, a Selective Dopamine D4 Receptor Antagonist, Through Enantioselective Epimer Synthesis[J]. European Journal of Organic Chemistry, 2013,2013(14): 2898-2905.
[5]Kimbonguila A M, Merzouk A, Guib é F, et al. Allylic protection of thiols and cysteine:Ⅰ: The allyloxycarbonylaminomethyl group [J]. Tetrahedron, 1999, 55(22): 6931-6944.
[6]Tsuji J. Application of Palladium Catalysts to Natural Product Syntheses[J]. Annals of the New York Academy of Sciences,1980, 333(1): 250-263.
[7]Trost B M, Self C R. . alpha.-Elimination of. alpha.-acetoxysilanes induced by palladium: evidence for the intermediacy of a vinylcarbene-palladium complex[J]. Journal of the American Chemical Society, 1983, 105(18): 5942-5944.
[8]Ganguly N C, Dutta S, Datta M. Mild and efficient deprotection of allyl ethers of phenols and hydroxycoumarins using a palladium on charcoal catalyst and ammonium formate[J]. Tetrahedron letters, 2006, 47(32): 5807-5810.
[9]Mart A, Shashidhar M S. Elaboration of the ether cleaving ability and selectivity of the classical Pearlman's catalyst [Pd(OH)2/C]: concise synthesis of a precursor for a myoinositol pyrophosphate[J]. Tetrahedron, 2012, 68(47): 9769-9776.
[10]Martinez A, Hemmert C, Meunier B. A macrocyclic chiral manganese (III) Schiff base complex as an efficient catalyst for the asymmetric epoxidation of olefins[J]. Journal of Catalysis, 2005, 234(2): 250-255.
[11]Vutukuri D R, Bharathi P, Yu Z, et al. A mild deprotection strategy for allyl-protecting groups and its implications in sequence specific dendrimer synthesis[J]. The Journal of organic chemistry, 2003, 68(3): 1146-1149.
[12]Seo Y H. Butein Disrupts Hsp 90's Molecular Chaperoning Function and Exhibits Anti-proliferative Effects Against Drug-resistant Cancer Cells[J]. Bull. Korean Chem. Soc,2013, 34(11): 3345-3349.
[13]Seo Y H, Jeong J H. Synthesis of Butein Analogues and their Anti-proliferative Activity Against Gefitinib-resistant Non-small Cell Lung Cancer (NSCLC) through Hsp90 Inhibition[J]. Bulletin of The Korean Chemical Society,2014, 35(5): 1294-1298.
[14]Tsukamoto H, Suzuki T, Kondo Y. Remarkable solvent effect on Pd (0)-catalyzed deprotection of allyl ethers using barbituric acid derivatives: Application to selective and successive removal of allyl, methallyl, and prenyl ethers[J]. Synlett, 2007(20): 3131-3136.
[15]Mora G, Piechaczyk O, Le Goff X F, et al. Palladium-Catalyzed Deallylation of Allyl Ethers with a Xanthene Phosphole Ligand. Experimental and DFT Mechanistic Studies[J]. Organometallics, 2008, 27(11): 2565-2569.
[16]Nawghare B R, Sakate S S, Lokhande P D. A New Method for the Facile Synthesis of Hydroxylated Flavones by Using Allyl Protection[J]. Journal of Heterocyclic Chemistry,2014, 51(2): 291-302.
[17]Humne V, Lokahnde P. Efficient Deallylation of Allyl Phenyl Ethers by Molecular Iodine in PEG-400 and Their Utility for Flavone Synthesis[J]. Synthetic Communications,2014, 44(7): 929-935.
[18]Konda S G, Humne V T, Lokhande P D. Rapid and selective deallylation of allyl ethers and esters using iodine in polyethylene glycol-400[J]. Green Chem., 2011, 13(9): 2354-2358.
[19]Humne V T, Hasanzadeh K, Lokhande P D. Selective O-deallylation of dihydropyrazoles by molecular iodine in the presence of active N-allyl and formyl groups[J]. Research on Chemical Intermediates, 2013, 39(2): 585-595.
[20]Nagaraju M, Krishnaiah A, Mereyala H B. Simple and Highly Efficient Method for the Deprotection of Allyl Ethers Using Dimethylsulfoxide-Sodium Iodide[J]. Synthetic Communications, 2007, 37(15): 2467-2472.
[21]Gärtner D, Konnerth H, von Wangelin A J. Highly practical iron-catalyzed C-O cleavage reactions[J]. Catalysis Science & Technology, 2013(10): 2541-2545.
[22]Chouhan M, Kumar K, Sharma R, et al. NiCl2·6H2O/ NaBH4in methanol: a mild and efficient strategy for chemoselective deallylation/debenzylation of aryl ethers[J]. Tetrahedron Letters, 2013, 54(34): 4540-4543.
中图分类号:O 629.9
文献标识码:A
文章编号:1671-9905(2016)02-0015-05
基金项目:广西自然科学基金(2013GXNSFAAO19041);广西研究生教育创新计划项目(20121106030703M02);西南民族药协同创新中心资助课题(CICSEM 2013-B6)
作者简介:唐剑耀 (1989-), 男,广西贵港人,在读硕士研究生, E-mail:tangjianyao@163.com
收稿日期:2015-12-07
Research Progress of Allyl Ethers Deallylation Protection
TANG Jian-yao1,LIU Hong-xing1,2,HUANG Chu-sheng1,2
(1.College of Chemistry and Materials Science, Guangxi Teachers Education University, Nanning 530001, China;2.Collaborative Innovation Center of Southwest Ethnic Medicine, Guilin 541001, China)
Abstract:When allyl was used as protecting groups of amine and hydroxyl, it had selectively capable of introducing and removing under mild reaction conditions, and had no effect on other acid-base sensitive groups. So it was widely used in organic synthesis. This paper reviewed allyl ethers deallylation mechanism and methods in the past decade.
Key words:allyl; deprotection; selectivity

