外源注射CART特异性dsRNA对蛋鸡产蛋性能和蛋品质的影响
李鹏飞, 景炅婕, 毕锡麟, 王 锴, 张子宁, 吕丽华
(1.山西农业大学生命科学学院;2.山西农业大学动物科技学院,山西 太谷 030801)
外源注射CART特异性dsRNA对蛋鸡产蛋性能和蛋品质的影响
李鹏飞1, 景炅婕2, 毕锡麟2, 王锴2, 张子宁2, 吕丽华2
(1.山西农业大学生命科学学院;2.山西农业大学动物科技学院,山西 太谷 030801)
摘要:选择500只健康、20周龄的海兰褐蛋鸡,预饲30 d后随机平均分为5组,每组4个重复,分别进行如下处理:生理盐水仅第1天注射一次组(A组,对照组)、可卡因—苯丙胺调节转录肽(CART)特异性双链RNA(dsRNA)仅第1天注射一次组(B组)、CART dsRNA每40 d注射一次组(C组)、CART dsRNA每20 d注射一次组(D组)、CART dsRNA每10 d注射一次组(E组),120 d后对各处理组蛋鸡的产蛋性能、蛋品质、蛋组分和体重变化进行测定,研究CART对产蛋期蛋鸡的产蛋性能和蛋品质的影响.结果表明:各试验组之间以及与对照组之间在产蛋率上均存在差异(P<0.05);B组的日产蛋量与对照组的差异不显著,其他试验组与对照组的差异显著(P<0.05);各试验组的采食量均高于对照组(P<0.05);从蛋料比来看,B、C组与对照组的差异不显著,D组与E组的差异不显著,但均与对照组存在差异(P<0.05);各试验组蛋品质、蛋组分与对照组的差异不显著;试验结束后,各试验组蛋鸡的体重变化与对照组均存在差异(P<0.05).总之,CART dsRNA对海兰褐蛋鸡产蛋性能和体重变化的影响显著, 对蛋品质和蛋组分的影响不显著.
关键词:蛋鸡; 双链RNA(dsRNA); 可卡因—苯丙胺调节转录肽(CART); 产蛋性能; 蛋品质
提高蛋鸡养殖经济效益的核心就是提高蛋鸡产蛋率和蛋料比.可卡因—苯丙胺调节转录肽(cocaine-and amphetamine-regulated transcript, CART)是动物体内广泛分布的神经肽,本课题组经大量研究证实CART对猪[1]、绵羊[2]、牛[3-4]卵泡细胞的生长增殖及雌激素的分泌具有抑制作用;并从基因和蛋白水平上证实CART在鸡卵泡中也有表达[5].蛋鸡卵泡发育过程中有成熟卵泡和未成熟卵泡之分[6-7],在产蛋期每天有一个未成熟卵泡经选择并发育为成熟卵泡[8-9].蛋鸡排卵数降低的生理原因是卵泡在发育过程中出现卵泡闭锁,通常闭锁多在卵泡直径发育到2~8 mm时发生[10].双链RNA(double-stranded RNA, dsRNA)在细胞及脊椎动物体内可诱导同源序列的基因表达受到抑制,进而产生干扰素反应;已经确定体外给予dsRNA后可不同程度地影响蛋鸡各阶段卵泡CART基因的表达,同时对不同发育阶段蛋鸡卵泡雌激素的分泌产生不同程度的影响,由此推测体外注射dsRNA可能通过影响卵泡细胞孕酮和雌激素的合成与分泌,进而调控蛋鸡卵泡发育过程[11].基于以上研究,本试验对产蛋期蛋鸡静脉注射CART dsRNA,通过测定蛋鸡的产蛋性能、蛋品质、饲料报酬和蛋鸡体重,研究体外注射CART dsRNA应用于蛋鸡的可行性,为后期CART dsRNA的推广应用提供技术和理论指导.
1材料与方法
1.1材料
试验用海兰褐蛋鸡来自于山西偏关县新牧畜禽养殖公司,蛋鸡均为20周龄.蛋鸡饮水充足,并选用正大蛋鸡产蛋期全价配合料(货号324)饲喂.
1.2试验设计
选择500只健康初产海兰褐蛋鸡,预饲期30 d后,依据本课题组前期体外注射CART基因特异性dsRNA对海兰褐蛋鸡内分泌激素的影响[11],根据注射频率的不同,随机平均分为5组,每组4个重复,每个重复25只鸡.各处理组分别为生理盐水仅第1天注射一次组(A组,对照组)、CART dsRNA仅第1天注射一次组(B组)、CART dsRNA每40 d注射一次组(C组)、CART dsRNA每20 d注射一次组(D组)、CART dsRNA每10 d注射一次组(E组).5个处理组采食同一全价饲料.
1.3饲养管理
鸡笼为三层阶梯式,单笼长40 cm,深45 cm,前高45 cm,后高38 cm,笼底坡度6°~8°.鸡自由饮水和采食,自然光照补加灯照,每笼饲养3只.鸡舍(17±2) ℃,相对湿度55%~65%,自然通风.鸡舍每天清粪2次,每周消毒1次.
1.4CART dsRNA的设计与合成
CART dsRNA的设计与合成参照本课题组前期研究的方法[6],将序列5′-GAG CCC TGG ACA TCT ACT CCG C-3′及其互补链作为CART dsRNA序列.
1.5CART dsRNA的稀释及注射
合成的粉末状CART dsRNA开盖前于5 000 r·min-1离心5 min,缓慢开盖后加入灭菌超纯水,振荡混匀,配制成浓度为0.1 μmol·mL-1的溶液备用.
试验期CART dsRNA的注射剂量依据本课题组前期研究的方法[11],按分组要求,用5号针头在蛋鸡翅膀内侧静脉注射CART dsRNA,对照组则注射生理盐水,剂量为每只蛋鸡每次200 μL.试验期间采集鸡蛋并记录指标.
1.6指标测定
1.6.1产蛋性能的测定试验期以组内重复为单位,每天记录产蛋数、蛋重,每10 d结料一次;120 d后,以组内重复为单位,计算产蛋率、日采食量、日产蛋量和蛋料比.
1.6.2蛋品质的测定试验期以组内重复为单位,每周随机采集鸡蛋1枚,即整个试验期每个重复共采集17枚鸡蛋,采用EMT5200多功能蛋品质测定仪(日本Robotmation公司)测定蛋白高度,采用EFG0503全自动蛋壳强度测量仪测定蛋壳强度,采用ETG1061全自动蛋壳厚度测量仪测定蛋壳厚度.
1.6.3蛋组分的测定试验期以组内重复为单位,每周随机采集鸡蛋1枚,每个重复共采集17枚鸡蛋,分别称重,分离蛋清、蛋黄和蛋壳并分别称重,计算各组分所占全蛋的比例.
1.6.4蛋鸡体重的测定分别在预饲期结束后及120 d试验期后,以组内重复为单位对蛋鸡进行活体称重并计算蛋鸡的体重变化.
1.7数据处理
试验数据以4次重复的平均值±标准差表示;采用SPSS V19.0对各指标进行方差分析并多重比较,差异显著性以P<0.05水平为标准.
2结果与分析
2.1CART dsRNA对蛋鸡产蛋性能的影响
对各处理组蛋鸡的产蛋性能进行显著性分析,结果(表1)显示:各试验组之间以及与对照组之间在产蛋率上均存在差异(P<0.05),C组的产蛋率最高,E组最低,且低于对照组;B组的日产蛋量与对照组之间不存在显著差异,其他试验组与对照组均存在差异(P<0.05),C组最高,E组低于对照组;各试验组的日采食量均高于对照组(P<0.05),且随着CART dsRNA注射频率的增加,日采食量呈上升的趋势;从蛋料比来看,B、C组与对照组的差异不显著,D组与E组的差异不显著,但均与对照组存在差异(P<0.05).
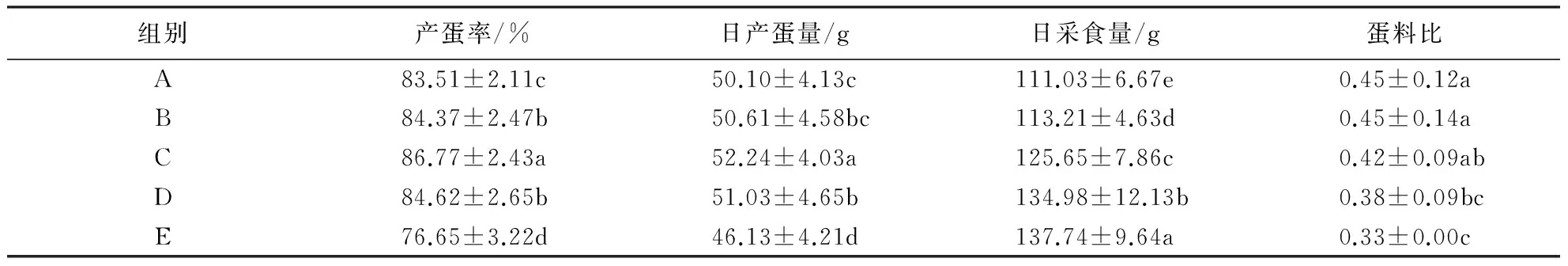
表1 CART dsRNA对蛋鸡产蛋性能的影响1)
1)同列数据后附不同小写字母者表示差异显著(P<0.05),附相同字母者表示差异不显著(P>0.05).
2.2CART dsRNA对蛋品质的影响
对各处理组的蛋品质进行显著性分析,结果(表2)显示,各试验组与对照组之间在蛋白高度、蛋壳强度和蛋壳厚度上均不存在差异(P>0.05).
2.3CART dsRNA对蛋组分的影响
对各处理组的蛋组分进行显著性分析,结果(表3)显示,各试验组与对照组之间在蛋黄比例、蛋清比例和蛋壳比例上均不存在差异(P>0.05),且随着CART dsRNA注射频率的增加,蛋组分的变化很小.

表2 CART dsRNA对蛋品质的影响

表3 CART dsRNA对蛋组分的影响
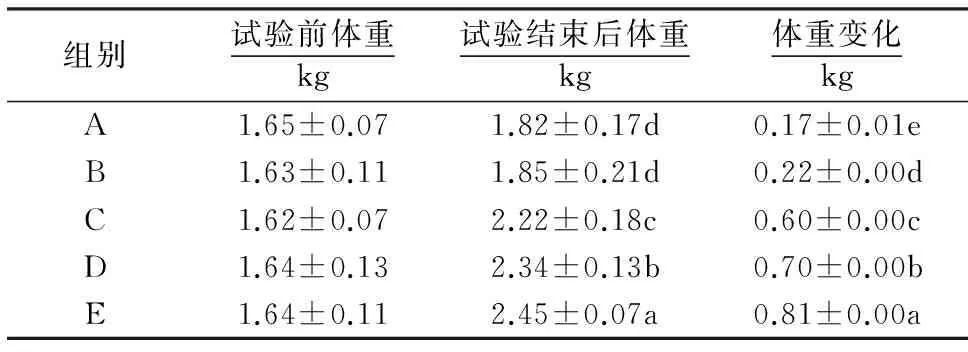
表4 CART dsRNA对蛋鸡体重的影响1)
1)同列数据后附不同小写字母者表示差异显著(P<0.05),附相同字母者表示差异不显著(P>0.05).
2.4CART dsRNA对蛋鸡体重的影响
预饲期结束后对蛋鸡随机分组,因此不同处理组蛋鸡试验前的体重不存在显著差异(表4).试验结束后对各处理组蛋鸡的体重进行显著性分析,结果(表4)显示:B组与对照组的体重不存在差异(P>0.05),C、D、E组之间以及与对照组、B组之间均存在差异(P<0.05);各试验组与对照组之间在蛋鸡体重变化上均存在差异(P<0.05);且随着CART dsRNA注射频率的增加,蛋鸡体重及体重变化呈明显的上升趋势.
3讨论
禽类E2的合成、分泌与哺乳动物有所不同,禽类卵泡E2由膜细胞合成[12].前人[13-14]研究表明,鸡卵泡E2通过旁分泌途径反馈调节颗粒细胞分泌孕酮,并作用于卵泡调节蛋鸡排卵.家禽P主要由卵泡颗粒细胞合成,在蛋鸡产蛋期,黄体生成素和促卵泡激素协同作用于卵泡细胞,调节E2和P的合成与分泌,对促进卵泡成熟和排卵发挥重要作用[15-16].Sen et al[3]于2008年通过研究建立了牛卵泡中CART信号传导模型,其中,CART刺激并诱导Erk1/2激活过程中的Go/i-PKC-MEK通路,促进促卵泡激素诱导的Erk1/2和Akt信号终止;同时,CART信号通路及表达量的改变对芳构化酶CYP19A1基因的表达也产生影响,进一步影响了P的合成与分泌.在前期研究中,已经通过蛋鸡CARTmRNA序列设计了高特异性dsRNA,证明其对海兰褐蛋鸡卵泡E2和P的分泌产生不同程度的影响[6].因此,本试验的设计目的在于初步研究体外注射CART dsRNA对蛋鸡产蛋性能和蛋品质的影响.
本试验结果表明,CART dsRNA注射频率对海兰褐蛋鸡蛋品质和蛋组分的影响不显著,对产蛋性能和体重变化影响显著.试验期每40 d注射一次CART dsRNA(C组),蛋鸡的产蛋率最高,为86.77%;从蛋鸡的体重变化来看,随着CART dsRNA注射频率的增大,蛋鸡体重变化明显增大(P<0.05).
CART dsRNA在引发真核细胞中同源序列基因表达干扰时,具有高度特异性和高效性,不同处理组之间蛋鸡产蛋性能和体重产生显著差异的原因,可能是由CART dsRNA作用于真核细胞发挥干扰作用的另一个特性——可传播性造成的,即CART dsRNA局部注射可对动物整个机体产生影响.研究表明,CART参与调节下丘脑—垂体—肾上腺轴进而调控动物摄食行为[17],同时,体内催产素水平暂时性升高,皮质酮和血糖水平显著升高[18],动物机体产热增加[19].动物采食量与血糖浓度呈负相关,而机体细胞吸收率是体内血糖浓度变化的标识[20].活体试验表明,对大鼠中枢灌注CART后,动物采食量和体重均会下降,并伴随血糖浓度上升和胰岛素水平下降,CART可能通过调节胰岛素水平影响血糖浓度进而调节动物采食量[21].瘦素和神经肽Y是动物食欲调节的主要因子,而弓状核可以合成CART、神经肽Y、阿黑皮素原和刺鼠相关蛋白,研究表明,与摄食抑制相关的所有神经肽通过与神经肽Y相互作用均会影响动物食欲[22-23].位于人体8号染色体5q13-14的CART基因是肥胖病的一个易感位点,研究发现,小鼠CART基因缺失或发生突变后,极容易出现肥胖症[24].总之,当与摄食相关的中枢系统功能发生异常时,机体将对调控摄食的激素变化出现相应的调节反应,引起食欲与机体能量需求状况的不平衡[25].本试验结果也表明:随着CART dsRNA注射间隔时间的缩短,蛋鸡体重及体重变化显著增加,这可能是由于CART dsRNA不仅抑制了卵泡CART的表达,同时对下丘脑弓状核CART的表达也产生抑制,造成与摄食相关的中枢系统功能发生异常,从而引起蛋鸡采食量及体重显著增加(P<0.05);同时,dsRNA干扰CART表达的变化,进一步引起了下丘脑—垂体—肾上腺轴调节水平发生变化,对蛋鸡体内相关激素的分泌量产生影响,导致CART dsRNA注射间隔时间不同也会造成蛋鸡的产蛋性能出现差异(P<0.05),使得CART dsRNA在试验中的高特异性和高效性未能得到验证.此外,在试验过程中,由于体外注射CART dsRNA对蛋鸡产生的应激较大,合理的CART dsRNA给药方法、注射间隔时间及对蛋鸡全身性的影响还有待进一步研究.
4结论
CART dsRNA对海兰褐蛋鸡的产蛋性能和体重变化具有显著影响,初步确定每40 d注射一次CART dsRNA有利于提高鸡场经济效益;CART dsRNA对蛋品质和蛋组分没有显著影响.
参考文献
[1] 李鹏飞,岳文斌,李富禄,等.可卡因—苯丙胺调控转录肽(CART)对猪卵巢卵泡颗粒细胞雌激素产生的影响[J].畜牧兽医学报,2012,43(12):1 879-1 886.
[2] 李鹏飞,岳文斌,黄洋,等.可卡因—苯丙胺调控转录肽对绵羊卵巢卵泡颗粒细胞雌激素产生的影响[J].畜牧兽医学报,2013,44(6):853-857.
[3] SEN A, LÜ L H, BELLO N, et al. Cocaine-and amphetamine-regulated transcript (CART) accelerates the temination of FSH induced ERK1/2 and AKT activation by regulating the expression and degradation of specific map kinase phosphatases [J]. Mol Endocrinol, 2008,22(12):2 655-2 676.
[4] LÜ L H, JIMENEZ-KRASSEL F, SEN A, et al. Evidence supporting a role for cocaine and amphetamine regulated transcript (CART) in control of granulosa cell estradiol production associated with dominant follicle selection in cattle [J]. Biol Reprod, 2009,81(3):580-586.
[5] 于雪静.蛋鸡卵巢CART基因的测序、蛋白定位及表达[D].太谷:山西农业大学,2013.
[6] ONAGBESAN O, BRUGGEMAN V, DECUYPERE E. Intra-ovarian growth faetors regulating ovarian function in avian speeies: a review [J]. Anim Reprod Sci, 2009,111(2-4):121-140.
[7] LOVELL T M, GLADWELL R, GROOME N P, et al. Ovarian follicle development in the laying hen is accompanied by divergent changes in inhibin A, inhibin B, activin A and follistatin production in granulosa and theca layers [J]. J Endoerinol, 2003,177(1):45-55.
[8] MAHON M G, LINDSTEDT K A, HERMANN M, et al. Multiple involvement of clusterin in chicken ovarian follicle development Binding to two oocyte-specific members of the low density lipoprotein receptor gene family [J]. J Biol Chem, 1999,274(7):4 036-4 044.
[9] WOODS D C, JOHNSON A L. Regulation of folliele-stimulating hormone-receptor messenge rRNA in hen granulosa cells relative to follicle seleetion [J]. Biol Reprod, 2005,72(3):643-650.
[10] GUPTA S K, GILBERT A B, WALKER M A. Histological study of follicular atresia in the ovary of the domestic hen (Gallusdomestieus) [J]. J Reprod Fertil, 1988,82(1):219-225.
[11] 李鹏飞,孟金柱,于雪静,等.外源性dsRNA对蛋鸡卵泡基因表达及发育的影响[J].畜牧兽医学报,2016,47(3):515-520.
[12] NITTA H, OSAWA Y, BAHR J M. Multiple steroidogenic cell population in the thecal layer of preovulatory follicles of the chicken ovary [J]. Endocrinology, 1991,129(4):2 033-2 040.
[13] JOHNSON P A, STOKLOSOWA S, BAHR J M. Interaction of granulosa and theca layers in the control of progesterone secretion in the domestic hen [J]. Biol Reprod, 1987,37(5):1 149-1 155.
[14] TANAKA K, LI Z D, ATAKA Y. Studies of ovulation in the perfused ovary of the fowl (Gallusdomesticus) [J]. J Reprod Fert, 1987,80(2):411-416.
[15] PALERMO R. Differential actions of FSH and LH during folliculogenesis [J]. Reprod BioMed, 2007:15(3):326-337.
[16] TSUTSUI K, BENTLEY G E, BEDECARRATS G, et al. Gonadotropin-inhibitory hormone (GnIH) and its control of central and peripheral reproductive function [J]. Front Neuroendocrinol, 2010,31(3):284-295.
[17] KRISTENSEN P, JUDGE M E, THIM L, et al. Hypothalamic CART is a new anorectic peptide regulated by leptin [J]. Nature, 1998,393(6680):72-76.
[18] STANLEY S A, MUPRHY K G, BEWIEK G A, et al. Regulation of rat pituitary cocaine-and amphetamine-regulated transcript (CART) by CRH and glucocorticoids [J]. Am J Physiol Endocrinol Metab, 2004,287(3):583-590.
[19] SMITH S M, VAUGHAN J M, DONALDSON C J, et al. Cocaine-and amphetamine-regulated transcript activates the hypothalamic-pituitary-adrenal axis through a corticotropin-releasing factor receptor-dependent mechanism [J]. Endocrinology, 2004,145(11):5 202-5 209.
[20] PHILIP J L, NIELS V, POUL C P, et al. Chronic intracerebroventricular administration of recombinant CART (42-89) peptide inhibits food intake and causes weight loss in lean and obese zucker (fa/fa) rats [J]. Obesity Research, 2000,8(8):590-596.
[21] KOYLU E O, COUCEYRO P R, LAMBERT P D, et al. Immunohistochemical iocalization of novel CART prptides in rat hypothalamus, pituitary, adreal gland [J]. Comp Neurol, 1998,39(1):15-132.
[22] BROBERGER C. Hypothalamic cocaine-and amphetamine-regulated transcript (CART) neurons: histochemical ralationship to thyrotropin-releasing hormone, melanin-concentrating hormone, orexin/hypocretin and neuropeptide Y [J]. Brain Res, 1999,848(1-2):101-113.
[23] PHILPOT K B, DALLVECHIA-ADAMS S, SMITH Y, et al. A cocaine-and-amphetamine-regulated-transcript peptide projection from the lateral hypothalamus to the ventral tegmental area [J]. Neuroscience, 2005,135(3):915-925.
[24] ECHWALD S M, SORENSEN T, ANDERSEN T, et al. Sequence variants in the human cocaine and amphetamine-regulated transcript (CART) gene in subjects with early onset obesity [J]. Obes Res, 1999,7(6):532-536.
[25] 傅茂,程桦,严励,等.可卡因——安非他明调节转录肽基因与超重肥胖的关联研究[J].中华内分泌代谢杂志,2002,18(6):435-438.
(责任编辑:施晓棠)
收稿日期:2016-01-01修回日期:2016-03-03
基金项目:国家自然科学基金资助项目(31172211);农业部“948”项目(2010-Z43);山西省横向协作与委托项目(2010HX54);山西省回国留学人员科研项目(2014-重点5);山西省科技攻关项目(20130311027-2);山西省人事厅人才引进项目;山西农业大学引进人才博士科研启动费(2014ZZ04) ;山西农业大学科研管理费资助重大项目和标志性成果培育项目(71060003).
作者简介:李鹏飞(1978-),男,副教授,博士.研究方向:动物生殖生理.Email:adamlpf@126.com.通讯作者吕丽华(1969-),女,教授,博士.研究方向:动物繁殖生物技术.Email:lihualvsxau@126.com.
中图分类号:S831.2
文献标识码:A
文章编号:1671-5470(2016)04-0434-05
DOI:10.13323/j.cnki.j.fafu(nat.sci.).2016.04.011
Effects of exogenous injection specificity dsRNA of CART on production performance and egg quality for laying hen
LI Pengfei1, JING Jiongjie2, BI Xilin2, WANG Kai2, ZHANG Zining2, LÜ Lihua2
(1.College of Life Science; 2.College of Animal Science and Technology,Shanxi Agricultural University, Taigu, Shanxi 030801, China)
Abstract:To investigate the effect of cocaine-and amphetamine-regulated transcript (CART) on production performance and egg quality of laying hen in laying period, 500 20-week-old healthy highland brown laying hens were randomized into 5 groups with 4 replications per group. Four treatments, which included no injection as the control (group A), and injections with CART specificity of double-stranded RNA (dsRNA) on the 1st day (group B), every 40 d (group C), every 20 d (group D) and every 10 d (group E), were applied after hens were fed for 30 d. Egg production performance, including egg quantity, quality, and composition, and body weight of hens were measured after 120-day treatment. Results showed that body weight and laying rate varied significantly among treatment groups (P<0.05). All injected groups differed significantly from the control in average daily egg production (P<0.05), except that no difference existed between group B and the control. Feed intakes of all injected groups were significantly higher than the control (P<0.05), however, they were the same statistically among all injected groups. With regard to egg-feed ratio, all injected groups differed from the control (P<0.05), however, no difference existed among groups A, B and C, and between groups D and E. In a word, CART dsRNA exerts significant impacts on laying performance and body weight of laying hens but not on egg quality and components.
Key words:laying hen; double-stranded RNA (dsRNA); cocaine-and amphetamine-regulated transcript (CART); egg laying performance; egg quality

