毛竹IDD基因家族启动子分析
陈虹君, 高臻毅, 郭小勤
(浙江农林大学亚热带森林培育国家重点实验室培育基地,浙江 临安 311300)
毛竹IDD基因家族启动子分析
陈虹君, 高臻毅, 郭小勤
(浙江农林大学亚热带森林培育国家重点实验室培育基地,浙江 临安 311300)
摘要:IDD基因家族编码一种混合型的转录因子,多数参与植物的生长发育.真核基因的表达受多种因素的调控,其中启动子在转录水平上的调节作用至关重要.本研究截取毛竹IDD家族8个基因(PhIDD1-2, PhIDD4-8和PhID1)起始密码子前2 000 bp序列,顺式作用元件分析显示,这些基因启动子中均存在TATA框和CAAT框,除此之外,上游调控区域还存在光响应元件、激素响应元件、逆境胁迫元件以及其他响应元件,其中有些元件是某个基因所特有的,表现出该基因家族各基因独特的表达模式,也表明该家族基因的功能分化,参与植物发育的各个阶段.
关键词:毛竹; IDD基因家族; 启动子; 顺式元件
IDD基因家族属于锌指转录因子家族,在拟南芥(Arabidopsisthaliana)和水稻(Oryzasativa)基因组中分别有16个和15个成员[1],该家族成员编码一种混合型的转录因子,包含2个C2H2和2个C2HC两种锌指结构,这两个锌指结构与一个核定位信号及其周围的序列构成IDD-domain的结构特征[2-6].研究表明,IDD家族各基因在同物种中行使不同的生物学功能,多数参与植物生长发育.玉米(Zeamays)id1突变体在一个生长周期内不开花,一直维持着营养生长而不进行生殖生长[7];水稻中该基因的突变体生长570 d也未开花[8],说明ID1在玉米和水稻成花相变中起到一个“总开关”的作用,但在模式植物拟南芥中未发现其同源基因[9],说明ID1基因可能是禾本科植物所特有的[10-11].其他IDD基因在拟南芥中的生物学功能比较明确,AtIDD1调节激素信号和淀粉质胚乳[12];AtIDD8影响蔗糖运输与新陈代谢,并出现晚花表型[13-14];AtIDD14在冷处理条件下调控淀粉积累[15];AtIDD15调控重力感应和根的发育[16].毛竹IDD3基因与AtIDD14和AtIDD15关系较近,预示着PhIDD3在糖代谢、激素代谢、感应重力及根发育等方面可能发挥着作用;毛竹IDD7基因与OsDD10关系最近,水稻OsDD10参与铵吸收与N代谢,PhIDD7可能参与毛竹根吸收养分及代谢过程;毛竹ID1与OsID1和ZmID1的亲缘关系最近,推测PhID1可能也在毛竹成花转变过程中起重要作用,即在毛竹从营养生长向生殖生长转变的过程中起非常重要的作用[15,17].而孝顺竹(Bambusamultiplex)中的ID1基因则可以看成控制竹子的开花调节器[18].从结构上看,该基因家族均属于锌指转录因子,但执行不同的生物学功能.
真核生物基因的表达与调控是涉及生物本身与外界环境,生物体内多蛋白协同互作的复杂过程.调控可以在多层面上进行,如在DNA水平,转录及转录后水平、翻译及翻译后水平等.目前对基因表达调控研究较多集中在转录水平,因而,启动子的序列及其上面的顺式作用元件非常关键.目前对IDD基因家族的研究日益增多[17-18],但对其启动子的研究未见报道.本研究截取毛竹IDD基因家族的启动子序列,利用生物信息学方法预测顺式作用元件,以期探索毛竹中该基因家族不同成员的转录表达模式,为后续表达调控的研究提供依据.
1材料与方法
1.1启动子序列的确定
从毛竹数据库(http://202.127.18.221/bamboo/down.php)中下载毛竹全基因组序列、CDS序列,构建本地Blast数据库,以本研究组从孝顺竹中克隆得到的BmID1基因完整的cDNA序列和基因组序列进行本地Blast搜索,分析毛竹9个IDD基因与上游基因之间的间距,对于间距大于2 000 bp的IDD基因,获取翻译起始密码子上游2 000 bp序列,剔除长度小于2 000 bp的序列,所获序列用于顺式作用元件预测.
1.2顺式响应元件分析
利用DNAman(Ver. 6.0.3.99)对毛竹IDD基因家族启动子序列进行序列比对.利用NCBI中的BLAST[19](http://blast. ncbi.nlm. nih. gov/)对IDD家族各基因启动子序列一致性进行分析,再利用Plant CARE database(plant cis-acting regulatory element database, http://bioinformatics.psb.ugent.be/webtools /plantcare/ html/)[20]对毛竹IDD基因家族启动子序列进行分析,预测可能存在的 TATA-box,CAAT-box以及顺式作用元件.
2结果与分析
2.1启动子序列比较
通过序列分析发现,PhIDD3基因启动子序列含有较多的N,该基因启动子不用于后续分析.最终从毛竹基因组上获得8个IDD基因(PhIDD1-2,PhIDD4-8和PhID1)的启动子序列.序列比对结果显示,各启动子的序列一致性仅为43.80%,表明各基因的启动子是特异的.
2.2TATA box和CAAT box元件分析
Plant CARE软件分析显示,8个启动子序列均存在核心启动子元件TATA-box和CAAT-box(表1),但数量差异较大.PhIDD5有27个TATA-box元件,数量最多,PhID1有9个TATA-box元件,数量最少.PhIDD6有最多的CAAT-box元件,PhIDD1的CAAT-box元件最少,只有2个.

表1 IDD基因家族启动子TATA box和CAAT box分析
2.3顺式作用元件分析
根据 Plant CARE预测结果,基于各顺式作用元件潜在的响应功能,对启动子的顺式作用元件进行了分类,除基本的启动子结构元件外,IDD基因启动子中还存在较多的光调控元件、激素响应元件、胁迫响应元件、温度响应元件和其他顺式元件(表2).
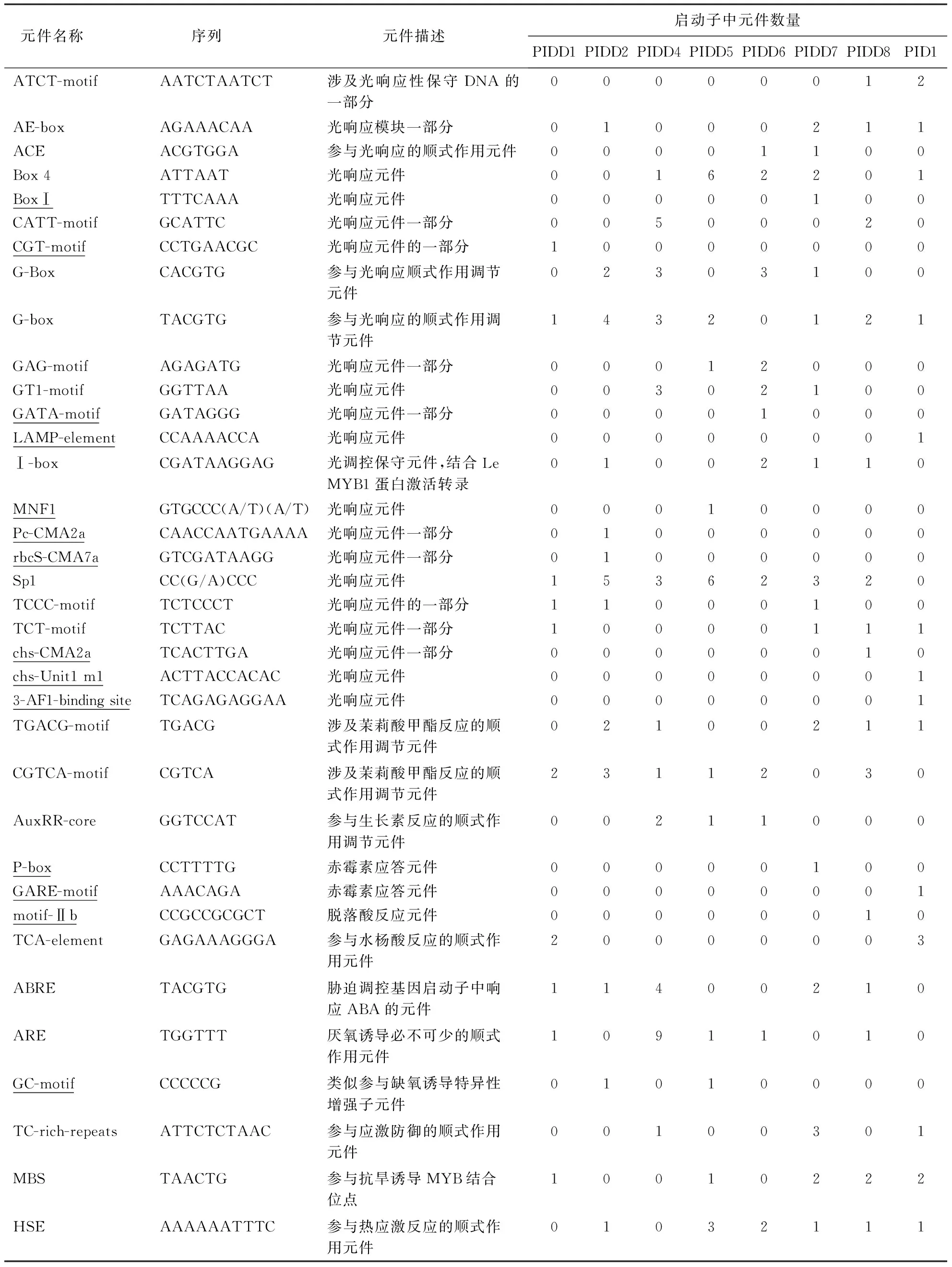
表2 IDD基因启动子序列中的顺式作用元件1)
续表2
1)下划线为毛竹各个启动子中所特有的元件.
2.3.1与光相关的顺式元件IDD基因家族8个基因的启动子含有23种光调控元件,这些启动子中都存在着一些典型的光元件,如G-box与GT1.G-box序列是普遍存在于植物基因启动子区的一类顺式作用元件,是bZIP蛋白与核DNA相结合的位点,在基因的转录调节中有着非常重要的地位,且与花特异表达有关[21-23],该元件参与脱落酸响应与光反应,必须和其它的光元件组合才能使启动子具有光调节特性,且类型和数量不同的光元件具有不同光调控特性[24],含有该元件的基因的表达可能受到ABA和光调节共同表达控制.还有一些元件是某个启动子所特有的,如BoxⅠ元件仅存在启动子PIDD7中,CGT-motif元件仅存在于启动子PIDD1中,而启动子PID1中含3个特异的光响应元件(LAMP-element、chs-Unit1 m1和3-AF1-binding site),表明这些基因存在有特异的表达特性.因此,IDD基因家族光元件种类、数量及与彼此之间距离,可能影响各个基因的转录造成不同光调控特性.
2.3.2与植物激素和胁迫相关的顺式元件除诸多光保守元件外,也有很多与激素和胁迫响应有关的作用元件,包括响应茉莉酸甲酯、生长素、赤霉素、脱落酸及水杨酸等激素的元件,如响应茉莉酸甲酯的CGTCA-motif和TGACG-motif元件,可以调控植物防御基因表达,诱导植物的化学防御,产生与机械损伤和昆虫取食相似的效果.水杨酸响应的TCA-element元件,可以参与水杨酸的反应.水杨酸与茉莉酸在植物抵抗外界伤害的生化防御系统中是最重要的两种信号分子,因此含有这两个元件的基因有很强的防御能力,PhIDD1和PhID1基因启动子中均含有这两个元件,说明这两个基因受外界环境胁迫后会表现出强烈的响应.其他各基因启动子中也分别含有不同的激素响应元件,表明该基因家族各基因均会不同程度参与逆境胁迫.赤霉素应答元件P-box和GARE-motif分别为基因PhIDD7和PhID1启动子所特有,表明这两个基因可能对赤霉素调控途径有一定作用.PhIDD8基因启动子中特异含有一个与脱落酸响应相关的元件motif-Ⅱb,表明该基因可能调控植物叶子的脱落过程.
该基因家族启动子中还存在与逆境胁迫相关的元件,如参与抗旱诱导MYB结合位点的MBS元件,和参与热应激反应的HSE元件.响应真菌诱导的Box-W1元件,含有该元件的启动子可能受真菌诱导后,激发下游基因表达变化,调节次生代谢产物合成途径中酶的活性,诱导特定次生代谢产物的生成和累积.
2.3.3与温度相关的顺式元件该基因家族PhIDD2、PhIDD6、PhIDD7和PhIDD8启动子中均仅存在一个涉及低温响应的顺式作用元件LTR,暗示这几个基因会受外界低温诱导表达.
2.3.4其他顺式元件在器官特异性元件中,启动子序列含有分生组织表达调控元件CAT-box、CCGTCC-box和NON-box,胚乳表达相关元件GCN4-motif和Skn-1-motif,在特异代谢调控元件中,启动子序列含有玉米醇溶蛋白代谢调控顺式元件O2-site.
此外,还包含许多组织特异性调控元件,如CAT-box是分生组织表达相关的顺式作用调节元件,GCN4-motif和Skn-1-motif是胚乳表达所需的顺式作用调节元件,高转录水平作用元件5UTR-Py-rich stretch,HD-Zip 1是栅栏叶肉细胞分化元件,HD-Zip 2是叶片形态控制元件.HD-Zip转录因子家族成员通过与其他蛋白互作,参与激素介导的信号途径,从而调控植物光形态建成、生长发育、果实发育、花发育和植物对逆境应答等生物学过程.这些纷繁复杂的作用元件的存在,表明IDD基因的表达受到复杂的调控网络调控.综上分析,认为IDD基因启动子具有诱导型启动子特征,并且有着各自不同的诱导响应模式.
3讨论
IDD基因家族属于混合型的锌指转录因子家族,在拟南芥和水稻基因组中分别有16个和15个成员[1],在毛竹中至少发现9个成员[17],但在毛竹注释的3.2万个基因库中(http://202.127.18.221/bamboo/down.php)仅找到2个,表明该基因家族中各基因表达量比较低.绿竹(Bambusaoldhami)中BmID1基因也显示出极低的表达特性[18].
本研究从已公布的毛竹基因组序列中,截取9个IDD基因起始密码子上游2 000 bp的序列(PhIDD3基因启动子区包含多N区域,剔除)用于顺式作用元件预测,不同启动子中所含的核心启动元件TATA-box和CAAT-box的数量不同.TATA-box是基因启动子的基本结构特征,是RNA聚合酶决定转录起始的位点,能指导起始前复合物的形成.CAAT-box可以极大提高基本启动子的低水平转录活性[25].所以基因启动子中TATA-box和CAAT-box数量越多的,其活性也越高.但从本文的研究结果看,虽然PhIDD6和PhID1基因启动子上TATA-box和CAAT-box的数量比较多,但cDNA库中未找到这2个基因,可能与构建cDNA文库的取样时间有关.
根据生物信息学分析预测,在IDD基因家族启动子中,光响应元件占据很大一部分,约占1/2,说明光照对这些基因的表达有很大影响.多数基因启动子中含有HSE元件,植物为了适应不良环境而在进化过程中形成复杂的适应机制,该元件还可以激活HSP基因的表达,增强植物对高温环境的耐受力,表明这些基因在植物逆境胁迫调节中起着重要作用.含有SP1和G-box元件的启动子,可以驱动下游基因在多种逆境下表达.ABRE元件对ABA诱导产生应答反应,在植物遭受干旱、冷、高盐等多种逆境胁迫时起到重要作用.对玉米、拟南芥和水稻的全基因组启动子的挖掘还揭示了ABRE在干旱诱导型启动子中的保守性.
启动子元件预测结果还显示,IDD基因启动子含有茉莉酸甲酯响应元件和水杨酸响应元件.水杨酸是抗病基因特异的植物系统性抗病反应的重要信号分子,参与植物的过敏反应和系统获得抗性反应[26],是植物产生系统抗性所必需的内源信号分子[27];而茉莉酸甲酯可作为病原物、激发子及创伤诱导植物防卫基因表达的信号分子[28].现已有许多报道[28-31]表明,茉莉酸甲酯诱导抗病性途径与水杨酸等有所不同,但不同途径之间存在协同或拮抗作用.由此推测IDD基因家族成员可能各自存在不同的茉莉酸甲酯和水杨酸特异性诱导的抗病性表达机制.植物基因启动子元件的多元化,以及与启动子结合的转录因子的多样性,决定了启动子的作用机制是一个十分复杂的过程[25],而毛竹IDD基因启动子中的各相关元件具体是如何行使其功能的?启动子含有较多的与光相关的作用元件,这些基因与植物生长发育有什么关系?启动子中各个元件的特异性较强,在进化上有什么作用?IDD基因这些问题都是目前研究的关键,有关IDD基因启动子许多问题还需要继续探索.因此启动子作用元件的预测,可以为后续试验提供理论依据和研究侧重方向.
参考文献
[1] 张丽娟.IDD转录因子家族在水稻根系的表达分析和功能鉴定[D].华中农业大学,2010.
[2] COLASANTI J, TREMBLAY R, WONG A Y, et al. The maize INDETERMINATE1 flowering time regulator defines a highly conserved zinc finger protein family in higher plants[J]. BMC Genomics, 2006,7:1-15.
[3] WU C, YOU C, LI C, et al.RID1, encodinga Cys2/His2-type zinc finger transcription factor, acts as a master switch from vegetative to floral development in rice[J]. Proceedings of the National Academy of Sciences of the United States of America, 2008,105(35):12 915-12 920.
[4] WONG A, COLASANTI J. Maize floral regulator protein INDETERMINATE1 is localized to developing leaves and is not altered by light or the sink/source transition[J]. Journal of Experimental Botany, 2007,58:403-414.
[5] MATSUBARA K, YAMANOUCHI U, WANG Z, et al. Ehd2, a rice ortholog of the maize INDETERMINATE1 gene, promotes flowering by up-regulating Ehd1[J]. Plant Physiology, 2008,148:1 425-1 435.
[6] PARK S, KIM S, LEE S, et al. Rice indeterminate1( OsId1) is necessary for the expression of Ehd1 (Early headingdate1) regardless of photoperiod[J]. The Plant Journal, 2008,56:1 018-1 029.
[7] COLASANTI J, YUAN Z, SUNDARESAN V. The indeterminate gene encodes a zinc finger protein and regulates a leaf-generated signal required for the transition to flowering in maize[J]. Cell, 1998,93:593-603.
[8] WOLBERGER C. Multiprotein-DNA complexes in transcriptional regulation[J]. Annual Review of Biophysics and Biomolecular Structure, 1999,28:29-56.
[9] FEURTADO J A, HUANG D Q, WICKISTORDEUR L, et al. TheArabidopsisC2H2 zinc finger INDETERMINATE DOMAIN1/ENHYDROUS promotes the transition to germination by regulating light and hormonal signaling during seed maturation[J]. Plant Cell, 2011,23:1 772-1 794.
[10] SEO P J, KIM M J, RYU J Y, et al. Two splice variants of theIDD1 transcription factor competitively form nonfunctional heterodimers, which may regulate starch metabolism[J]. Nature Communications, 2011a,2:303.
[11] SEO P J, RYU J Y, KANG S K, et al. Modulation of sugar metabolism by an INDETERMINATE DOMAIN transcription factor contributes to photoperiodic flowering inArabidopsis[J]. Plant Journal, 2011b,65:418-429.
[12] WELCH D, HASSAN H, BLILOU I, et al.ArabidopsisJACKDAW and MAGPIE zinc finger proteins delimit asymmetric cell division and stabilize tissue boundaries by restricting SHORT-ROOT action[J]. Genes and Development, 2007,21:2 196-2 204.
[13] KIKUCHI R, KAWAHIGASHI H, OSHIMA M, et al. The differential expression of HvCO9, a member of the CONSTANS-like gene family, contributes to the control of flowering under short-day conditions in barley[J]. Journal of Experimental Botany, 2012,63:773-784.
[14] TSUJI H, TAOKA K, SHIMAMOTO K. Regulation of flowering in rice: two florigen genes, a complex gene network, and natural variation[J]. Current Opinion in Plant Biology, 2011,14:45-52.
[15] INGKASUWAN P, SUPATCHAREE N, SUKON P , et al. Inferring transcriptional gene regulation network of starch metabolisminArabidopsisthalianaleaves using graphical Gaussianmodel[J]. BMC Systems Biology, 2012,6:100.
[16] TANIMOTO M, TREMBIAY R, COLASANTI J. Altered gravitropic response, amyloplast sedimentation and circumnutation in theArabidopsisshoot gravitropism 5 mutants are associated with reduced starch levels[J]. Plant Molecular Biology, 2008,67:57-66.
[17] 关鹰,许在恩,郭小勤.毛竹IDD基因家族的生物信息学分析[J].核农学报,2014,28(6):998-1 005.
[18] GUO X Q, GUAN Y, XIAO G H, et al. Isolation and characterization of anIndeterminate1 gene, BmID1, from bamboo (Bambusamultiplex)[J]. Journal of Plant Biochemistry and Biotechnology, 2015, DOI: 10. 1007/s13562-015-0304-z.
[19] ALTSCHUL S F, MADDEN T L, SCHFFER A A, et al. Gapped BLAST and PSI-BLAST: A new generation of protein database search programs[J]. Nucleic Acids Res, 1997,25:3 389-3 402.
[20] LESCOT M, DEHAIS P, THIJS G, et al. Plant CARE, a database of plant cis-acting regulatory elements and a portal to tools for in silico analysis of promoter sequences[J]. Nucleic Acids Res, 2002,30:325-327.
[21] HARTER K, KIRCHER S, FROHNMEYER H. Light-regulated modification and nuclear translocation of cytosolic G-box binding factors in parsley. Plant Cell, l 1994,6(4):545-559.
[22] KIRCHER S, WELLMER F, NICK P. Nuclear import of the parsley bZIP transcription factor CPRF2 is regulated by phytochrome photoreceptors[J]. CellBio, 1999,144(2):201-211.
[23] GUILIANO G, PICHERSKY E, MA1IKV S. An evolutionary conserved protein binding sequence upstream of a plant light-regulated gene. PANS, 1988,85(19):7 089-7 093.
[24] JIN S X, KANAGARAJ A, VERMA D, et al. Release of hormones from conjugates: chloroplast expression of beta-glucosidase results in elevated phytohormone levels associated with significant increase in biomass and protection from aphids or whiteflies conferred by sucrose esters[J]. Plant Physiology, 2011,155:222-235.
[25] 张计育,王庆菊,郭忠仁.植物AP2/ERF类转录因子研究进展[J].遗传,2012,34(7):835-847.
[26] 李广平,张长青,章镇,等.中国李pgip启动子的克隆及调控元件分析[J].园艺学报,2009,36(10):1 425-1 430.
[27] KLESSIG D F, MALAMY J. The salicylic acid signal in plants. Plant Molecular Biology[J]. 1994,26:1 439-1 458.
[28] TITARENKO E, ROJO E, LEON J, et al. Jasmonic acid-dependent and-independent signaling pathways control wound-induced gene activation inArabidopsisthaliana[J]. Plant Physiol, 1997,115:817-826.
[29] BERGMANN C W, ITO Y, SINGER D, et al. Polygalacturonase-inhibiting protein accumulates inPhaseolusvulgarisL. in response to wounding, elicitors and fungal infectio[J]. Plantn, 1994,5(5):625-634.
[30] KACHROO P, YOSHIOKA K, SHAH J, et al. Resistance to turnp crinkle virus inArabidopsisis regulated by two host genes and is salicylic acid dependent but NPR1, ethylene, and jasmonate independent[J]. Plant Cell, 2000,12:677-690.
[31] VAN WEES S C M, DE SWART ERIK A, M, VAN PELT JOHAN A, et al. Enhancement of induced disease resistance by simultaneous activation of salicylate-and jasmonate-dependent defense pathways inArabidopsisthaliana[J]. Proc Natl Acad Sci USA, 2000,97(15):8 711-8 716.
(责任编辑:吴显达)
收稿日期:2015-11-16修回日期:2015-12-04
基金项目:浙江省自然科学基金项目(Y307499, LY13C160011).
作者简介:陈虹君(1989-),女,硕士研究生, 研究方向:植物分子生物学.Email:chenhongjun1114@126.com.通讯作者郭小勤(1975-),女,副教授. 研究方向:植物生物技术.Email:xqguo@zafu.edu.cn.
中图分类号:S795
文献标识码:A
文章编号:1671-5470(2016)04-0427-07
DOI:10.13323/j.cnki.j.fafu(nat.sci.).2016.04.010
Analysis on promoter ofIDDgene family inPhyllostachysedulis
CHEN Hongjun, GAO Zhenyi, GUO Xiaoqin
(Nurturing Station of State Key Laboratory of Subtropical Silviculture, Zhejiang A&F University, Lin'an, Zhejiang, 311300, China)
Abstract:IDD gene family, which encode hybrid transcription factor, are mostly involved in regulating plant growth and development. To elucidate the function of upstream cis-elements of PhIDD gene family, upstream sequences of start codons of 8 IDD genes (PhIDD1-2, PhIDD4-8 and PhID1) at the length of 2 000 bp in Phyllostachys edulis were obtained and analyzed by bioinformatics methods. Results indicated that there were TATA box and CAAT box in all promoter sequences. Various conservative elements existed in the promoter sequence, including light responsive element, phytohormone responsive element, stress responsive element, etc. Some cis-elements were specific to certain genes, suggesting that each gene in this family may show distinctive expression pattern and play different roles in plant growth and development.
Key words:Phyllostachys edulis; IDD gene family; promoter; cis-element

