补充水解胶原蛋白与跑台运动联合作用对生长期大鼠骨密度和组织形态计量学指标的影响
马涛+苏红燕
摘要:目的:从补充水解胶原蛋白(hydrolyzed collagen,HC)和跑台运动两个方面探索促进生长期骨生长的有效途径。方法:4周龄雄性SD大鼠48只,随机分为6组,每组8只:正常对照组(CON)、6%HC补充组(HC6)、12%HC补充组(HC12)、跑台运动组(CON+Ex)、6%HC补充+跑台运动组(HC6+Ex)和12%HC补充+跑台运动组(HC12+Ex)。跑台训练速度为30 m/min,每次训练60 min,每周训练6 d,共训练8 w。8w后测试各组大鼠股骨骨密度(bone mineral density,BMD)和形态学指标以及胫骨松质骨组织形态计量学指标。结果:与其相应的对照组相比,补充HC组与运动组大鼠股骨BMD和形态学指标,以及胫骨松质骨组织形态计量学指标均显著增加;高剂量补充HC组与中等剂量补充HC组相比,其上述指标差异无统计学意义;补充HC与跑台训练联合干预组与单纯补充HC组或单纯跑台训练组相比,上述指标均显著增加。结论:补充HC与跑台运动均能有效促进生长期的骨生长;中等剂量的HC补充即能较好地促进生长期的骨生长,而高剂量的补充并不能起到更好效果;补充HC与跑台运动具有协同作用,其效果优于单纯补充HC或单纯跑台运动。
关键词:水解胶原蛋白;跑台运动;骨密度;组织形态计量学
中图分类号:G804.4 文献标识码:A 文章编号:1006-2076(2016)04-0077-08
Abstract:Objective:This study aimed to explore effective ways to promote growth of growing bone from supplement hydrolyzed collagen and treadmill exercise. Methods:Forty-eight male SD rats, 4 weeks of age, were randomly divided into six groups and assigned as follows: normal control group (CON), 6%HC supplemented group (HC6), 12%HC supplemented group (HC12), treadmill exercise group (CON+Ex), 6%HC + supplement treadmill exercise group (HC6+Ex)and 12%HC + supplement treadmill exercise group (HC12+Ex), each group of eight rats. Rats treadmill trained speed is 30m/min, eight weeks of training, training six days a week, 60 minutes a day of
training.After eight weeks, bone mineral density and morphological indicators of femur and histomorphometry indexes of tibia cancellous bone in each group were tested.Results:Compared with the corresponding control groups, bone mineral density and morphological indicators of femur and histomorphometry indexes of tibia cancellous bone in supplemented HC group and the exercise group were significantly increased. Compared with moderate-dose HC supplements group, the difference of these indexes in high-dose HC supplement group were not statistically significant. Compared with simply HC supplement group and simply treadmill training group, these indexes in combined HC supplement with treadmill training group were significantly increased.Conclusion:Supplementary HC and treadmill exercise both can effectively promote growth of growing bone. Moderate doses of HC supplement can better promote growth of growing bone, high-dose supplementation did not play better results. HC supplement with treadmill exercise have a synergistic effect, the effect is better than simply HC supplements and simply treadmill exercise.
Key words: hydrolyzed collagen; treadmill exercise; bone mineral density; histomorphometry
生长发育期是骨量增长的一个关键时期,此期间骨量的快速获得,是与骨骼本身处于突增生长阶段相吻合的。人生的最初20年里所获得的骨量可以达到其峰值骨量(PBM,Peak bone mass)的90%~99%,峰值骨量是维持成人生命的“骨库”,因而青少年时期骨量的获得对其成年后骨骼的健康起着决定性的作用[1]。峰值骨量的水平与成年后患骨质疏松症的可能性密切相关[2]。因此,在生长期获得尽可能高的基础骨量,对提高骨量峰值以及保证成年后的骨健康具有重要的意义。
业已证明,在生长期,适宜的机械负荷刺激(如体力劳动或体育运动)对于提高峰值骨量具有重要作用[3]。除此之外,营养因素(如蛋白质的摄入)也是影响骨形成的重要因素之一[4]。因此,为了能够提高峰值骨量,在生长期要经常参加体育活动以使骨组织经常受到机械负荷刺激,而且通过营养补充摄取足够的蛋白质也是必不可少的。就青少年运动员来说,他们在经历高水平的体育锻炼的同时,虽也摄取了足够的蛋白质[5],然而体育锻炼和蛋白质摄入对于其骨组织生长的影响并没有得到充分的研究。已有研究显示,补充水解胶原蛋白(hydrolyzed collagen,HC)可以有效减缓随年龄增长而增加的骨质流失,然而,关于补充HC与运动联合作用对生长期骨量影响的研究还未见报道。本研究通过对补充HC与跑台运动联合作用对生长期大鼠BMD和组织形态计量学指标影响的研究,旨在从营养和运动两个方面探索促进生长期骨生长的有效途径,为提高青少年峰值骨量和保证成年后的骨健康提供有效方法和理论依据。
1 材料与方法
1.1 实验动物及分组
4周龄雄性SD大鼠48只,体重(89.26±6.32)g,购于上海西普尔-必凯实验动物有限公司[许可证号为SCXK(沪)2003-0002]。在标准的实验室环境下分笼饲养,环境温度为(22±1)℃,光照遵循12 h:12 h明暗周期。动物购回适应本实验室环境和饮食1周后,被随机分为6组,每组8只:正常对照组(CON)、6%HC补充组(HC6)、12%HC补充组(HC12)、跑台运动组(CON+Ex)、6%HC补充+跑台运动组(HC6+Ex)和12%HC补充+跑台运动组(HC12+Ex)。大鼠分笼饲养,各组大鼠每日提供足够食物,自由饮水,每周记录大鼠体重和进食量。
1.2 HC补充方案
HC的补充是通过动物食物配方的改变实现的,各组大鼠食物的蛋白含量如下:CON组和CON+Ex组大鼠食物均为标准啮齿类动物饲料,其中蛋白总含量为20%,蛋白中不含HC蛋白;HC6组和HC6+Ex组大鼠为中等剂量HC补充组,其食物蛋白含量为:HC蛋白含量为6%,蛋白总含量为20%;HC12组和HC12+Ex组大鼠为高剂量HC补充组,其食物蛋白含量为:HC蛋白含量为12%,蛋白总含量为20%。
1.3 跑台训练方案
CON+Ex组、HC6+Ex组和HC12+Ex组大鼠每周跑台训练6 d,共训练8 w。跑速从首次训练的10 m/min以每日5 m/min的速度逐渐递增为30 m/min,每日训练时间从首次训练的35 min开始,以每日5 min的速度逐渐递增为60 min。从第二周开始,大鼠每日训练时间固定为60 min,跑速固定为30 m/min。
1.4 取材
于跑台训练组大鼠最后一次训练结束24小时后,称量大鼠体重,断颈椎处死所有大鼠。分离大鼠左侧股骨和胫骨,用镊子和纱布除去骨表面的软组织,用游标卡尺测量股骨的形态学指标后,将股骨用浸透生理盐水的纱布包好,放于-20 ℃ 冰箱内保存待测BMD,将胫骨投于10%甲醛溶液中进行固定,待测组织形态计量学指标。
1.5 测试方法
1.5.1 体重及进食量的测定
饲养期间每周固定时间用YP601N电子分析天平测试各小鼠体重并记录,最后一次体重测试在小鼠处死前一天晚上进行;每周用YP601N电子分析天平称量各笼大鼠饲料添加量和剩余量并记录。
1.5.2 游标卡尺测量股骨的形态学指标
分离大鼠左侧股骨和胫骨后,用游标卡尺(精确度为0.02 mm)测量股骨的长度、近端厚度(矢状径)和宽度(额状径)、远端厚度(矢状径)和宽度(额状径)、中段厚度(矢状径)和宽度(额状径)。
1.5.3 Kodak 双能X 射线骨密度仪测量股骨干骺端BMD
从- 20℃冰箱中取出左侧股骨,室温自然解冻,用Kodak 双能X 射线骨密度仪和Carestream 骨密度分析软件测量股骨远端干骺端BMD(图1)。
1.5.4 胫骨组织形态计量学指标的测定
所有大鼠分别于处死前第10天和第3天腹腔注射盐酸四环素(购于上海生工生物工程技术服务有限公司)。处死后,取左侧胫骨经10%甲醛溶液固定2天,流水冲洗2小时,酒精梯度脱水(75%、85%、95%、100%各2天),甲基丙烯酸甲酯(MMA)包埋,室温干燥后在德国LEICA SP1600切片机上进行50 μm切片,一部分在荧光显微镜(日本Olympus IX71)下直接观察荧光标记并拍片,观察位置在距骺线1~4 mm 范围;另一部分经磨成5 μm的薄片后,HE染色,在日本产Olympus IX71显微镜下观察并拍片,观察位置在距骺线1~4 mm范围。测量参数如下:
骨小梁体积(TBV,trabecular volume),指骨小梁体积占松质骨总体积的百分比。骨小梁宽度(Tb. Wi,trabecular width),单位为μm。骨小梁数目(Tb. N,trabecular number),单位为个/mm。皮质骨矿化沉积率(MAR,mineral apposition rate),荧光双标记带间的距离除以二次标记相隔的天数,单位为μm/d。
1.6 统计处理
各检测结果以[AKX-]±S表示,用SPSS12.0软件进行统计分析。首先,使用多因素方差分析(MANOVA)对数据进行统计学检验,如果发现有显著性差异,运动组和非运动组之间、不同剂量HC补充组之间采用单因素方差分析(ANOVA)进行检验,实验前及8周实验后数据检验采用配对T检验(Paired T test)。以P<0.05为差异显著性标准,以P<0.01为差异非常显著性标准。
2 结果
2.1 各组大鼠的进食量
由图2可知,随着大鼠的生长,其进食量也有一定的增加,而各组大鼠进食量的差异无统计学意义(P>0.05)。
2.2 各组大鼠实验前后体重变化
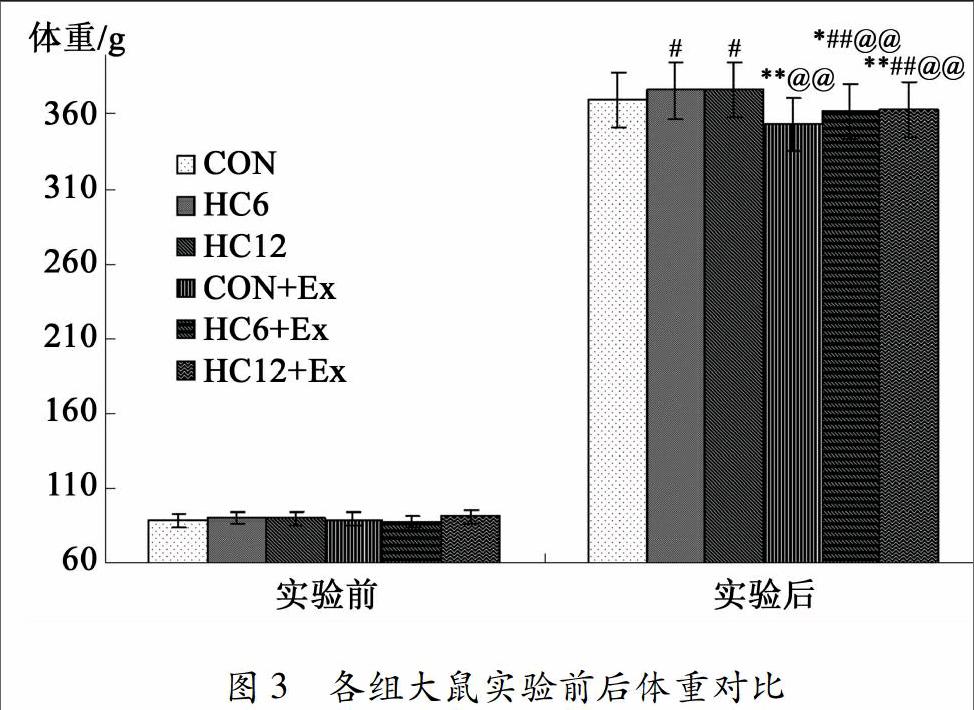
实验前各组大鼠体重差异无统计学意义(P>0.05);实验后各组大鼠体重均比实验前有较大幅度的增长(P<0.01);实验后补充HC组与其对应的正常饲养组相比(即HC6、HC12与CON相比,或者HC6+Ex、HC12+Ex与CON+Ex相比),大鼠体重显著增加(P<0.05或P<0.01);而高剂量补充HC组与中等剂量补充HC组相比(即HC12与HC6相比,或HC12+Ex 与HC6+Ex相比),其体重差异无统计学意义(P>0.05);而运动各组(CON+Ex、HC6+Ex、HC12+Ex)大鼠体重与其对应的非运动组(CON、HC6、HC12)大鼠相比,体重均显著下降(P<0.01)(见图3)。
2.3 各组大鼠股骨形态学指标比较
由表1和表2可知:补充HC组与其对应的正常饲养组相比(即HC6、HC12与CON相比,或者HC6+Ex、HC12+Ex与CON+Ex相比),大鼠股骨形态各项指标均显著增加(P<0.05或P<0.01);而高剂量补充HC组与中等剂量补充胶原蛋白组相比(即HC12与HC6相比,或者HC12+Ex与HC6+Ex相比),其股骨形态学各项指标差异无统计学意义(P>0.05);运动各组(CON+Ex、HC6+Ex、HC12+Ex)与其对应的非运动组(CON、HC6、HC12)相比,大鼠股骨形态学各指标均显著增加(P<0.01或P<0.01);而补充HC与跑台训练联合干预组(HC6+Ex或HC12+Ex)与单纯补充HC组(HC6或HC12)或单纯跑台训练组(CON+Ex)相比,大鼠股骨形态学各指标均显著增加(P<0.05或P<0.01)。
2.4 各组大鼠股骨干骺端BMD比较
由图4可知:补充HC组与其对应的正常饲养组相比(即HC6、HC12与CON相比,或者HC6+Ex、HC12+Ex与CON+Ex相比),大鼠股骨干骺端BMD均显著增加(P<0.05或P<0.01);而高剂量补充HC组与中等剂量补充HC组相比(即HC12与HC6相比,或者HC12+Ex与HC6+Ex相比),其股骨干骺端BMD差异无统计学意义(P>0.05);运动各组(CON+Ex、HC6+Ex、HC12+Ex)与其对应的非运动组(CON、HC6、HC12)相比,大鼠股骨干骺端BMD均显著增加(P<0.01);而补充HC与跑台训练联合干预组(HC6+Ex或HC12+Ex)与单纯补充HC组(HC6或HC12)或单纯跑台训练组(CON+Ex)相比,大鼠股骨形态学各指标均显著增加(P<0.05或P<0.01)。
2.5 各组大鼠胫骨干骺端骨组织形态计量学指标比较
图5和图6分别是大鼠胫骨干骺端松质骨骨小梁HE染色图片及皮质骨荧光双标记图片。统计结果显示:补充HC组与其对应的正常饲养组相比(即HC6、HC12与CON相比,或者HC6+Ex、HC12+Ex与CON+Ex相比),大鼠胫骨干骺端组织形态计量学指标均显著增加(P<0.05或P<0.01);而高剂量补充HC组与中等剂量补充HC组相比(即HC12与HC6相比,或者HC12+Ex与HC6+Ex相比),其胫骨干骺端组织形态计量学指标差异无统计学意义(P>0.05);运动各组(CON+Ex、HC6+Ex、HC12+Ex)与其对应的非运动组(CON、HC6、HC12)相比,大鼠胫骨干骺端组织形态计量学指标均显著增加(P<0.01);而补充HC与跑台训练联合干预组(HC6+Ex或HC12+Ex)与单纯补充HC组(HC6或HC12)或单纯跑台训练组(CON+Ex)相比,大鼠胫骨干骺端组织形态计量学指标均显著增加(P<0.05或P<0.01)(见图7)。3 分析与讨论
3.1 跑台运动与生长期骨生长
骨组织是一种代谢非常活跃的组织,其外部形态和内部结构都与其自身所处的力学环境密切相关。美国骨生理学家Harold Frost[6]的研究和论断被人们称为机械应力调控骨重建的最经典理论。Harold Frost认为,机械力因素(如骨骼肌施加在骨组织上的力以及体力活动对骨组织的机械应力等)对骨组织的生理过程起着决定性作用,骨组织所受机械负荷的变化影响着骨代谢激素的反应,从而对骨钙含量进行调节。运动可以看做是对骨组织的一种机械刺激,这种机械刺激同样可以调节骨代谢,优化骨结构。在本实验室的前期研究中[7-9],发现运动可显著提高生长期大鼠和骨质疏松模型大鼠BMD并优化其松质骨骨小梁结构。国外的大量研究也表明[10],体力活动或体育运动可显著提高生长期青少年儿童骨组织的生长发育,使BMD和骨强度均显著增加。在本研究中,运动方式采用的是动物跑台运动,根据Wheeler DL等人报道[11],30 m/min的跑速相当于大鼠60%~70% VO2max的运动强度。考虑到过大的运动强度可能会对骨代谢产生不利的影响,反而会影响大鼠骨组织的生长[12],故本研究也采取了30 m/min的速度作为大鼠的跑速。此外,在本研究中,大鼠的跑台训练周期选择为8周,这是根据大鼠的寿命周期长度安排的,由文献[13]可知,SD大鼠的寿命为2~3年,而8周约占大鼠整个生命周期的6%~7%,相当于人类生命周期中的4~5年(按照平均寿命75岁计算)。由此可见,对于SD大鼠来说,8周的跑台训练应属于较长时间的系统的训练。
BMD是指单位体积内的骨矿含量,是影响骨组织力学性能的一个重要指标,目前国内外均把BMD作为评价骨强度的一个最方便、最常用的临床指标[14]。本研究结果显示,跑台运动可显著提高生长期大鼠股骨BMD,和本实验室前期研究结果[7-8]一致。近年来的研究表明[15],尽管骨组织的力学性能80%由BMD决定,但是骨组织的力学性能还与其内部结构密切有关,尤其对于对松质骨而言,骨小梁三维构筑方式以及骨小梁间的连接性与骨强度密切相关。骨小梁体积(TBV)反映的是单位体积内骨小梁所占的体积百分比,即骨小梁的疏密程度,它同骨小梁宽度(Tb.Wi)和骨小梁数目(Tb.N)共同反映了松质骨中骨小梁的三维结构。本研究结果显示,跑台运动组大鼠股骨长度、宽度和厚度指标均显著增加,胫骨组织形态计量学指标TBV、Tb.Wi和Tb.N均显著增加,表明跑台运动可促进皮质骨的生长和松质骨骨小梁的三维结构重建,使骨组织更致密,从而增加骨组织的生物力学强度。四环素是一种活性荧光物质,进入血液循环与无机盐结合沉积于骨组织矿化前沿,在荧光显微镜下,可见到首次标记线埋于近小梁表面的骨基质中;第二条标记线更靠近骨表面。皮质骨矿化沉积率(MAR)是荧光双标记带间的距离除以两次荧光标记相隔的天数,单位为μm/d,它是反映骨生长速率的指标,它代表成骨细胞矿化类骨质的速度[16]。本研究结果显示,跑台运动组大鼠MAR显著大于非跑台运动组大鼠,说明跑台运动可以增加成骨细胞的活性,提高其类骨质分泌与矿化的速度,促进骨的生长。
3.2 补充HC与生长期骨生长
Ⅰ型胶原蛋白是一种主要的结构蛋白,更是骨组织进行钙化的主要的细胞外基质蛋白,它广泛分布于人类机体的各种组织,大约占身体蛋白总量的25%,在人类结缔组织中Ⅰ型胶原蛋白的比例更是达到了80%[17]。研究证明,Ⅰ型胶原蛋白的合成对于进一步促进成骨细胞的分化至关重要[18-19]。业已证明,动物服用HC可以有效提高BMD和骨矿含量(bone mineral content,BMC)[20],服用HC也能够显著增加去卵巢大鼠骨基质中Ⅰ型胶原蛋白的含量[21]。而且,骨质疏松患者在注射降钙素的同时口服HC能够比单纯注射降钙素具有更强的对抗骨质流失的作用[22]。Guillerminet 等人的研究表明[23],食用含HC蛋白的食物比食用标准的AIN-93N 食物能够有效提高去卵巢小鼠的BMD。Mizoguchi 等人发现[24],摄取含HC蛋白的食物在显著增加去卵巢大鼠股骨BMD和骨强度的同时,能够显著提高血清骨钙素(成骨作用标志物),说明补充HC能够促进成骨细胞的成骨作用。而且血清羟脯氨酸和甘氨酸水平增加,说明补充HC可显著提高血清氨基酸水平,这对合成骨组织蛋白十分重要。此外,体外实验表明[25],在成骨细胞培养体系中,HC能够显著提高碱性磷酸酶(成骨作用标志酶)的活性。这些研究结果表明,口服胶原蛋白肽能够有效阻止增龄性骨质流失,然而,至今仍然没有研究证明口服胶原蛋白肽是否也能够增加生长期的骨形成作用。本研究的结果显示,补充HC能够增加生长期大鼠的BMD,提高其骨组织形态计量学指标,使骨组织更致密,促进生长期的骨生长。
在本研究中,为了研究动物HC摄入水平对于生长期骨生长的影响,动物HC的补充分为中等剂量组和高剂量组,此剂量的标准源于参考Reeves PG等人的研究,在Reeves PG等人的研究中[25]推荐,生长期大鼠食物中适宜的蛋白质含量应为17.9%,同时参考Wu J[20]等人和Nomura Y[21]等人研究中关于大鼠服用HC的剂量,将HC6组和HC6+Ex组大鼠食物(HC蛋白含量为6%,蛋白总含量为20%)作为中等剂量的HC补充,将HC12组和HC12+Ex组大鼠食物(HC蛋白含量为12%,蛋白总含量为20%)作为高剂量的HC补充。值得注意的是,在本研究中,高剂量HC补充组并没有比中等剂量HC补充组获得更高的BMD或骨组织形态计量学指标。这说明对于生长期的骨生长而言,中等剂量的HC补充即能起到较好的效果,而高剂量的补充并不能更好地促进骨组织的生长。已有一些关于蛋白质摄入水平对骨量影响的研究,如蛋白质缺乏可引起胰岛素样生长因子1的分泌减少,从而能够阻止正常的骨量合成[27]。Takeda等人的研究表明,在生长期蛋白质摄入不足可减少骨量的获得并且使骨强度下降[28]。然而,过高的蛋白摄入可导致尿钙分泌的增加,同样也可因此导致骨吸收作用的增加[29],在生长期摄入过高的蛋白质也可以抑制跑台训练引起的骨量的获得和骨强度的增加[28]。然而,Takeda等人的研究是以酪蛋白作为蛋白质补充物质,而对于高水平摄入HC同时结合跑台训练对于生长期骨量获得的影响仍属未知,所以本研究的目的在于研究是否高水平的HC补充比中等水平的HC补充能够更加有效提高生长期大鼠的骨量。
3.3 补充HC与跑台运动联合作用与生长期骨生长
已有多数关于营养补充和运动联合作用对BMD和骨结构影响的研究,如李爽等[30]研究了运动与中药联合作用对骨质疏松大鼠BMD的影响,结果显示运动与中药联合作用较单纯运动或中药治疗有较好的治疗效果,同时减少副作用。再如章晓霜等[31]研究了不同强度运动和雌激素联合作用对去卵巢大鼠骨骼生物力学性能的影响,结果显示单纯运动对力直接作用部位的力学性能—股骨颈最大载荷的影响大于单纯补充雌激素,运动和雌激素无明显协同作用;对于非力直接作用部位的力学性能—第2 腰椎最大凹入载荷及第3 腰椎最大压缩载荷,运动和雌激素联合有一定的协同作用。然而上述研究均是对去卵巢模拟妇女绝经后骨质疏松模型大鼠进行的研究,而关于营养补充和运动联合作用对生长期大鼠BMD和骨结构影响的研究还未见报道,而且也未见有关HC补充与运动联合作用对骨生长或骨代谢影响的报道。本研究的结果显示:不论股骨BMD和形态学指标还是胫骨组织形态计量学指标,补充HC与跑台运动联合作用均比单纯补充HC和单纯跑台运动能够更大幅度地促进生长期的骨生长。这提示我们,补充HC和跑台运动在促进生长期骨生长方面具有协同效应,二者分别从营养摄入和改变骨组织的应力环境方面促进成骨细胞的成骨活性,从而提高新骨组织的生成。
4 结论
4.1 补充HC与跑台运动均能有效提高生长期BMD,使骨组织形态计量学指标增加,促进生长期的骨生长。
4.2 对于促进生长期骨生长而言,补充HC与跑台运动具有协同作用,其效果优于单纯补充HC或单纯跑台运动。
4.3 中等剂量的HC补充即能较好地促进生长期的骨生长,而高剂量的补充并不能起到更好效果。
参考文献:
[1] Shuler FD, Lycans D, Gill T,et al.Physical education in West Virginia schools: are we doing enough to generate peak bone mass and promote skeletal health[J]. W V Med J, 2013, 109(4): 66-70.
[2] Barrack MT, Van Loan MD, Rauh MJ,et al.Body mass, training, menses, and bone in adolescent runners: a 3-yr follow-up[J]. Med Sci Sports Exerc, 2011, 43(6):959-966.
[3] Weaver CM. Parallels between nutrition and physical activity: research questions in development of peak bone mass[J]. Res Q Exerc Sport, 2015, 86(2):103-106.
[4] Hooven EH, Heppe DH, Kiefte-de Jong JC,et al.Infant dietary patterns and bone mass in childhood: the Generation R Study[J]. Osteoporos Int., 2015, 26(5):1595-1604.
[5] Carlsohn A, Cassel M, Linne K,et al.How much is too much A case report of nutritional supplement use of a high-performance athlete[J]. Br J Nutr, 2011, 25(1):1–5.
[6] Frost HM. Wolff's Law and bone's structural adaptations to mechanical usage: an overview for clinicians[J]. Angle Orthod, 1994, 64(3):175-88.
[7] 李世昌, 马涛, 尹小俭, 等. 不同运动方式对生长期大鼠骨密度和组织形态计量学指标的影响[J]. 体育科学, 2008, 28(1): 54-58.
[8] 郑庆云, 李世昌, 马 涛, 等. 纵跳对生长期大鼠骨密度和血液生化指标的影响[J]. 体育科学, 2008,28(8): 45-49.
[9] 马涛, 李世昌, 梁晓霞, 等. 上、下坡跑台运动对去卵巢小鼠骨密度及骨组织形态计量学指标的影响[J]. 体育科学, 2011, 31(1): 48-55.
[10] Nilsson M, Ohlsson C, Odén A,et al.Increased physical activity is associated with enhanced development of peak bone mass in men: a five-year longitudinal study[J]. J Bone Miner Res,2012,27(5):1206-1214.
[11] Wheeler DL, Graves JE, Miller GL,et al.Effects of running in the torisional strength, morphometry, and bone mass of the rat skeleton[J]. Med Sci Sports Exerc, 1995, 27(4): 520–529.
[12] Langsetmo L, Hitchcock CL, Kingwell EJ,et al.Physical activity, body mass index and bone mineral density-associations in a prospective population-based cohort of women and men: the Canadian Multicentre Osteoporosis Study (CaMos)[J]. Bone, 2012, 50(1):401-408.
[13] 乔玉成. 体育生物科学研究方法与技术[M]. 北京:中国科学文化出版社,2002:122-125.
[14] Chan MY, Nguyen ND, Center JR,et al.Absolute fracture-risk prediction by a combination of calcaneal quantitative ultrasound and bone mineral density[J]. Calcif Tissue Int, 2012, 90(2):128-136.
[15] Macdonald HM, Nishiyama KK, Hanley DA,et al.Changes in trabecular and cortical bone microarchitecture at peripheral sites associated with 18 months of teriparatide therapy in postmenopausal women with osteoporosis[J]. Osteoporos Int, 2011, 22(1): 357-362.
[16] Reid IR, Miller PD, Brown JP,et al.Effects of denosumab on bone histomorphometry: the FREEDOM and STAND studies[J]. J Bone Miner Res, 2010, 25(10): 2256-2265.
[17] Figueres Juher T, Basés Pérez E. An overview of the beneficial effects of hydrolysed collagen intake on joint and bone health and on skin ageing[J]. Nutr Hosp, 2015, 32(1):62-66.
[18] Liu J, Wang Y, Song S,et al.Combined Oral Administration of Bovine Collagen Peptides with Calcium Citrate Inhibits Bone Loss in Ovariectomized Rats[J]. PLoS One, 2015,10(8):e0135019.
[19] Wen XX, Wang FQ, Xu C,et al.Time Related Changes of Mineral and Collagen and Their Roles in Cortical Bone Mechanics of Ovariectomized Rabbits[J].PLoS One,2015,10(6):e0127973.
[20] Wu J, Fujioka M, Sugimoto K,et al.Assessment of effectiveness of oral administration of collagen peptide on bone metabolism in growing and mature rats[J]. J Bone Miner Metab, 2004, 22(6):547–553.
[21] Nomura Y, Oohashi K, Watanabe M,et al.Increase in bone mineral density through oral administration of shark gelatin to ovariectomized rats[J]. Nutrition, 2005, 21(11):1120–1126.
[22] Adam M, Spacek P, Hulejová H,et al.Postmenopausal osteoporosis. Treatment with calcitonin and a diet rich in collagen proteins[J]. Cas Lek Cesk, 1996, 135(3):74–78.
[23] Guillerminet F, Fabien-Soulé V, Even PC,et al.Hydrolyzed collagen improves bone status and prevents bone loss in ovariectomized C3H/HeN mice[J]. Osteoporos Int, 2012, 23(7):1909–1919.
[24] Mizoguchi T, Tamura K, Yoshida T,et al.Mineral and collagen derived from fish-skin supplementation improves bone metabolism in overiectomized rats part II[J]. J Jpn Dent Mater, 2006, 25(2):192.
[25] Guillerminet F, Beaupied H, Fabien-Soulé V,et al.Hydrolyzed collagen improves bone metabolism and biomechanical parameters in ovariectomized mice: an in vitro and in vivo study[J]. Bone, 2010, 46(3):827–834.
[26] Reeves PG, Nielsen FH, Fahey GC. AIN-93 purified diets for laboratory rodents: final report of the American Institute of Nutrition ad hoc writing committee on the reformulation of the AIN-76A rodent diet[J]. J Nutr, 1993, 123(11):1939–1951.
[27] Yahya ZA, Bates PC, Millward DJ. Responses to protein deficiency of plasma and tissue insulin-like growth factor-I levels and proteoglycan synthesis rates in rat skeletal muscle and bone[J]. J Endocrinol, 1990, 127(3):497–503.
[28] Takeda S, Kobayashi Y, Park JH,et al.Effect of different levels of dietary protein and physical exercise on bone mineral density and bone strength in growing male rats[J]. J Nutr Sci Vitaminol, 2012, 58(4):240–246.
[29] Jenkins DJ, Kendall CW, Vidgen E,et al.Effect of high vegetable protein diets on urinary calcium loss in middle-aged men and women[J]. Eur J Clin Nutr, 2003, 57(2):376–382.
[30] 李爽,刘庆思,陈扬,等.运动与中药联合作用对骨质疏松大鼠骨密度的影响[J].中国运动医学杂志,2005,24(2):170-172.
[31] 章晓霜,许豪文,赵卫东. 不同强度运动和雌激素联合作用对去卵巢大鼠骨骼生物力学性能的影响[J]. 中国运动医学杂志,2006,25(2):187-190.

