六安市小肠结肠炎耶尔森菌检测及其分子生物学研究
高大维,丁业荣,张 凤,杨 卫,常宏伟,李朝阳,徐鹏鹏,段 然,梁俊容,王建军
六安市小肠结肠炎耶尔森菌检测及其分子生物学研究
高大维1,2,丁业荣2,张凤2,杨卫2,常宏伟2,李朝阳2,徐鹏鹏2,段然3,梁俊容3,王建军1,4
1.安徽医科大学公共卫生学院,合肥230032;2.安徽省六安市疾病预防控制中心,六安237000;3.中国疾病预防控制中心传染病预防控制所,北京102206;4.安徽省疾病预防控制中心,合肥230000
摘要:目的调查本地腹泻病人和家畜家禽、昆虫苍蝇中小肠结肠炎耶尔森菌的感染及携带情况;通过对小肠结肠炎耶尔森菌的病原学和分子生物学研究来探讨动物带菌与人群之间的相互关系;为制定相应的防治对策提供科学依据。方法按照中国CDC编制《小肠结肠炎耶尔森菌实验室的病原学分离鉴定手册》第二、三版规定的程序进行病原学和分子生物学试验、研究。结果近年来自1 521份腹泻病人、家畜家禽等标本中分离出小肠结肠炎耶尔森菌109株,其阳性检出率分别为4.11%和11.04%;所有菌株均经生物梅里埃API 20E生化试验鉴定确认;不同标本中均检出致病性小肠结肠炎耶尔森菌,其毒力基因分布为ail+、ystA+、yadA+、virF+、rfbC+、ystB-,而非致病性菌株上述毒力因子均为阴性;致病性小肠结肠炎耶尔森菌PFGE分子分型检测证实腹泻病人,家畜家禽标本中的菌株带型类聚图高度一致。结论本地腹泻病人、家畜家禽和苍蝇标本均检出致病性和非致病性小肠结肠炎耶尔森菌;不同标本中分离的致病性小肠结肠炎耶尔森菌菌株毒力基因分布相同,均携带毒力质粒,PFGE分子分型检测基因组带型类聚图高度一致,从而可以认为猪是本地人群小肠结肠炎耶尔森菌病的重要传染源之一,牛、犬等在本病传播中的地位尚不能确定,有待进一步的调查与探讨。
关键词:小肠结肠炎耶尔森菌;腹泻病人;家畜家禽;分子生物学
Supported by the National Science and Technology Major Projects Subject (No. 2013ZX10004-203-002)
位于安徽省西部大别山麓的六安市,被称为安徽的西大门,与湖北黄冈河南信阳接壤。过去临床上一直没有关于致病性小肠结肠炎耶尔森菌在不同宿主之间分析的资料报告[1-2]。为了查清本地小肠结肠炎耶尔森菌的感染现状,搞清楚该病的传染来源以及小肠结肠炎耶尔森菌的分子生物学特性,近年来我们对腹泻病人、家畜家禽和苍蝇等标本进行了一系列的调查和研究,现报告如下。
1材料与方法
1.1标本来源腹泻病人来自2011—2014年以来六安市人民医院、六安市中医院以及附近乡镇医院肠道门诊,由临床医生、护士按照1∶10的比例采集新鲜粪便标本于10 mL改良PBS增菌液中冷藏送检;动物宿主标本采自养猪场、屠宰场,按上述比例,用无菌棉签采取粪便的中间部位,避免交叉污染,冷藏送检;苍蝇标本:人工捕捉苍蝇15只为1份标本,置改良PBS增菌液中冷藏送检。
1.2采集时间一般每年的5~10月份。
1.3试剂与仪器分型血清购自日本生研株式会社,API20E生化鉴定条购自法国生物梅里埃公司,分离培养基及各种生化试剂购自北京陆桥技术有限责任公司,药敏试纸由杭州天和微生物试剂有限公司生产,基因组DNA 提取试剂盒和PCR 反应体系试剂购天根生化科技有限公司,限制性内切酶NotⅠ、XbaⅠ购自Promega公司,SeaKem Gold琼脂糖购自Cambraex Bio Seience Rockland公司,蛋白酶K购自Merck公司。脉冲场凝胶电泳仪为Bio-Rad CHEF-DRⅢ系统和Bio-Rad CHEF-Mapper系统,凝胶成像仪为Bio-Rad GelDoc 2000系统,均购自美国伯乐公司。
1.4血清及生化鉴定细菌培养根据临床检验操作规程,按常规方法进行,纯培养后再进行生化及血清学鉴定
1.5基因检测引物按参考文献合成[3]ail、ystA、ystB、yadA、rfbC、virF6种毒力基因,由上海生工生物工程有限公司合成 。 PCR 扩增体系:采用20 μL反应体系,每个体系加入纯水8 μL,PremixTaqVersion2.0(Loading dye mix)10 μL,上下引物各0.5 μL,DNA模板1.0 μL。
1.6实验方法按照中国CDC编写《小肠结肠炎耶尔森菌实验室分离鉴定手册》(2版、3版)程序(以下简称“程序”)[4]。用SPSS 16.0软件对数据进行统计学处理。用Bionumerics软件对PFGE结果进行聚类分析。
2结果
2.1腹泻病人标本的小肠结肠炎耶尔森菌检测2011—2014年先后收到各家医院肠道门诊送检的腹泻病人粪便标本851份,分离出小肠结肠炎耶尔森菌35株,阳性检出率为4.11%;2012年最高为6.47%,2014年次之,为5.31%,2011年最低,仅为1.98%(表1)。
表1腹泻病人标本小肠结肠炎耶尔森菌检测情况
Tab.1Detection rate of Yersinia enterocolitica in diarrhea patient samples

年份Year标本数No.ofsamples阳性数No.ofpositive阳性率(%)Positiverate(%)201120241.982012201136.47201320352.462014245135.31合计Total851354.11
2.2家畜家禽和苍蝇携带小肠结肠炎耶尔森菌近年来,我们对本地饲养的家禽、畜粪便标本开展了小肠结肠炎耶尔森菌携带情况调查,先后收到送检的猪、牛粪等标本467份,检出小肠结肠炎耶尔森菌62株,其中猪粪标本阳性率最高达21.53%,牛和犬粪标本带菌率偏低(表2);值得关注的是自2011—2014年从203份苍蝇标本中常常能检出小肠结肠炎耶尔森菌,阳性检出率依次为12.5%、0%、8.51%和5.88%。
表2家畜家禽标本检测小肠结肠炎耶尔森菌
Tab.2Detection of Yersinia enterocolitica in livestock and poultry samples

样本Specimens检测份数No.ofdetection阳性数No.ofpositive阳性率(%)Positiverate(%)猪粪Pigfeces2094521.53牛粪Cattlefeces11597.83鸡粪Chickenfeces11176.31犬粪Dogfeces3213.13合计Total4676213.28
2.3小肠结肠炎耶尔森菌生血清学分布和化学特性对44株致病性小肠结肠炎耶尔森菌和非致病性小肠结肠炎耶尔森菌的血清型在不同宿主的分布进行了研究,显示致病性菌株同时在腹泻病人和家畜家禽标本中检出,其血清型均为O∶3型;除此以外,非致病性菌株中还能检出O8型、O1andO2型菌株(表3)。我们还应用生物梅里埃API.20E生化试验系统对109株小肠结肠炎耶尔森菌进行了生化学鉴定,结果呈7种生化反应模式,其中最常见的生化反应编码式为:1015523、1155723、1155523三种,分别占鉴定菌株的30.28%、28.44%和23.85%,其它均不多见(表4)。不同来源的标本分离菌株的生化鉴定结果并不一致,腹泻病人菌株生化编码多为1155723和1155523两种模式,而猪粪标本菌株的编码却多数为1015523,其它少见。分析其原因发现与菌株的致病性和血清型别有关,O3型致病性菌株的生化编码一般为1015523,而非致病性O8型和其它型菌株却是1155723和1155523多见。

表3 44株小肠结肠炎耶尔森菌致病性及血清型在不同宿主的分布

表4 109株小肠结肠炎耶尔森菌生化反应模式
2.4药物敏感性试验选择自不同标本中分离的59株小肠结肠炎耶尔森菌,检测其对各种常用抗生素的敏感性,结果看出该菌对左氧氟沙星、哌拉西林、亚胺培南、诺氟沙星、环丙沙星等药物高度敏感,而对临床上常用的氧氟沙星、头孢唑啉、头孢呋肟等药物开始出现抗药性菌株,对复方新诺明、阿莫西林、氨苄西林等抗生素几乎不敏感(表5)。
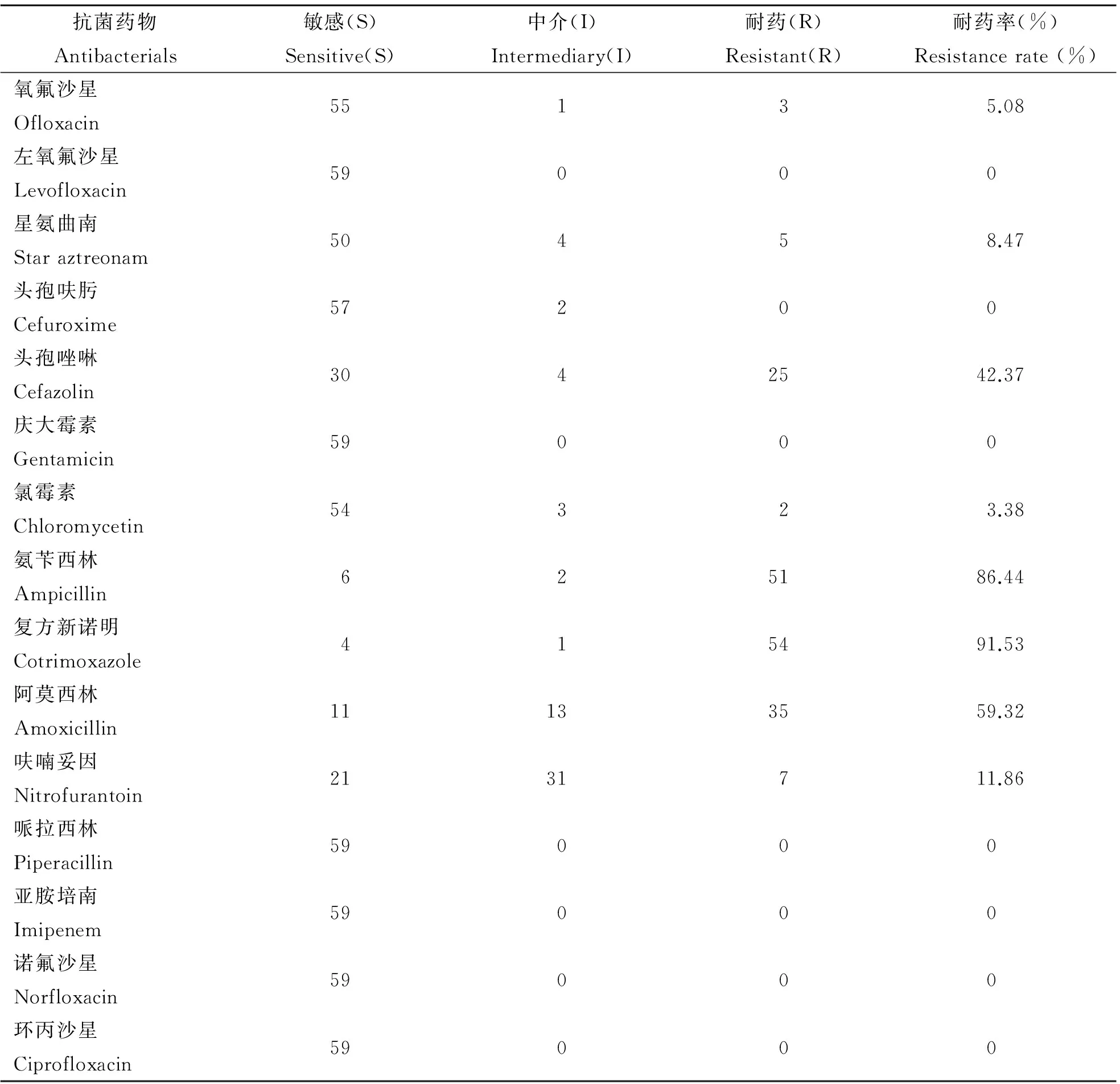
表5 59株小肠结肠炎耶尔森菌抗生素敏感性
2.5小肠结肠炎耶尔森菌的分子生物学研究
2.5.1PCR检测foxA基因foxA是小肠结肠炎耶尔森菌的铁草胺菌素受体蛋白的基因,文献报道[5]可用于小肠结肠炎耶尔森菌种的鉴定。2015年2月我们用聚合酶链反应(PCR)的方法检测109株小肠结肠炎耶尔森菌的foxA基因,结果发现全部阳性。另外在实际工作中还发现4株弗氏/中间型结肠炎耶尔森菌的foxA基因亦为阳性;尚未发现生化鉴定为小肠结肠炎耶尔森菌而foxA基因阴性的菌株。
在实验研究中,我们应用聚合酶链反应(PCR)技术和常规分离培养方法同时进行小肠结肠炎耶尔森菌检测的对照性研究(表6),110份不同标本增菌培养后,二种方法同步进行,结果PCR法阳性34份,常规分离方法阳性35份。阳性检出率分别为30.91%和31.82%,有统计学意义(χ2= 0.021,P>0.05);仔细分析二法的实验结果,发现二法阳性、阴性符合率达95.45%(105/110),而常规分离阳性,PCR阴性,以及PCR法阳性,常规分离法阴性标本仅占4.55%(5/110)。
2.5.2毒力基因检测本次对24株不同型别小肠结肠炎耶尔森菌进行了毒力基因检测,以确定其致病性。结果发现O3型菌株的毒力基因分布均为ail+、ystA+、yadA+、virF+、rfbC+、ystB-,符合典型的致病性小肠结肠炎耶尔森菌毒力基因分布特征,尚未发现毒力质粒在人工传代中丢失。非致病性菌株中除1株不携带上述毒力基因外,其余仅ystB阳性(表7)。
表6PCR 法和分离培养法检测小肠结肠炎耶尔森菌结果
Tab.6PCR and isolation method results of Yersinia enterocolitica

PCR法PCRmethod分离培养法Isolationmethod阳性Positive阴性Negative合计Total阳性Positive32234阴性Negative37376合计Total3575110
2.5.3脉冲场凝胶电泳(PFGE)分子分型我们在中国CDC应急实验室的帮助下应用PFGE方法对本地16株O3型致病性小肠结肠炎耶尔森菌菌株进行基因组带型分型,结果显示,腹泻病人分离菌株(sy22,sy25,sy26,sy30)与本地猪粪、鸡粪等标本中分离菌株的带型类聚图高度一致(图1)。腹泻病人的菌株为2014年分离,而家畜家禽菌株为2012年和2013年保存的菌株。
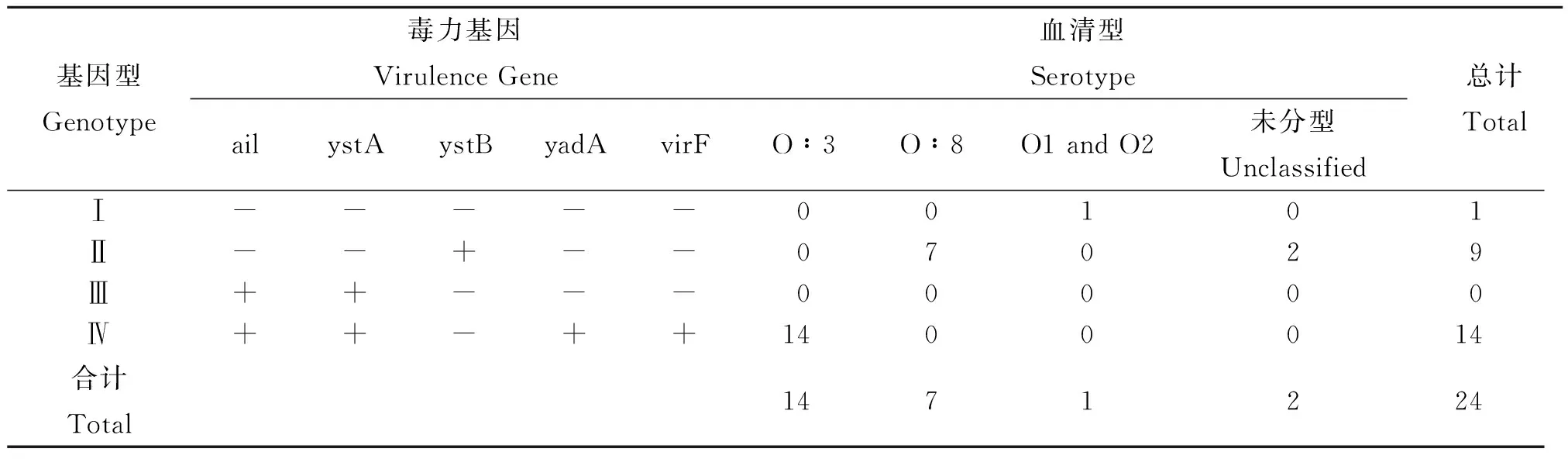
表7 24株小肠结肠炎耶尔森菌毒力各基因在不同血清型分布情况

图1 O3血清型小肠结肠炎耶尔森菌PFGE带型类聚图
Fig.1PFGE band pattern clustering diagram in O3 serotype Yersinia enterocolitica
3讨论
近年来,国内相关的医学文献中,一直没有安徽省致病性小肠结肠炎耶尔森菌在不同宿主分布的文献资料报道[1-2]。我们的调查结果证实851份腹泻病人标本中,检出了35株小肠结肠炎耶尔森菌,其中致病性小肠结肠炎耶尔森菌4株;670份家畜家禽和苍蝇标本中分离到小肠结肠炎耶尔森菌74株,其中猪粪、鸡粪、犬粪标本均检出致病性小肠结肠炎耶尔森菌。结果首次改写了安徽省无致病性小肠结肠炎耶尔森菌存在的历史,该菌在我国江淮地区被发现也填补了国内小肠结肠炎耶尔森菌不同地区分布的空白。
从不同标本中分离的小肠结肠炎耶尔森菌来看,血清型分布相对广泛。腹泻病人标本中分离的O3型菌株以及O8型,O1 and O2型菌株,在家畜家禽标本,苍蝇标本中都能检出;特别值得一提的是209份猪粪标本中分离的45株小肠结肠炎耶尔森菌,其中致病性菌株占分离菌株的88.8%(40/45),均为O∶3血清型,与腹泻病人的PFGE带型一致,为我国的优势带型,说明猪是本地小肠结肠炎耶尔森菌病重要的传染源之一,当人群与带菌动物及污染食物、水源密切接触后,极有可能被感染而发病[6-8],对其应引起高度关注;其它动物携带致病性小肠结肠炎耶尔森菌的传染性也不容忽视。生物梅里埃API.20E生化鉴定系统鉴定的阳性的菌株有7种生化反应模式,其中最常见生化编码为1015523、1155723、1155523三种,其他均为少见。分析发现,O∶3型小肠结肠炎耶尔森菌的生化编码多是1015523,而O∶8型和未定型菌株的生化编码多为1155723和1155523,说明不同血清型菌株的生化分解能力存在一定差异。药物敏感性实验可以看出,不同标本中分离的小肠结肠炎耶尔森菌对左氧氟沙星、哌拉西林、诺氟沙星、环丙沙星等均高度敏感,而对临床上频繁使用的氧氟沙星、头孢唑啉等都产生一定的抗药性;值得注意的是腹泻病人和家畜家禽菌株对各种抗生素的敏感性有一定的差异,体内、体外的药物反应也不完全相同,考虑这些因素,要求我们临床医生应根据病人的临床症状和体征采取相应的防控措施,制定有效的治疗方案,妥善合理使用抗生素,防止耐药菌株的产生,这样不仅可以减轻病人的经济负担,而且可以缩短病程,减少并发症的发生,是病人早日康复的重要环节。
应用聚合酶链反应(PCR)技术和常规分离方法检测小肠结肠炎耶尔森菌对照研究,110份标本同时应用二种方法进行,结果可以看出,其阳性率非常近似,差异无统计学意义(χ2=0.021,P>0.05);二种方法阳/阴性符合率为95.45%(105/110),不吻合率仅占4.55%(5/100),这说明PCR法不失为检测小肠结肠炎耶尔森菌的一种值得推广应用的好方法,尤其是对大量标本的调查与研究,它可以在初筛和确定阳性标本方面具有重要意义,不仅可以节省大量的人力、物力和时间,而且可以为分离培养法锁定疑似阳性标本的范围,比较容易的把标本中的小肠结肠炎耶尔森菌分离出来,这样就可以进一步对其进行生化学、血清学、分子生物学等各方面的鉴定与研究。二法可以互补其得与失,从而保证该项目工作的顺利完成。本次实验研究结果与有关报告并不一致,有文献[9]认为PCR法的阳性率明显高于分离培养法,这可能与实验标本增菌培养后,分离培养前未进行碱处理有关,我们在实际工作中发现增菌标本碱处理可以提高该菌的阳性检出率达8.86倍之多[ 10],这是实验标本分离培养获得成功的关键因素。毒力基因检测显示,不同标本分离的O3型小肠结肠炎耶尔森菌的毒力基因分布为ail+、ystA+、yadA+、virF+、rfbC+、ystB-,为典型的致病性菌株特征,而O8型和未定型菌株均不携带上述致病因子(ail+、ystA+、yadA+、virF+、rfbC+),该菌在腹泻病感染过程中所起的作用,尤待于进一步的研究与探讨。PFGE分子分型方法,是近年来中国CDC刚刚建立的起来的一种分子分型模式[ 11],16株O3型小肠结肠炎耶尔森菌的PFGE检测的PFGE带型类聚图显示腹泻病人分离的致病性O3型菌株与当地家畜家禽猪等标本分离的O3型菌株带型高度一致,从而为人类感染该病的来源与家畜家禽有十分密切的关系提供了很好的佐证。O3型致病性菌株多分布在北方寒冷地区,少数温暖的沿海地区也有存在[4],而我国江淮地区也能在腹泻病人和家畜家禽标本中检出致病性小肠结肠炎耶尔森菌,尚属首次报告。
(本研究得到中国疾病预防控制中心应急实验室景怀琦研究员的大力支持, 在此表示衷心感谢!)
参考文献:
[1]Jing HQ, Li JY, Xiao YC, et al. PCR detection and investigation of distribution of virulence factors forYersiniaenterocoliticaserotype O∶3 and O∶9[J]. Chin J Vector Bio Ctrl, 2004, 15: 317-319. (in Chinese)
景怀琦, 李继耀, 肖玉春, 等. O∶3 和O∶9 小肠结肠炎耶尔森菌主要毒力基因分布调查 [J].中国媒介生物学及控制杂志. 2004, 15: 317-319.
[2]Wang X, Cui Z, Jin D, et al. Distribution of pathogenicYersiniaenterocoliticain China[J]. Eur J Clin Microbiol Infect Dis, 2009, 28(10): 1237-1244. DOI: 10.1007/s10096-009-0773-x
[3]Wang H, Jing HQ, Zhu FC, et al.Yersiniaenterocoliticadisease[M]. Beijing: People’s Medical Publishing House, 2004. (in Chinese)
汪华, 景怀琦, 朱凤才, 等. 小肠结肠炎耶尔森菌病[M ].北京: 人民卫生出版社, 2004.
[4]Jing HQ, Wang X.YersiniaenterocoliticaYersinia pseudotuberculosis isolation and identification of the laboratory manual[M]. 3rd ed. Beijing: China Center for Disease Control and Prevention, Prevention and Control of Infectious Diseases, 2010: 11. (in Chinese)
景怀琦,王鑫.小肠结肠炎耶尔森菌假结核耶尔森菌实验室分离与鉴定手册[M].3版.北京:中国疾病预防控制中心传染病预防控制所,2010:11.
[5]Ying H, Xin W, Cui Z, et al. Possible use of ail and foxA polymorphisms for detecting pathogenicYersiniaenterocolitica[J]. BMC Microbiol, 2010, 10: 211. DOI: 10.1186/1471-2180-10-211
[6]Liang J, Wang X, Xiao Y, et al. Prevalence ofYersiniaenterocoliticain pigs slaughtered in Chinese abattoirs[J]. Appl Environ Microbiol, 2012, 78(8): 2949-2956. DOI: 10.1128/AEM.07893-11
[7] Bottone EJ.Yersiniaenterocolitica: the charisma continues[J]. Clin Microbiol Rev, 1997, 10: 257-276.
[8]Bottone EJ.Yersiniaenterocolitica: overview and epidemiologic correlate[J]. Microbes Infect, 1999, 1: 323-333.
[9]Xiao YC, Li KW, Liang JR, et al. Comparison ofYersiniaenterocoliticadetection by PCR and conventional culturing[J]. Dis Surveill, 2013, 28: 456-458. (in Chinese)
肖玉春,李维可,梁俊容,等.聚合酶链反应方法和分离培养法筛检小肠结肠炎耶尔森该菌的方法的比较研究[J].疾病监测杂志, 2013,28:456-458.
[10]Zhang F, Ding YR, Gao DW, et al. Preliminary investigation on the pathogenicity ofYersiniaenterocoliticain patient specimens[J]. Chin J Health Lab Technol, 2015, 25(16): 2693-2696. (in Chinese)
张凤,丁业荣,高大维,等. 腹泻病人标本分离小肠结肠炎耶尔森菌及其病原学研究[J].中国卫生检验杂志, 2015,25(16): 2693-2696.
[11]Jin D, Cui ZG, Xiao YC, et al. Molecular typing of the pathogenicYersiniaenterocoliticastrains with pulsed field gel electrophoresis isolated in China[J]. Chin J Epidemiol, 2006, 27: 677-680. (in Chinese)
金东, 崔志刚, 肖玉春, 等. 中国六省致病性小肠结肠炎耶尔森菌的脉冲场凝胶电泳分析[J].中华流行病学杂志, 2006,27:677-680.
DOI:10.3969/j.issn.1002-2694.2016.03.009
通讯作者:王建军,Email:wjj@ahcdc.com.cn
中图分类号:R378.2
文献标识码:A
文章编号:1002-2694(2016)03-0256-06
Corresponding author:Wang Jian-jun, Email: wjj@ahcdc.com.cn
收稿日期:2015-08-04;修回日期:2016-01-15
Yersinia enterocolitis detection and molecular biology in Lu’an City, China
GAO Da-wei1,2,DING Ye-rong2,ZHANG Feng2,YANG Wei2,CHANG Hong-wei2,LI Chao-yang2,XU Peng-peng2,DUAN Ran3,LIANG Jun-rong3,WANG Jan-jun4
(1.AnhuiMedicalUniversity,SchoolofPublicHealth,Hefei200032,China;2.Liu’anCenterforDiseaseControlandPrevention,Lü’an237000,China;3.ChineseCenterforDiseaseControlandPrevention,Beijing102206,China;4.AnhuiProvincialCenterforDiseaseControlandPrevention,Heifei230000,China)
Abstract:We investigated the infection of Yersinia enterocolitica in local diarrhea patients, livestock and poultry, and insect flies carry status by studying relationship between host and animals carrier with etiological and molecular biological methods, for providing scientific basis for the development of appropriate countermeasures. Results showed that 109 Yersinia enterocolitica strains were isolated from 1 521 diarrhea patients and livestock poultry; the positive rates were 4.11% and 11.04%, respectively. All strains were confirmed by bioMerieux API 20E biochemical tests. Different specimens of pathogenic Yersinia enterocolitica strains were detected, and the virulence genes include ail+, ystA+, yadA+, virF+, rfbC+, ystB-, and pathogenic strains did not carry these virulence factors; pathogenic Yersinia enterocolitica PFGE subtyping tests showed that diagram with a highly consistent pattern clustering between diarrhea patients and host animals specimens. Pathogenic and non-pathogenic Yersinia enterocolitica were detected from local diarrhea patients, livestock poultry and fly specimens. Pathogenic Yersinia enterocolitica had the same virulence genes were isolated from different samples. Genome type clustering map were with a highly consistent pattern clustering tested by PFGE molecular, which prompted that swine were one of the most important sources of infection leading to the local people with Yersinia enterocolitica. It’s also suggested that the effect of cattle and dogs cannot be determined in the spread of the disease, and needs further investigation and discussion.
Keywords:Yersinia enterocolitica; diarrhea patients; livestock and poultry; molecular biology
国家科技重大专项课题(2013ZX10004-203-002)

