精异丙甲草胺胁迫下烟草根际土壤微生物的动态响应及其降解
侯少锋++李荣玉++尹显慧+龙友华++吴小毛
摘要:为了探明除草剂在烟草根际的降解与其根际微生物数量之间的关系,揭示烟草根际环境中除草剂快速降解的机制,采用室内模拟法研究精异丙甲草胺胁迫下烟草根际土壤微生物的动态响应及其降解动态。结果表明:在整个试验周期内,无论是处理土壤,还是对照土壤,根际土壤微生物区系数量、土壤呼吸作用均高于非根际土壤,存在明显的根际效应;真菌是精异丙甲草胺胁迫下的优势菌群,能够在该除草剂污染的根际土壤中旺盛生长;精异丙甲草胺在烟株根际土壤中更容易降解,与非根际土壤相比,根际土壤中精异丙甲草胺的降解速率提高了1.23倍,半衰期缩短了18.77%。
关键词:精异丙甲草胺;烟草根际;微生物;降解;动态响应;非根际土壤
中图分类号: S154.3文献标志码: A文章编号:1002-1302(2016)06-0493-03
收稿日期:2016-02-01
基金项目:国家自然科学基金(编号:21267007);中国烟草总公司贵州省公司科技项目专项[编号:201311,编号:201414];贵州省烟草公司毕节市公司项目(编号:BJYC-201304)。
作者简介:侯少锋(1987—),男,河北唐山人,硕士研究生,主要从事农药环境毒理学及农产品安全评价研究。Tel:(0851)88297830;E-mail:460912660@qq.com。
通信作者:吴小毛,博士,副教授,主要从事农药环境毒理学及农产品安全评价研究。Tel:(0851)88297830;E-mail:wuxm827@126.com。植物根际是根与土壤环境相互耦合的生态与环境界面,是一个较为特殊的微生态环境,由于其中的微生物活动非常旺盛,能加快土壤中有机化合物的分解及其他矿质元素的活化,根际环境,特别是有机污染物胁迫下的根际环境与一般土体存在显著差别[1]。由于植物根系脱落物及根系分泌作用的存在,根际环境中pH值、Eh(氧化还原电位)、养分状况的变化,将直接影响微生物组成、酶活性等物理、化学及生物学特性[2]。根际—土壤界面决定了污染物降解的过程远较一般土体复杂,有关污染物在根—土界面的形态及毒性变化的研究一直是环境科学研究的热点,但目前相关的研究主要集中于重金属及有机污染物方面[3-7]。
精异丙甲草胺(S-metolachlor)别称(S)-异丙甲草胺,是一种酰胺类除草剂,其化学名为2-氯-N-(2-乙基-6-甲基苯基)-N-[(1S)-2-甲氧基-1-甲基乙基]乙酰胺。精异丙甲草胺是一种选择性芽前土壤处理药剂,其主要作用机理为抑制发芽的杂草种子蛋白质的合成,其次是抑制胆碱类物质渗入磷脂,干扰卵磷脂的形成。精异丙甲草胺的杀草谱非常广范,其主要防除对象为一年生的单子叶杂草、部分阔叶杂草和莎草,并被广泛应用于玉米、马铃薯、水稻、大豆、烟草、蔬菜等多种作物的田间除草[8-11]。目前有关精异丙甲草胺胁迫下土壤微生物生态效应及其降解动态的研究较少,笔者选用烟株根际土壤为基质,采用室内模拟培养的方法,研究精异丙甲草胺胁迫下烟草植株根际微生物的动态变化及根际微生物对其降解潜力。
1材料与方法
1.1材料
1.1.1土壤在花溪烟草种植试验地中,采集以烟草K326烟株为中心、15 cm半径范围的整个土块,将抖落大块土壤后的烟株根系连同与之紧密黏附的土壤置于保鲜袋中,带回实验室,仔细刷下并收集黏附于烟株根系的土壤,风干,过1 mm筛,保存备用。
1.1.2药品及试剂精异丙甲草胺标准品[≥ 97.7%,85%(S)isomer],购自美国迪马科技有限公司。甲醇为色谱纯,其他试剂为分析纯。
1.1.3主要仪器设备6 890N气相色谱(带μECD检测器)、HP-5石英毛细管柱(30 m×0.32 mm,0.25 μm,美国Agilent)、AL104分析天平(瑞士梅特勒)、YX-208B灭菌锅(上海三申医疗器械有限公司)、SW-CJ-1FD超净工作台(杭州钱江仪器设备有限公司)、SHZ-82恒温振荡器(常州澳华仪器有限公司)、RE-52A型旋转浓缩蒸发仪(上海亚荣生化仪器厂)、 CH20生物显微镜[奥林巴斯(中国)有限公司]、BIC-300人工气候培养箱(上海博讯实业有限公司)。
1.2试验方法
1.2.1土壤微生物区系的动态响应试验分别称取500 g根际、非根际土样置于1 000 mL烧杯中,加入含精异丙甲草胺的甲醇溶液,使除草剂浓度均为6 mg/kg,待甲醇挥发后搅拌均匀,用蒸馏水调节湿度至土壤最大持水量的60%。土样于25 ℃培养箱中恒温培养60 d,每个处理均设置3次重复,同时设空白对照(CK),试验期间定时称质量补足水分含量。于1、3、7、14、21、30、45、60 d定时取样测定,微生物计数采用固体平板梯度稀释涂布培养计数法,细菌用牛肉膏蛋白胨琼脂培养基培养,真菌用马丁氏培养基培养,放线菌用改良高氏1号培养基培养[12]。
1.2.2土壤呼吸作用测定采用直接吸收法测定[13]。称取50 g土样、1 g葡萄糖于100 mL烧杯中,加入少量水湿润土壤后于25 ℃恒温箱中避光培养7 d,然后添加含精异丙甲草胺的甲醇溶液并使其浓度分别为1、3、6、9、12 mg/kg。待甲醇挥发后搅拌均匀,用蒸馏水调节湿度至土壤最大持水量的60%,将装有土样的烧杯与盛有40 mL 0.2 mol/L NaOH的小烧杯一起置于密闭容器中,每个处理3次重复,同时设空白对照(CK),恒温培养60 d,定期取出NaOH溶液用0.4 moL/L HCl溶液滴定,同时换入新鲜的NaOH溶液,继续培养。根据HCl溶液的消耗量计算100 g干土的CO2释放量。在整个试验阶段适时补水,以保持土壤含水量恒定。
1.2.3在根际土壤中的降解试验分别称取20 g根际、非根际土样于100 mL锥形瓶中,加入含精异丙甲草胺的甲醇溶液,使其浓度均为6 mg/kg,待溶剂挥发后搅拌均匀,加入适量无菌蒸馏水,使含水量为田间最大持水量的60%,土样于25 ℃恒温培养箱内黑暗培养,每个处理均设3次重复,在整个试验阶段适时称质量补水,以保持土壤含水量恒定。于0、7、14、30、60 d后取样,采用液相色谱法测定精异丙甲草胺的残留量[14]。
2结果与分析
2.1细菌的动态响应
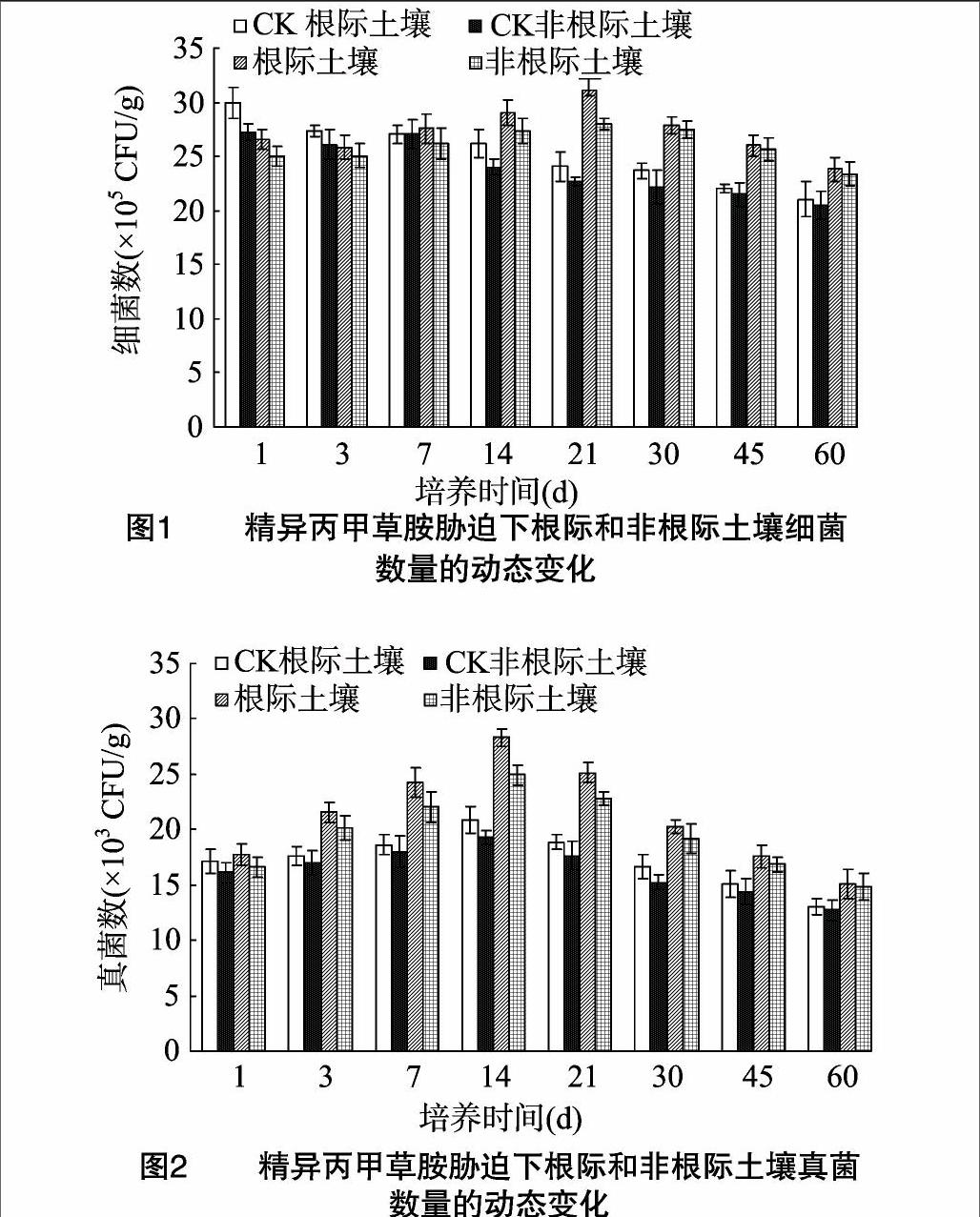
由图1可见,在整个试验期内,根际土细菌数量均高于非根际土;与非根际土相似,经精异丙甲草胺处理的根际土壤,细菌的生长开始被抑制,到一定时间后被促进。在试验前期(1~7 d),与对照土壤相比,施用精异丙甲草胺处理后,根际与非根际土壤细菌的生长基本受到抑制,在培养1 d时抑制作用达到最大值。随后,各处理的抑制作用逐渐减弱,其中精异丙甲草胺在培养7 d时对根际土壤细菌生长的抑制效应消失,开始促进细菌生长,且促进效应一直继续到试验结束,并且细菌数量均显著高于对照土壤(P<0.05)。经精异丙甲草胺处理的根际、非根际土壤的细菌数量在21 d到达最大值,其中处理根际土壤细菌数量比对照根际土壤增加了2815%,而处理非根际土壤细菌数量比对照土壤增加了780%,此时处理根际土壤细菌数量是处理非根际土壤的111倍,即处理土壤的根际效应R/S(1 g根际土壤中所含微生物数量与非根际土壤的相应值之比)为1.11,而对照土壤的根际效应R/S为1.06,差异均达到显著水平(P<0.05)。
2.2真菌的动态响应
从图2可以看出,精异丙甲草胺对根际与非根际土壤真菌的生长一直表现为促进作用,30~60 d内,真菌数量均明显高于对照土壤。精异丙甲草胺处理土壤的真菌数量在14 d时到达最大值,其中根际土壤真菌数量比对照土壤增加了39.14%,相应的非根际土壤真菌数量比对照土壤增加了2953%,此时处理土壤的根际效应R/S也达到峰值,为114,对照土壤的根际效应R/S为1.08,差异均达到显著水平(P<0.05)。在整个试验周期内,无论是处理土壤还是对照土壤,根际土中的真菌数量均要高于非根际土,但在试验后期(45~60 d),根际与非根际土壤的真菌数量之间不存在明显差异。
2.3放线菌的动态响应
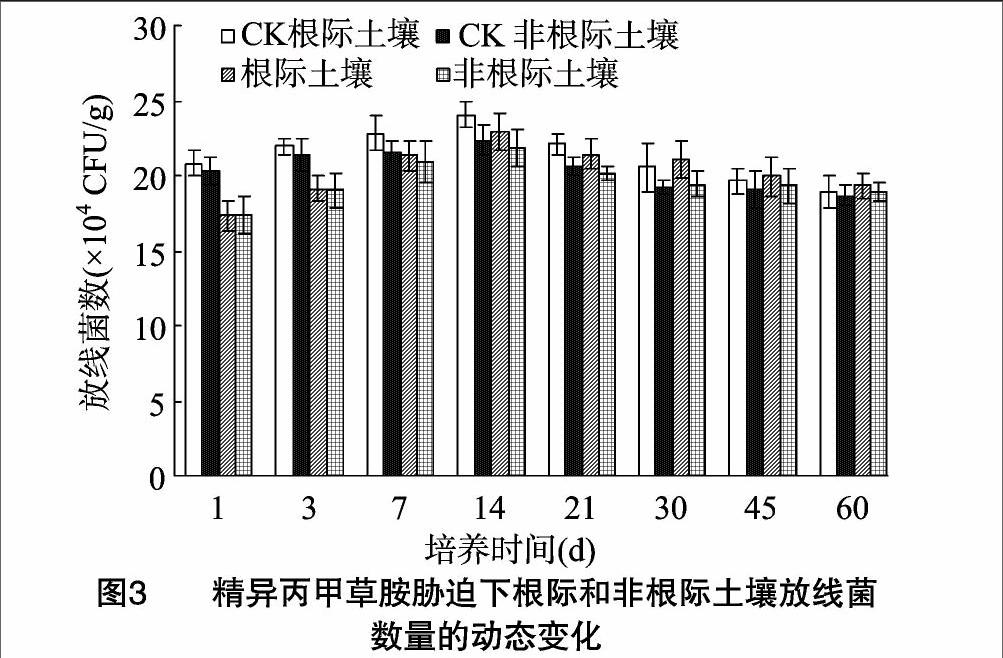
由图3可知,在培养期间,根际土壤放线菌数量均高于非根际土壤;精异丙甲草胺对放线菌生长的影响为抑制—恢复—刺激。处理1~14 d,与对照土壤相比,精异丙甲草胺处理下的放线菌生长受到抑制,1 d时抑制作用最大,根际土壤的最大抑制率为14.51%,非根际土壤的抑制率为1432%。精异丙甲草胺处理根际土壤的放线菌数量在14 d时达到峰值,此时,处理土壤的根际效应R/S也达到最大值,为1.07,差异也达显著水平(P<0.05)。14 d后抑制作用逐渐减弱,其中精异丙甲草胺处理的根际土壤放线菌数量在21 d时恢复到对照水平,30 d时开始促进放线菌生长,且促进作用一直继续到试验结束,但差异明显。在整个试验周期内,无论是处理土壤还是对照土壤,根际土中的放线菌数量均要高于非根际土。
2.4对根际土壤呼吸作用的影响
如图4所示,与非根际土相似,施用除草剂对根际土壤呼吸均有一定的刺激作用,在3 d时,土壤呼吸强度达到了最高值,精异丙甲草胺处理的根际土壤呼吸强度比对照土壤增加了18.82%,相应的非根际土壤呼吸强度比对照土壤增加了15.41%,处理根际比处理非根际土增加了15.32%,即处理土壤的根际效应R/S为1.15,对照土壤的根际效应R/S为112,差异均达到显著水平(P<0.05)。随后精异丙甲草胺对根际土壤呼吸的刺激作用逐渐减弱。45 d时,精异丙甲草胺处理根际土壤的呼吸在7~60 d内继续保持刺激状态,而非根际土壤的呼吸强度在45 d时基本与对照持平。在整个试验周期内,根际土壤呼吸强度均高于非根际土壤。
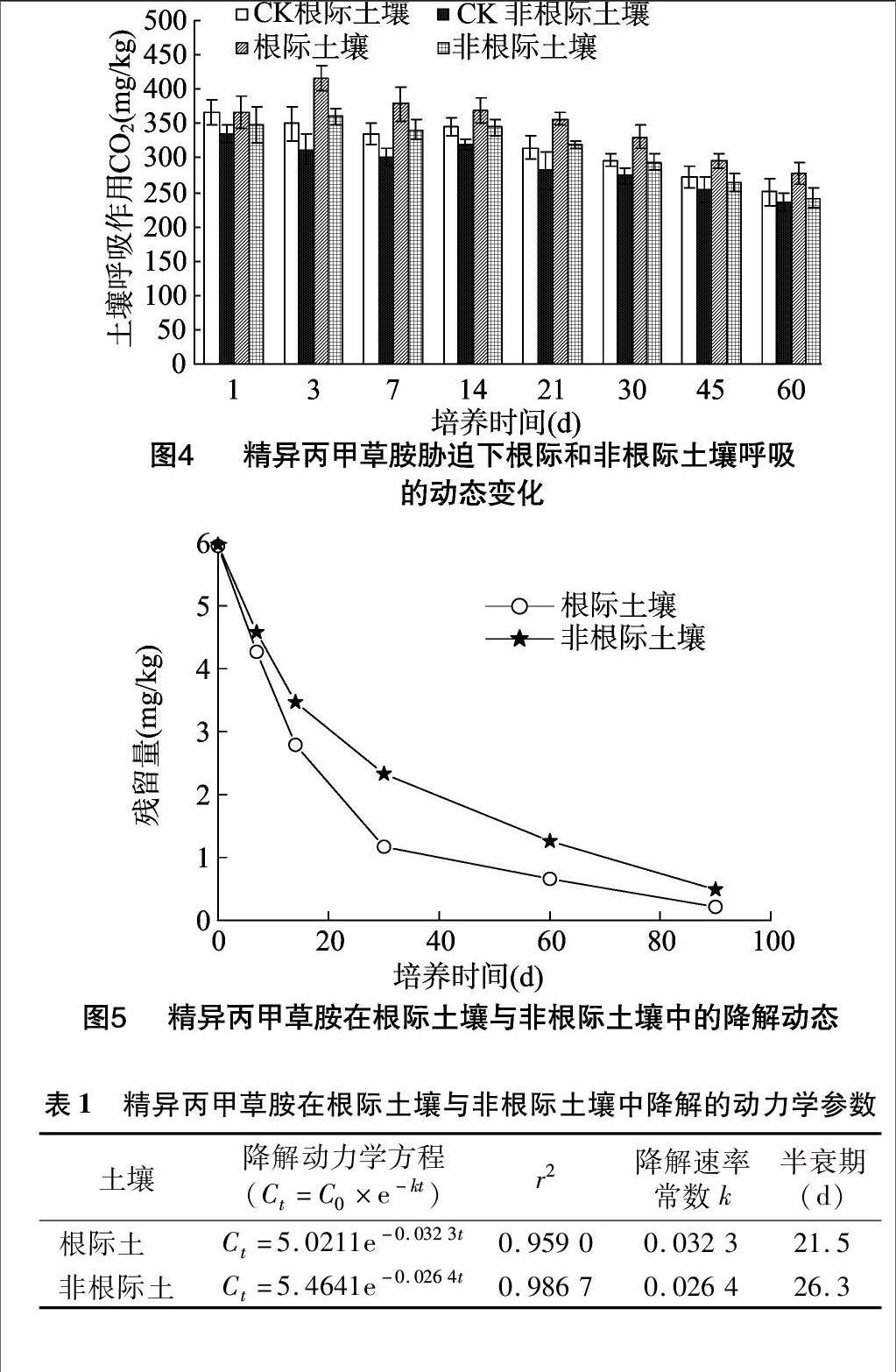
2.5在根际土壤中的降解动态
由图5可知,在培养60 d,根际土壤中精异丙甲草胺的降解率为86.67%,而在非根际土壤中的降解率仅为80.33%,差异均达到显著水平(P<0.05)。精异丙甲草胺除草剂在根际土壤中的降解也可用一级反应动力学方程模拟(表1),根际土壤中精异丙甲草胺的降解速率常数为0.032 3,相应的半衰期为21.5 d;非根际土壤中精异丙甲草胺的降解速率常数为0.026 4,相应的半衰期为26.3 d。与非根际土壤相比,根际土壤中精异丙甲草胺的降解速率常数提高了1.22倍,半衰期缩短了18.25%。综合精异丙甲草胺胁迫下根际土壤微生物种群数量变化,根际微生物具有加快除草剂降解的潜力,表明植物种植可能是实现土壤农药污染治理的一种有效途径。
3结论与讨论
微生物是根际微域中最活跃的生物相,其在有机物根际污染生态系统中的作用尤为重要。本研究表明,在整个试验周期内,无论是处理土壤还是对照土壤,根际土壤微生物区系数量、土壤呼吸作用均高于非根际土土壤,存在明显的根际效应。所研究的除草剂精异丙甲草胺在烟株根际土壤中更容易降解,与非根际土壤相比,根际土壤中精异丙甲草胺的半衰期缩短了18.77%,降解速率提高了1.23倍。同时,精异丙甲草胺对细菌、真菌和放线菌的影响不同:细菌是先抑制后促进,真菌是持续促进,放线菌是抑制—恢复—刺激。真菌是精异丙甲草胺胁迫下的优势菌群,均能够在除草剂污染的根际土壤中旺盛生长。这说明土壤真菌在精异丙甲草胺的驯化作用下大多都具备了耐受除草剂的能力或者部分敏感菌群趋于消亡而耐受菌群能够旺盛生长。本研究初步探讨了精异丙甲草胺对烟草根际土壤微生物的影响及其降解动态,有关精异丙甲草胺对土壤酶活性的毒性效应方面有待进一步研究。
参考文献:
[1]刘芷宇. 根际动态及其效应的研究[J]. 世界农业1987,8:39-41.
[2]Chaineau C H,Model J L,Oudot J,et al. Biodegradation of fuel oil hydrocarbons in the rhizosphere of maize[J]. Journal of Environmental Quality,2000,29:569-578.
[3]Wei S H,Zhou Q X,Zhang K S,et al. Roles of rhizosphere in remediation of contaminated soils and its mechanisms[J]. Chinese Journal of Applied Ecology,2003,14(1):143-147.
[4]谢晓梅,翁棣. 有机酸对镉在土壤矿物上吸附特征的影响[J]. 浙江大学学报:农业与生命科学版,2003,29(2):210-214.
[5]Gleba D,Borisjuk V B,Borisjuk L G,et al. Use of plant roots for phytoremediation and molecular farming [J]. Proceedings of the National Academy of Sciences,1999,96(11):5973-5977.
[6]Schnoor J L,Licht L A,Mcutcheon S C,et al. Phytoremediation of organic and nutrient contaminants[J]. Environmental Science & Technology,1995,29(7):318-323.
[7]Li G,Huang W,Lerner D N,et al.. Enrichment of degrading microbes and bioremediation of petrochemical contaminants in polluted soil[J]. Water Research,2000,34(15):3845-3853.
[8]OConnell P J,Harms C T,Allen J R F.Metolachlor,S-metolachlor and their role within sustainable weed-management[J]. Crop Protection,1998,17(3):207-212.
[9]Mohammad K,Waqar H. Effect of S-metolachlor (Dual Gold 960 EC) on weed control and yields in different crops[J]. Sarhad Journal of Agriculture,2003,19:333-339.
[10]李霞,王纯兰,郑亚东,等. 96%精异丙甲草胺乳油防除玉米、大豆田杂草试验[J]. 农药科学与管理,2006,27(6):23-25.
[11]Soltani N,Shropshire C,Cowan T,et al. Tolerance of black beans (Phaseolus vulgaris) to soil applications of S-metolachlor and imazethapyr[J]. Weed Technology,2004,18:111-118.
[12]中国科学院南京土壤研究所微生物室.土壤微生物研究法[M]. 北京:科学出版社,1985:44-58.
[13]闵航. 微生物研究技术[M]. 北京:科技出版社,1999:30-52.
[14]Long Y H,Li R Y,Wu X M. Degradation of S-metolachlor in soil as affected by environmental factors[J]. Journal of Soil Science and Plant Nutrition,2014,14(1):189-198.
侯少锋 李荣玉 尹显慧 龙友华 吴小毛



摘要:为了探明除草剂在烟草根际的降解与其根际微生物数量之间的关系,揭示烟草根际环境中除草剂快速降解的机制,采用室内模拟法研究精异丙甲草胺胁迫下烟草根际土壤微生物的动态响应及其降解动态。结果表明:在整个试验周期内,无论是处理土壤,还是对照土壤,根际土壤微生物区系数量、土壤呼吸作用均高于非根际土壤,存在明显的根际效应;真菌是精异丙甲草胺胁迫下的优势菌群,能够在该除草剂污染的根际土壤中旺盛生长;精异丙甲草胺在烟株根际土壤中更容易降解,与非根际土壤相比,根际土壤中精异丙甲草胺的降解速率提高了1.23倍,半衰期缩短了18.77%。
关键词:精异丙甲草胺;烟草根际;微生物;降解;动态响应;非根际土壤
中图分类号: S154.3文献标志码: A文章编号:1002-1302(2016)06-0493-03
收稿日期:2016-02-01
基金项目:国家自然科学基金(编号:21267007);中国烟草总公司贵州省公司科技项目专项[编号:201311,编号:201414];贵州省烟草公司毕节市公司项目(编号:BJYC-201304)。
作者简介:侯少锋(1987—),男,河北唐山人,硕士研究生,主要从事农药环境毒理学及农产品安全评价研究。Tel:(0851)88297830;E-mail:460912660@qq.com。
通信作者:吴小毛,博士,副教授,主要从事农药环境毒理学及农产品安全评价研究。Tel:(0851)88297830;E-mail:wuxm827@126.com。植物根际是根与土壤环境相互耦合的生态与环境界面,是一个较为特殊的微生态环境,由于其中的微生物活动非常旺盛,能加快土壤中有机化合物的分解及其他矿质元素的活化,根际环境,特别是有机污染物胁迫下的根际环境与一般土体存在显著差别[1]。由于植物根系脱落物及根系分泌作用的存在,根际环境中pH值、Eh(氧化还原电位)、养分状况的变化,将直接影响微生物组成、酶活性等物理、化学及生物学特性[2]。根际—土壤界面决定了污染物降解的过程远较一般土体复杂,有关污染物在根—土界面的形态及毒性变化的研究一直是环境科学研究的热点,但目前相关的研究主要集中于重金属及有机污染物方面[3-7]。
精异丙甲草胺(S-metolachlor)别称(S)-异丙甲草胺,是一种酰胺类除草剂,其化学名为2-氯-N-(2-乙基-6-甲基苯基)-N-[(1S)-2-甲氧基-1-甲基乙基]乙酰胺。精异丙甲草胺是一种选择性芽前土壤处理药剂,其主要作用机理为抑制发芽的杂草种子蛋白质的合成,其次是抑制胆碱类物质渗入磷脂,干扰卵磷脂的形成。精异丙甲草胺的杀草谱非常广范,其主要防除对象为一年生的单子叶杂草、部分阔叶杂草和莎草,并被广泛应用于玉米、马铃薯、水稻、大豆、烟草、蔬菜等多种作物的田间除草[8-11]。目前有关精异丙甲草胺胁迫下土壤微生物生态效应及其降解动态的研究较少,笔者选用烟株根际土壤为基质,采用室内模拟培养的方法,研究精异丙甲草胺胁迫下烟草植株根际微生物的动态变化及根际微生物对其降解潜力。
1材料与方法
1.1材料
1.1.1土壤在花溪烟草种植试验地中,采集以烟草K326烟株为中心、15 cm半径范围的整个土块,将抖落大块土壤后的烟株根系连同与之紧密黏附的土壤置于保鲜袋中,带回实验室,仔细刷下并收集黏附于烟株根系的土壤,风干,过1 mm筛,保存备用。
1.1.2药品及试剂精异丙甲草胺标准品[≥ 97.7%,85%(S)isomer],购自美国迪马科技有限公司。甲醇为色谱纯,其他试剂为分析纯。
1.1.3主要仪器设备6 890N气相色谱(带μECD检测器)、HP-5石英毛细管柱(30 m×0.32 mm,0.25 μm,美国Agilent)、AL104分析天平(瑞士梅特勒)、YX-208B灭菌锅(上海三申医疗器械有限公司)、SW-CJ-1FD超净工作台(杭州钱江仪器设备有限公司)、SHZ-82恒温振荡器(常州澳华仪器有限公司)、RE-52A型旋转浓缩蒸发仪(上海亚荣生化仪器厂)、 CH20生物显微镜[奥林巴斯(中国)有限公司]、BIC-300人工气候培养箱(上海博讯实业有限公司)。
1.2试验方法
1.2.1土壤微生物区系的动态响应试验分别称取500 g根际、非根际土样置于1 000 mL烧杯中,加入含精异丙甲草胺的甲醇溶液,使除草剂浓度均为6 mg/kg,待甲醇挥发后搅拌均匀,用蒸馏水调节湿度至土壤最大持水量的60%。土样于25 ℃培养箱中恒温培养60 d,每个处理均设置3次重复,同时设空白对照(CK),试验期间定时称质量补足水分含量。于1、3、7、14、21、30、45、60 d定时取样测定,微生物计数采用固体平板梯度稀释涂布培养计数法,细菌用牛肉膏蛋白胨琼脂培养基培养,真菌用马丁氏培养基培养,放线菌用改良高氏1号培养基培养[12]。
1.2.2土壤呼吸作用测定采用直接吸收法测定[13]。称取50 g土样、1 g葡萄糖于100 mL烧杯中,加入少量水湿润土壤后于25 ℃恒温箱中避光培养7 d,然后添加含精异丙甲草胺的甲醇溶液并使其浓度分别为1、3、6、9、12 mg/kg。待甲醇挥发后搅拌均匀,用蒸馏水调节湿度至土壤最大持水量的60%,将装有土样的烧杯与盛有40 mL 0.2 mol/L NaOH的小烧杯一起置于密闭容器中,每个处理3次重复,同时设空白对照(CK),恒温培养60 d,定期取出NaOH溶液用0.4 moL/L HCl溶液滴定,同时换入新鲜的NaOH溶液,继续培养。根据HCl溶液的消耗量计算100 g干土的CO2释放量。在整个试验阶段适时补水,以保持土壤含水量恒定。
1.2.3在根际土壤中的降解试验分别称取20 g根际、非根际土样于100 mL锥形瓶中,加入含精异丙甲草胺的甲醇溶液,使其浓度均为6 mg/kg,待溶剂挥发后搅拌均匀,加入适量无菌蒸馏水,使含水量为田间最大持水量的60%,土样于25 ℃恒温培养箱内黑暗培养,每个处理均设3次重复,在整个试验阶段适时称质量补水,以保持土壤含水量恒定。于0、7、14、30、60 d后取样,采用液相色谱法测定精异丙甲草胺的残留量[14]。
2结果与分析
2.1细菌的动态响应
由图1可见,在整个试验期内,根际土细菌数量均高于非根际土;与非根际土相似,经精异丙甲草胺处理的根际土壤,细菌的生长开始被抑制,到一定时间后被促进。在试验前期(1~7 d),与对照土壤相比,施用精异丙甲草胺处理后,根际与非根际土壤细菌的生长基本受到抑制,在培养1 d时抑制作用达到最大值。随后,各处理的抑制作用逐渐减弱,其中精异丙甲草胺在培养7 d时对根际土壤细菌生长的抑制效应消失,开始促进细菌生长,且促进效应一直继续到试验结束,并且细菌数量均显著高于对照土壤(P<0.05)。经精异丙甲草胺处理的根际、非根际土壤的细菌数量在21 d到达最大值,其中处理根际土壤细菌数量比对照根际土壤增加了2815%,而处理非根际土壤细菌数量比对照土壤增加了780%,此时处理根际土壤细菌数量是处理非根际土壤的111倍,即处理土壤的根际效应R/S(1 g根际土壤中所含微生物数量与非根际土壤的相应值之比)为1.11,而对照土壤的根际效应R/S为1.06,差异均达到显著水平(P<0.05)。
2.2真菌的动态响应
从图2可以看出,精异丙甲草胺对根际与非根际土壤真菌的生长一直表现为促进作用,30~60 d内,真菌数量均明显高于对照土壤。精异丙甲草胺处理土壤的真菌数量在14 d时到达最大值,其中根际土壤真菌数量比对照土壤增加了39.14%,相应的非根际土壤真菌数量比对照土壤增加了2953%,此时处理土壤的根际效应R/S也达到峰值,为114,对照土壤的根际效应R/S为1.08,差异均达到显著水平(P<0.05)。在整个试验周期内,无论是处理土壤还是对照土壤,根际土中的真菌数量均要高于非根际土,但在试验后期(45~60 d),根际与非根际土壤的真菌数量之间不存在明显差异。
2.3放线菌的动态响应
由图3可知,在培养期间,根际土壤放线菌数量均高于非根际土壤;精异丙甲草胺对放线菌生长的影响为抑制—恢复—刺激。处理1~14 d,与对照土壤相比,精异丙甲草胺处理下的放线菌生长受到抑制,1 d时抑制作用最大,根际土壤的最大抑制率为14.51%,非根际土壤的抑制率为1432%。精异丙甲草胺处理根际土壤的放线菌数量在14 d时达到峰值,此时,处理土壤的根际效应R/S也达到最大值,为1.07,差异也达显著水平(P<0.05)。14 d后抑制作用逐渐减弱,其中精异丙甲草胺处理的根际土壤放线菌数量在21 d时恢复到对照水平,30 d时开始促进放线菌生长,且促进作用一直继续到试验结束,但差异明显。在整个试验周期内,无论是处理土壤还是对照土壤,根际土中的放线菌数量均要高于非根际土。
2.4对根际土壤呼吸作用的影响
如图4所示,与非根际土相似,施用除草剂对根际土壤呼吸均有一定的刺激作用,在3 d时,土壤呼吸强度达到了最高值,精异丙甲草胺处理的根际土壤呼吸强度比对照土壤增加了18.82%,相应的非根际土壤呼吸强度比对照土壤增加了15.41%,处理根际比处理非根际土增加了15.32%,即处理土壤的根际效应R/S为1.15,对照土壤的根际效应R/S为112,差异均达到显著水平(P<0.05)。随后精异丙甲草胺对根际土壤呼吸的刺激作用逐渐减弱。45 d时,精异丙甲草胺处理根际土壤的呼吸在7~60 d内继续保持刺激状态,而非根际土壤的呼吸强度在45 d时基本与对照持平。在整个试验周期内,根际土壤呼吸强度均高于非根际土壤。
2.5在根际土壤中的降解动态
由图5可知,在培养60 d,根际土壤中精异丙甲草胺的降解率为86.67%,而在非根际土壤中的降解率仅为80.33%,差异均达到显著水平(P<0.05)。精异丙甲草胺除草剂在根际土壤中的降解也可用一级反应动力学方程模拟(表1),根际土壤中精异丙甲草胺的降解速率常数为0.032 3,相应的半衰期为21.5 d;非根际土壤中精异丙甲草胺的降解速率常数为0.026 4,相应的半衰期为26.3 d。与非根际土壤相比,根际土壤中精异丙甲草胺的降解速率常数提高了1.22倍,半衰期缩短了18.25%。综合精异丙甲草胺胁迫下根际土壤微生物种群数量变化,根际微生物具有加快除草剂降解的潜力,表明植物种植可能是实现土壤农药污染治理的一种有效途径。
3结论与讨论
微生物是根际微域中最活跃的生物相,其在有机物根际污染生态系统中的作用尤为重要。本研究表明,在整个试验周期内,无论是处理土壤还是对照土壤,根际土壤微生物区系数量、土壤呼吸作用均高于非根际土土壤,存在明显的根际效应。所研究的除草剂精异丙甲草胺在烟株根际土壤中更容易降解,与非根际土壤相比,根际土壤中精异丙甲草胺的半衰期缩短了18.77%,降解速率提高了1.23倍。同时,精异丙甲草胺对细菌、真菌和放线菌的影响不同:细菌是先抑制后促进,真菌是持续促进,放线菌是抑制—恢复—刺激。真菌是精异丙甲草胺胁迫下的优势菌群,均能够在除草剂污染的根际土壤中旺盛生长。这说明土壤真菌在精异丙甲草胺的驯化作用下大多都具备了耐受除草剂的能力或者部分敏感菌群趋于消亡而耐受菌群能够旺盛生长。本研究初步探讨了精异丙甲草胺对烟草根际土壤微生物的影响及其降解动态,有关精异丙甲草胺对土壤酶活性的毒性效应方面有待进一步研究。
参考文献:
[1]刘芷宇. 根际动态及其效应的研究[J]. 世界农业1987,8:39-41.
[2]Chaineau C H,Model J L,Oudot J,et al. Biodegradation of fuel oil hydrocarbons in the rhizosphere of maize[J]. Journal of Environmental Quality,2000,29:569-578.
[3]Wei S H,Zhou Q X,Zhang K S,et al. Roles of rhizosphere in remediation of contaminated soils and its mechanisms[J]. Chinese Journal of Applied Ecology,2003,14(1):143-147.
[4]谢晓梅,翁棣. 有机酸对镉在土壤矿物上吸附特征的影响[J]. 浙江大学学报:农业与生命科学版,2003,29(2):210-214.
[5]Gleba D,Borisjuk V B,Borisjuk L G,et al. Use of plant roots for phytoremediation and molecular farming [J]. Proceedings of the National Academy of Sciences,1999,96(11):5973-5977.
[6]Schnoor J L,Licht L A,Mcutcheon S C,et al. Phytoremediation of organic and nutrient contaminants[J]. Environmental Science & Technology,1995,29(7):318-323.
[7]Li G,Huang W,Lerner D N,et al.. Enrichment of degrading microbes and bioremediation of petrochemical contaminants in polluted soil[J]. Water Research,2000,34(15):3845-3853.
[8]OConnell P J,Harms C T,Allen J R F.Metolachlor,S-metolachlor and their role within sustainable weed-management[J]. Crop Protection,1998,17(3):207-212.
[9]Mohammad K,Waqar H. Effect of S-metolachlor (Dual Gold 960 EC) on weed control and yields in different crops[J]. Sarhad Journal of Agriculture,2003,19:333-339.
[10]李霞,王纯兰,郑亚东,等. 96%精异丙甲草胺乳油防除玉米、大豆田杂草试验[J]. 农药科学与管理,2006,27(6):23-25.
[11]Soltani N,Shropshire C,Cowan T,et al. Tolerance of black beans (Phaseolus vulgaris) to soil applications of S-metolachlor and imazethapyr[J]. Weed Technology,2004,18:111-118.
[12]中国科学院南京土壤研究所微生物室.土壤微生物研究法[M]. 北京:科学出版社,1985:44-58.
[13]闵航. 微生物研究技术[M]. 北京:科技出版社,1999:30-52.
[14]Long Y H,Li R Y,Wu X M. Degradation of S-metolachlor in soil as affected by environmental factors[J]. Journal of Soil Science and Plant Nutrition,2014,14(1):189-198.

