精氨酰-tRNA合成酶在局灶性脑缺血再灌注大鼠中的表达及机制研究
沈 寅,范云智,范宇葱,符 荣
·论著·
精氨酰-tRNA合成酶在局灶性脑缺血再灌注大鼠中的表达及机制研究
沈 寅,范云智,范宇葱,符 荣
430030湖北省武汉市,华中科技大学同济医学院附属协和医院神经外科
【摘要】背景目前,临床上针对哺乳动物氨基酰-tRNA合成酶的研究主要集中在精氨酰-tRNA合成酶、亮氨酰-tRNA合成酶、甲硫氨酰-tRNA合成酶、丙氨酰-tRNA合成酶的结构和功能方面,对哺乳动物尤其是大鼠脑缺血与氨基酰-tRNA合成酶关系的研究报道极少。目的探讨精氨酰-tRNA合成酶在局灶性脑缺血再灌注大鼠中的表达及机制。方法选取清洁级健康雄性SD大鼠60只,其中4只大鼠进行预实验,采用线栓法栓塞大脑中动脉建立局灶性脑缺血再灌注模型。然后将剩余的56只大鼠随机分为正常组8只、假手术组8只、脑缺血再灌注组40只。正常组不做任何外科处理;假手术组大鼠外科操作步骤与脑缺血再灌注组相同,只是线栓不进入颈内动脉、不造成脑缺血;脑缺血再灌注组大鼠建立局灶性脑缺血再灌注模型。采用反转录-聚合酶链反应(RT-PCR)测定正常组、假手术组、脑缺血再灌注组大鼠再灌注后不同时间点精氨酰-tRNA合成酶mRNA相对表达量,采用Western Blotting法测定正常组、假手术组、脑缺血再灌注组大鼠再灌注后不同时间点精氨酰-tRNA合成酶蛋白相对表达量。结果假手术组与脑缺血再灌注组大鼠再灌注2 h、脑缺血再灌注组再灌注48 h精氨酰-tRNA合成酶mRNA相对表达量及蛋白相对表达量比较,差异无统计学意义(P>0.05);假手术组大鼠精氨酰-tRNA合成酶mRNA相对表达量及蛋白相对表达量均低于脑缺血再灌注组再灌注6 h、12 h及24 h(P<0.05);脑缺血再灌注组大鼠再灌注6 h精氨酰-tRNA合成酶mRNA相对表达量及蛋白相对表达量均高于再灌注2 h和12 h(P<0.05);脑缺血再灌注组大鼠再灌注24 h精氨酰-tRNA合成酶mRNA相对表达量及蛋白相对表达量均高于再灌注12 h和48 h(P<0.05)。结论大鼠局灶性脑缺血再灌注后6 h及24 h精氨酰-tRNA合成酶表达明显升高,可能与缺血和再灌注两次损伤有关。
【关键词】脑缺血;再灌注损伤;精氨酰-tRNA合成酶
沈寅,范云智,范宇葱,等.精氨酰-tRNA合成酶在局灶性脑缺血再灌注大鼠中的表达及机制研究[J].实用心脑肺血管病杂志,2016,24(6):54-58.[www.syxnf.net]
SHEN Y,FAN Y Z,FAN Y C,et al.Expression of arginyl-tRNA synthetase in rats with focal cerebral ischemia reperfusion and the mechanism[J].Practical Journal of Cardiac Cerebral Pneumal and Vascular Disease,2016,24(6):54-58.
缺血性脑卒中是指由于脑供血动脉狭窄或闭塞导致的脑组织缺血缺氧甚至坏死,可严重威胁患者生命健康。目前,缺血性脑卒中的治疗手段较多,但治疗效果不理想。脑缺血耐受是机体自身一种强大的内源性保护机制,但其确切的分子作用机制尚不清楚。ANDERSON等[1]研究发现,线虫氨基酰-tRNA合成酶基因被抑制后,蛋白质翻译明显减少,线虫的低氧耐受能力明显增强,故认为抑制氨基酰-tRNA合成酶基因能够抑制基因转录,导致细胞生物学行为变化,如三磷腺苷(ATP)消耗减少等。临床研究显示,基因转录抑制导致能量消耗急剧下降是冬眠动物在长期缺氧环境下存活的一种行之有效的内在机制[2],提示急性缺血状态下氨基酰-tRNA合成酶基因沉默极有可能是一种新的脑缺血耐受保护机制。迄今为止,有关哺乳动物脑缺血耐受与氨基酰-tRNA合成酶基因抑制关系的研究报道极少。本研究拟通过建立大鼠局灶性脑缺血再灌注模型,观察精氨酰-tRNA合成酶在局灶性脑缺血再灌注大鼠中的表达,间接判断缺血脑组织半暗带细胞能量代谢的变化规律,旨在探究精氨酰-tRNA合成酶在局灶性脑缺血再灌注大鼠中的表达及机制。
1材料与方法
1.1实验动物实验动物的购买、麻醉和外科操作均经华中科技大学同济医学院实验动物中心批准。于2015年选取清洁级健康雄性SD大鼠60只,体质量(280±20)g,由同济医学院实验动物中心提供;饲养条件:25 ℃、12 h昼夜喂养。
1.2主要仪器及试剂一氯化三苯基四氮唑(TTC)购自美国sigma公司,2.0 T核磁共振仪购自美国GE公司,羊抗鼠精氨酰-tRNA合成酶IgG、兔抗羊抗体及ABC试剂盒购自Santa Cruz 公司;Trizol购自GIBCOL公司;精氨酰-tRNA合成酶基因引物由巴菲尔生物技术公司合成;反转录-聚合酶链反应(RT-PCR)试剂盒购自Promega公司,BCA蛋白浓度测定试剂盒购自碧云天生物试剂公司;其他试剂均为国内分析纯。 LEICA-Q500IW图像分析系统购自德国Meilteler公司,UVP ImageStore 5000 cobine系统购自美国。
1.3实验分组首先选取4只大鼠进行预实验,建立局灶性脑缺血再灌注模型,4只大鼠均建模成功。然后将剩余的56只大鼠随机分为正常组8只、假手术组8只、脑缺血再灌注组40只。正常组大鼠不做任何外科处理;假手术组大鼠外科操作步骤与脑缺血再灌注组相同,只是线栓不进入颈内动脉、不造成脑缺血;脑缺血再灌注组大鼠建立局灶性脑缺血再灌注模型。
1.4局灶性脑缺血再灌注模型采用线栓法栓塞大脑中动脉建立局灶性脑缺血再灌注模型:暴露左侧颈总动脉,结扎颈外动脉;线栓(线栓为进口尼龙线,直径0.2 mm,长度2.4 cm,头端为直径0.25~0.28 mm的圆钝小球)经颈外动脉插入颈内动脉2.0~2.2 cm,用以封闭大脑中动脉;15 min后拔出线栓至颈外动脉形成大脑中动脉再灌注;造模后,观察大鼠行为以证实栓塞大脑中动脉有效。局灶性脑缺血再灌注模型建立成功标准:大鼠出现左侧Horner征,右前爪不能伸直,爬行时向右侧转圈或向右侧倾倒。局灶性脑缺血再灌注造模成功大鼠方可进入实验;造模大鼠死亡或出现蛛网膜下腔出血或无左侧Horner征及右侧偏瘫表现均为造模失败,不能进入实验,选取同一批次的大鼠制成合格模型后补足数目。
1.5TTC染色大鼠采用2.0 T核磁共振仪扫描后腹腔注射过量麻醉剂即刻断头处死,无菌条件下迅速取出大鼠脑组织快速低温冷冻,做连续2 mm厚冠状切片,随后放入1% TTC溶液中,37 ℃下染色30 min。正常脑组织TTC染色显示为红色,缺血区脑组织TTC染色显示为白色。
1.6RT-PCR正常组、假手术组各选取4只大鼠,脑缺血再灌注组于再灌注2 h、6 h、12 h、24 h、48 h分别选取4只大鼠,注射过量麻醉剂致死,快速断头取脑。无菌条件下取出正常组、假手术组大鼠正常脑组织及脑缺血灌注组大鼠缺血区脑组织,采用RNAiso Plus裂解细胞,三氯甲烷溶解总RNA,异丙醇沉淀RNA,沉淀RNA经无水乙醇洗涤后采用不含RNA酶的双蒸水溶解。然后采用分光光度法测定RNA纯度。精氨酰-tRNA合成酶基因扩增引物由Primer 3软件进行设计,在上海生工生物技术公司合成。上游引物为5′-CATCAAATACGCCGACCTTT-3′,下游引物为5′-GTAAAATGCACCGTCCCAGT-3′,产物长度为233 bp;内参照为β-actin,其上游引物为5′-GAGAGGGAAATCGTGCGTGAC-3′,下游引物为5′-CATCTGCTGGAAGGTGGACA-3′,产物长度为462 bp。RNA反转录成cDNA及PCR扩增过程均严格按照试剂生产商提供的说明书进行。配制1.2%琼脂糖凝胶电泳,10 μl PCR扩增产物(精氨酰-tRNA合成酶基因和β-actin基因)电泳。采用GDS8000凝胶成像系统及LEICA-Q500IW图像分析系统进行电泳条带分析,并计算精氨酰-tRNA合成酶mRNA相对表达量,精氨酰-tRNA合成酶mRNA相对表达量=精氨酰-tRNA合成酶mRNA/β-actin mRNA。
1.7Western Blotting法正常组、假手术组各选取4只大鼠,脑缺血再灌注组于再灌注2 h、6 h、12 h、24 h、48 h分别选取4只大鼠,注射过量麻醉剂致死,快速断头取脑。选取正常组、假手术组大鼠正常脑组织及脑缺血灌注组大鼠缺血区脑组织,匀浆后采用TBS缓冲液(50 mM Tris-HCl,150 mM NaCl,5 mM CaCl,0.05%Brij-35,0.1 mM PMSF,pH 7.4)抽提,匀浆缓冲液4 ℃ 12 000 r/min离心20 min。取含细胞质成分的上清液,采用BCA蛋白浓度测定试剂盒测定蛋白浓度。取70 μg蛋白溶液于10%聚丙烯酰胺凝胶电泳,然后转染到PVDF膜上。将转染后的PVDF膜置于含5%脱脂牛奶和小牛血清的0.05% Tween-20的TBS缓冲液中用以封闭非特异性抗体。室温下一抗(精氨酰-tRNA合成酶1∶500,β-actin 1∶1 000)和PVDF膜反应2 h,然后加入二抗反应2 h。试剂盒(增强化学发光法)用作抗体检测。PVDF膜置于X线胶片下,采用化学发光法UVP ImageStore 5000 cobine系统对获取的条带进行光密度测定和定量分析。精氨酰-tRNA合成酶蛋白相对表达量=精氨酰-tRNA合成酶蛋白/β-actin蛋白。
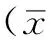
2结果
2.1局灶性脑缺血再灌注模型的建立及稳定性各组大鼠动脉压、肛温、动脉血氧分压、血糖、心率及呼吸频率比较,差异均无统计学意义(P>0.05,见表1)。对局灶性脑缺血再灌注大鼠苏醒后进行行为观察及脑组织切片TTC染色,结果显示,40只大鼠均出现左侧Horner征、右前爪不能伸直、行走时向右转圈或向右倾倒。
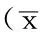
Table 1Comparison of arterial pressure,rectal temperature,arterial oxygen partial pressure,blood glucose,heart rate,respiratory rate in the three groups
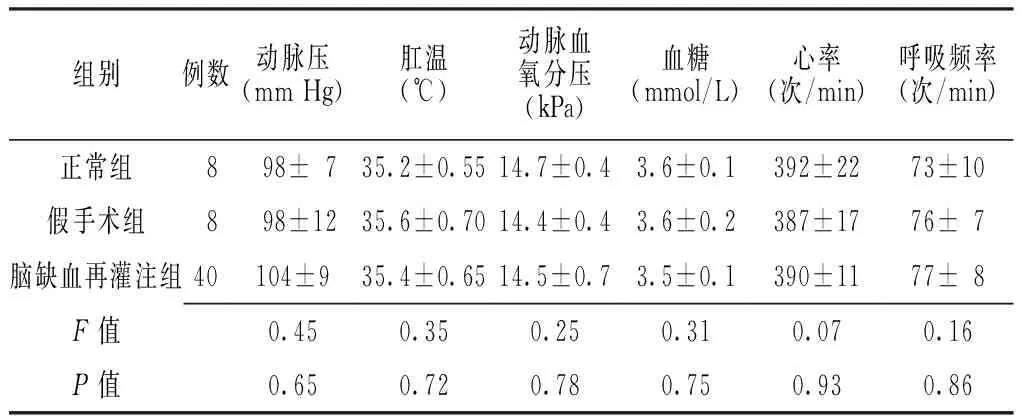
组别例数动脉压(mmHg)肛温(℃)动脉血氧分压(kPa)血糖(mmol/L)心率(次/min)呼吸频率(次/min)正常组 8 98±7 35.2±0.5514.7±0.43.6±0.1392±2273±10假手术组 8 98±12 35.6±0.7014.4±0.43.6±0.2387±1776±7脑缺血再灌注组40104±935.4±0.6514.5±0.73.5±0.1390±1177±8F值0.450.350.250.310.070.16P值0.650.720.780.750.930.86
注:1 mm Hg=0.133 kPa
2.2各组大鼠精氨酰-tRNA合成酶mRNA及蛋白表达情况各组大鼠精氨酰-tRNA合成酶mRNA相对表达量及蛋白相对表达量比较,差异均有统计学意义(P<0.05)。假手术组与脑缺血再灌注组大鼠再灌注2 h、48 h精氨酰-tRNA合成酶mRNA相对表达量及蛋白相对表达量比较,差异无统计学意义(P>0.05);假手术组大鼠精氨酰-tRNA合成酶mRNA相对表达量及蛋白相对表达量均低于脑缺血再灌注组再灌注6 h、12 h及24 h,差异有统计学意义(P<0.05);脑缺血再灌注组大鼠再灌注6 h精氨酰-tRNA合成酶mRNA相对表达量及蛋白相对表达量均高于再灌注2 h及12 h,差异有统计学意义(P<0.05);脑缺血再灌注组大鼠再灌注24 h精氨酰-tRNA合成酶mRNA相对表达量及蛋白相对表达量均高于再灌注12 h及48 h,差异有统计学意义(P<0.05,见表2,图1~2)。
3讨论
哺乳动物冬眠状态下体温下降、氧耗减少、心率减慢及可调节性细胞、组织代谢抑制。NATHANIEL[3]认为机体可调节性细胞、组织代谢抑制是防治脑缺血缺氧损伤的新策略之一。ASAMI等[4]研究认为,减少氧耗、降低细胞代谢能够减轻组织器官缺血缺氧性损伤(包括脑损伤),其可能成为临床治疗重症疾病的重要研究方向之一。赵睿等[5]对冬眠动物北极地松鼠进行离体细胞培养发现,在体外缺氧和葡萄糖匮乏条件下培养其海马区神经元几乎未遭受任何损伤;用同样方法培养人类海马区神经元则发现细胞严重损伤且细胞数量大量减少;进一步研究发现,这种对缺氧缺糖的耐受能力归因于能源物质匮乏促发了北极地松鼠神经元再生;且通过研究ATP产量推测,在缺血缺氧条件下北极地松鼠神经元能量代谢率急剧降低[6]。
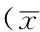
Table 2Comparison of relative expression quantity of arginyl-tRNA synthetase mRNA and arginyl-tRNA synthetase protein in the three groups
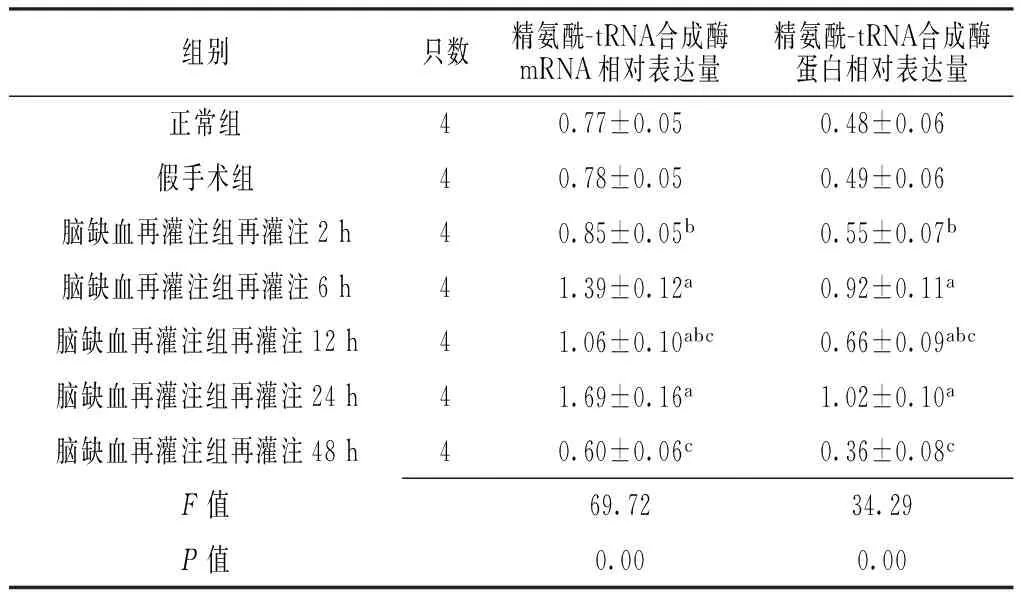
组别只数精氨酰-tRNA合成酶mRNA相对表达量精氨酰-tRNA合成酶蛋白相对表达量正常组40.77±0.050.48±0.06假手术组40.78±0.050.49±0.06脑缺血再灌注组再灌注2h40.85±0.05b0.55±0.07b脑缺血再灌注组再灌注6h41.39±0.12a0.92±0.11a脑缺血再灌注组再灌注12h41.06±0.10abc0.66±0.09abc脑缺血再灌注组再灌注24h41.69±0.16a1.02±0.10a脑缺血再灌注组再灌注48h40.60±0.06c0.36±0.08cF值69.7234.29P值0.000.00
注:与假手术组比较,aP<0.05;与脑缺血再灌注组再灌注6 h比较,bP<0.05;与脑缺血再灌注组再灌注24 h比较,cP<0.05
图1 3组大鼠精氨酰-tRNA合成酶mRNA表达情况
Figure 1Expression of arginyl-tRNA synthetase mRNA in the three groups

图2 3组大鼠精氨酰-tRNA合成酶蛋白表达情况
Figure 2Expression of arginyl-tRNA synthetase protein in the three groups
氨基酰-tRNA合成酶作为蛋白质生物合成过程中的一类关键酶,其底物是氨基酸、tRNA 和ATP。通常细胞中含有20种氨基酰-tRNA合成酶,根据保守序列和特征结构花式不同可分为两大类,各包括10种氨基酰-tRNA合成酶,且每种氨基酰-tRNA合成酶对应一种氨基酸和相应的tRNA。氨基酰-tRNA合成酶可催化相应tRNA的氨基酰化,氨基酰化的tRNA 通过tRNA的反密码子与mRNA上的密码子配对,在核糖体上将氨基酸依次连接并合成蛋白质[6]。
2009年ANDERSON等[1]通过RNAi技术抑制了线虫体内氨基酰-tRNA合成酶的表达,结果发现氨基酰-tRNA合成酶基因沉默后蛋白质翻译明显减少,其低氧耐受能力明显增强,缺氧所致的死亡率明显降低,且低氧耐受能力与蛋白质翻译水平呈负相关。以上研究结果表明,抑制氨基酰-tRNA合成酶基因能够抑制蛋白质翻译,导致细胞生物学行为变化,如ATP消耗减少等,故推测蛋白质翻译减少导致能量消耗急剧下降是冬眠动物在长期缺氧环境下存活的一种行之有效的内在机制。KAMPHUIS等[7]对大鼠视网膜细胞缺血60 min前进行5 min缺血预处理,采用微阵列技术分析了104个已知基因在缺血预处理后1~7 d的表达情况;结果发现,缺血预处理能够完全阻止后续缺血对视网膜的损伤,对视网膜具有保护作用,同时发现编码氨基酰-tRNA合成酶的基因(Iars,Lars,Cars,Yars,Gars,Tars)表达明显下调,缺血预处理后24 h和48 h下降幅度达30%~45%;定量PCR结果显示,Iars、Lars、Cars、Yars、Tars等基因的转录在缺血预处理后24 h平均下降31.7%,在缺血预处理后48 h平均下降 49.3%;微阵列探针发现14个已知的氨基酰-tRNA合成酶中9个在缺血预处理后24 h和48 h转录减少,提示缺血预处理对视网膜细胞的保护作用与缺血预处理后参与氨基酸代谢和转运过程的氨基酰-tRNA合成酶和基因转录减少有关,因此推测氨基酰-tRNA合成酶基因转录减少和功能降低可能是保护视网膜细胞的一种有效机制。另有研究显示,采用放线菌酮抑制蛋白质合成能够降低脑[8]和脊髓[9-10]的缺血性损伤,有助于维持细胞存活,但蛋白质合成的全面下调如何介导神经保护作用机制目前尚不清楚。
目前,临床上针对哺乳动物氨基酰-tRNA合成酶的研究主要集中在精氨酰-tRNA合成酶[11-12]、亮氨酰-tRNA合成酶[13]、甲硫氨酰-tRNA合成酶[14]、丙氨酰-tRNA合成酶[15]的结构和功能方面,对哺乳动物尤其是大鼠脑缺血与氨基酰-tRNA合成酶关系的研究报道极少。本研究结果显示,正常组、假手术组大鼠脑组织及缺血再灌注组大鼠缺血区脑组织中均有精氨酰-tRNA合成酶的表达,且正常组和假手术组大鼠精氨酰-tRNA合成酶mRNA及蛋白相对表达量间无差异,提示假手术对精氨酰-tRNA合成酶的表达无影响。本研究结果亦显示,假手术组大鼠精氨酰-tRNA合成酶mRNA相对表达量及蛋白相对表达量均低于脑缺血再灌注组再灌注6 h、12 h及24 h,脑缺血再灌注组大鼠再灌注6 h精氨酰-tRNA合成酶mRNA相对表达量及蛋白相对表达量均高于再灌注2 h和12 h,脑缺血再灌注组大鼠再灌注24 h精氨酰-tRNA合成酶mRNA相对表达量及蛋白相对表达量均高于再灌注12 h和48 h,表明精氨酰-tRNA合成酶表达在局灶性脑缺血再灌注6 h和24 h出现两个高峰,可能与缺血和再灌注两次损伤有关。精氨酰-tRNA合成酶mRNA表达与蛋白表达规律相似,但分析数据发现蛋白表达强度弱于mRNA表达强度,其原因有待进一步分析。
综上所述,大鼠局灶性脑缺血再灌注6 h及24 h精氨酰-tRNA合成酶表达明显升高,分析其机制可能如下:受细胞缺氧、去极化、K+水平升高等因素影响,机体通过某种机制导致细胞氨基酰-tRNA合成酶活性增加,进而增加脑缺血再灌注组织脑细胞的蛋白质合成以稳定缺血脑细胞的结构,进而维持正常的细胞功能;而脑缺血损伤导致精氨酰-tRNA合成酶代偿性增多,在再灌注后缺氧情况得到改善,精氨酰-tRNA合成酶表达随之降低,但随着再灌注损伤出现,细胞代谢紊乱进一步加重,为了维持细胞结构稳定精氨酰-tRNA合成酶再次代偿性增多。因此笔者推测大鼠局灶性脑缺血再灌注后6 h及24 h精氨酰-tRNA合成酶两次增高可能与缺血和再灌注两次损伤有关,精氨酰-tRNA合成酶基因和蛋白表达增加可能是哺乳动物脑缺血再灌注后的一种机体自我修复机制。
作者贡献:沈寅、符荣进行实验设计、撰写论文、成文并对文章负责;沈寅、范云志、范宇葱进行实验实施、评估、资料收集;符荣进行质量控制及审校。
本文无利益冲突。
参考文献
[1]ANDERSON L L,MAO X,SCOTT B A,et al.Survival from hypoxia in C.elegans by inactivation of aminoacyl-tRNA synthetases[J].Science,2009,323(5914):630-633.
[2]STOREY K B,STOREY J M.Metabolic rate depression in animals:transcriptional and translational controls[J].Biol Rev Camb Philos Soc,2004,79(1):207-233.
[3]NATHANIEL T I.Brain-regulated metabolic suppression during hibernation:a neuroprotective mechanism for perinatal hypoxia-ischemia[J].Int J Stroke,2008,3(2):98-104.
[4]ASLAMI H,JUFFERMANS N P.Induction of a hypometabolic state during critical illness——a new concept in the ICU?[J].Neth J Med,2010,68(5):190-198.
[5]赵睿,高凯,于常海.脑能量代谢研究的回顾与前瞻[J].科学,2009,61(3):11-14.
[6]ROSS A P,CHRISTIAN S L,ZHAO H W,et al.Persistent tolerance to oxygen and nutrient deprivation and N-methyl-D-aspartate in cultured hippocampal slices from hibernating Arctic ground squirrel[J].J Cereb Blood Flow Metab,2006,26(9):1148-1156.
[7]KAMPHUIS W,DIJK F,VAN SOEST S,et al.Global gene expression profiling of ischemic preconditioning in the rat retina[J].Mol Vis,2007,28(13):1020-1030.
[8]KATO H,KANELLOPOULOS G K,MATSUO S,et al.Protection of rat spinal cord from ischemia with dextrorphan and cycloheximide:effects on necrosis and apoptosis[J].J Thorac Cardiovasc Surg,1997,114(4):609-618.
[9]SNIDER B J,DU C,WEI L,et al.Cycloheximide reduces infarct volume when administered up to 6 h after mild focal ischemia in rats[J].Brain Res,2001,917(2):147-157.
[10]LIANG C L,YANG L C,LU K,et al.Neuroprotective synergy of N-methyl-D-aspartate receptor antagonist(MK801) and protein synthesis inhibitor(cycloheximide) on spinal cord ischemia-reperfusion injury in rats[J].J Neurotrauma,2003,20(2):195-206.
[11]RODOVICIUS H,BURNECKIENE J.Seasonal differences in activities of rabbit liver tRNA and aminoacyl-tRNA synthetases specific for valine and arginine under myocardial ischemia[J].Medicina(Kaunas),2006,42(3):225-230.
[12]YANG F,XIA X,LEI H Y,et al.Hemin binds to human cytoplasmic arginyl-tRNA synthetase and inhibits its catalytic activity[J].J Biol Chem,2010,285(50):39437-39446.
[13]CHEN X,MA J J,TAN M,et al.Modular pathways for editing non-cognate amino acids by human cytoplasmic leucyl-tRNA synthetase[J].Nucleic Acids Res,2011,39(1):235-247.
[14]GÖTZ A,TYYNISMAA H,EURO L,et al.Exome sequencing identifies mitochondrial alanyl-tRNA synthetase mutations in infantile mitochondrial cardiomyopathy[J].Am J Hum Genet,2011,13(5):635-642.
[15]JONES T E,ALEXANDER R W,PAN T.Misacylation of specific nonmethionyl tRNAs by a bacterial methionyl-tRNA synthetase[J].Proc Natl Acad Sci USA,2011,26(17):6933-6938.
(本文编辑:谢武英)
基金项目:国家自然科学基金项目(81371453)
通信作者:符荣,430030湖北省武汉市,华中科技大学同济医学院附属协和医院神经外科;E-mail:FurongLP@163.com
【中图分类号】R 743.31
【文献标识码】A
DOI:10.3969/j.issn.1008-5971.2016.06.014
Corresponding author:FU Rong,Department of Neurosurgery,Union Hospital Affiliated to Tongji Medical College,Huazhong University of Science and Technology,Wuhan 430030,China;E-mail:FurongLP@163.com
(收稿日期:2016-02-16;修回日期:2016-06-07)
Expression of Arginyl-tRNA Synthetase in Rats With Focal Cerebral Ischemia Reperfusion and the Mechanism
SHENYin,FANYun-zhi,FANYu-cong,FURong.
DepartmentofNeurosurgery,UnionHospitalAffiliatedtoTongjiMedicalCollege,HuazhongUniversityofScienceandTechnology,Wuhan430030,China
【Abstract】BackgroundsAt present,aminoacyl-tRNA synthetase related clinical studies mostly concentrate on the structure and function of arginyl-tRNA synthetase,leucyl-tRNA synthetase,methionyl-tRNA synthetase and alanyl-tRNA synthetase,research reports about relationship between aminoacyl-tRNA synthetase and cerebral ischemia is relatively rare.ObjectiveTo explore the expression of arginyl-tRNA synthetase in rats with focal cerebral ischemia reperfusion and the mechanism.MethodsAt first,4 out of 60 clean healthy male SD rats were selected to carry out the preliminary experiment,then the other 56 rats were randomly divided into A group(n=8),B group(n=8)and C group(n=40);focal cerebral ischemia reperfusion model was prepared by suture-occluded method(by embolization of middle cerebral artery).Rats of A group did not received any surgical intervention,rats of C group prepared for focal cerebral ischemia reperfusion model,while rats of B group received same surgical intervention without line-lock of internal carotid or cerebral ischemia.RT-PCR was used to detect the relative expression quantity of arginyl-tRNA synthetase mRNA,Western Blotting method was used to detect the relative expression quantity of arginyl-tRNA synthetase protein.ResultsAfter 2 hours and 48 hours of reperfusion,no statistically significant differences of relative expression quantity of arginyl-tRNA synthetase mRNA or arginyl-tRNA synthetase protein was found between B group and C group(P>0.05);after 6 hours,12 hours and 24 hours of reperfusion,the relative expression quantity of arginyl-tRNA synthetase mRNA and arginyl-tRNA synthetase protein of B group were statistically significantly lower than those of C group(P<0.05).After 6 hours of reperfusion,the relative expression quantity of arginyl-tRNA synthetase mRNA and arginyl-tRNA synthetase protein of C group were statistically significantly higher than those after 2 hours and 12 hours of reperfusion(P<0.05);after 24 hours of reperfusion,the relative expression quantity of arginyl-tRNA synthetase mRNA and arginyl-tRNA synthetase protein of C group were statistically significantly higher than those after 12 hours and 48 hours of reperfusion(P<0.05).ConclusionAfter 6 hours and 12 hours of reperfusion,the expression of arginyl-tRNA synthetase is significantly elevated in rats with focal cerebral ischemia reperfusion,its mechanism is possibly related with the double damage of ischemia and reperfusion.
【Key words】Brain ischemia;Reperfusion injury;Arginyl-tRNA synthetase

