基因3型猪戊型肝炎病毒荧光定量RT-PCR检测方法的建立
陈小金,董志珍,赵祥平,王建华,刘 洋,王玉玲,陈本龙,肖 妍,王乃福,张俊哲(天津出入境检验检疫局动植物与食品检验中心,天津 300467)
基因3型猪戊型肝炎病毒荧光定量RT-PCR检测方法的建立
陈小金,董志珍,赵祥平,王建华,刘洋,王玉玲,陈本龙,肖妍,王乃福,张俊哲
(天津出入境检验检疫局动植物与食品检验中心,天津300467)
摘要:对GenBank中基因3型猪戊型肝炎病毒(HEV)代表毒株基因进行序列分析,最终选定ORF3基因的部分序列为目的基因,运用生物信息学软件设计特异性引物和探针,扩增获得目的片段,并构建重组载体pUC-19-ORF3。梯度稀释重组质粒制备标准品,初步建立检测基因3型HEV的实时荧光定量PCR方法。对建立的检测方法进行特异性、敏感性和重复性验证。结果表明,标准品浓度在108~102copies/μL范围内线性关系良好,相关系数为0.996。特异性试验结果显示,其它几种常见猪病病原体(猪流行性腹泻病毒、猪轮状病毒、猪传染性胃肠炎病毒、猪瘟病毒和猪繁殖与呼吸综合征病毒)未见典型扩增曲线。敏感性试验证实本方法的最低检测下限为101copies/μL。重复性试验表明该方法对3个标准品检测结果的批内和批间变异系数低于2%。用该方法抽检59份进境猪肉样品,同时用普通RT-PCR方法对这些样品进行符合性试验,结果均为阴性。本研究所建立的检测方法不仅适用于进境猪肉样品中基因3型HEV的监控检测,而且还可用于基因3型HEV的早期临床诊断及分子流行病学调查。
关键词:猪戊型肝炎病毒;TaqMan探针;荧光定量RT-PCR
戊型肝炎(Hepatitis E)由戊型肝炎病毒(Hepatitis E virus,HEV)引起,临床上主要表现为急性肝炎[1-2]。人感染后的病死率为1%~4%,孕妇病死率可达25%[1],戊型肝炎病毒主要通过粪-口途径、污染的水源,以及食用未煮熟的猪肉、野猪肉和鹿肉等制品传播。尽管HEV只有一个血清型,但具有高度的遗传多样性。目前普遍认可将HEV分为4个基因型:基因1型和2型主要感染人类,基因3型和4型可感染人和动物[3-4]。
自1997年首次分离到猪源HEV之后,在世界范围内的不同物种(野猪、猫鼬和鹿)体内都可检测到HEV。几乎所有发达国家的人和动物体内都已证实检测到基因3型HEV。屠宰场工人和兽医具有更高的血清阳性率[5]。鉴于目前HEV血清学检测结果,据估计全球人口的三分之一接触过该病毒[6]。基因3型和基因4型可以在除人外的灵长类和猪之间跨种传播[7]。
猪肉是HEV通过食源性途径传播的主要来源。目前,检测HEV的方法主要有免疫电镜、免疫荧光、血清中和试验、ELISA方法和聚合酶链式反应等。这些方法虽各有优点,但都不能满足特定要求。荧光定量PCR技术具有敏感性高、特异性好、高通量、操作简便省时等优点,同时可对待检样品进行精确定量,可用于批量样品中病原检测。从首次发现戊型肝炎病毒到现在,各国的研究者建立了多种HEV的检测方法,为HEV的深入研究提供了技术手段。我国的流行毒株主要为基因4型HEV,且现阶段关于HEV检测方法大部分是针对血清、粪便及肝脏样本,缺乏针对肉制品中基因3型的HEV快速准确敏感的检测方法。本研究旨在建立一种针对基因3型HEV的荧光定量RT-PCR检测方法,用于进境猪肉及其产品HEV的定量检测。该方法的建立将有助于进出境动物源性食品检验检疫体系进一步完善,进而保证食品安全和公共卫生安全。
1 材料与方法
1.1毒株、细胞系及临床病料
试验中使用的病毒株,如猪轮状病毒(Porcine rotsvirus,PoRV)、猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)、猪传染性胃肠炎病 毒(Transmissible gastroenteritis virus,TGEV)、猪瘟病毒(Classical swine fever virus,CSFV)、猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome viruse,PRRSV)均为疫苗毒。59份猪肉样品分别来自德国、西班牙、英国等,为2015年收集的欧盟国家进境猪肉样品。
1.2主要试剂及仪器
One Step PrimeScriptTMRT-PCR Kit、pUC19载体购自大连宝生物工程有限公司;Trizol IS购自Invitrogen公司;随机引物和 M-MLV反转录酶购于Promega公司;Axgen DNA Gel Extraction Kit 购自Axgen公司;PCR扩增仪购自伯乐生物有限公司;紫外分光光度计购自Thermo公司;金属恒温连接仪购自Eppendorf公司;Roche LightCycler 480 II荧光定量PCR仪购自罗氏公司。
1.3引物的设计与合成
参照GenBank登录的10株基因3型HEV代表毒株基因序列,将不同毒株的ORF3基因进行序列比对,筛选保守区域,并以其为靶基因设计特异性引物和探针,预期扩增目的片段长度分别为114 bp和140 bp。引物和探针均由北京擎科新业生物技术有限公司合成。试验设计的特异性引物和探针序列见表1。
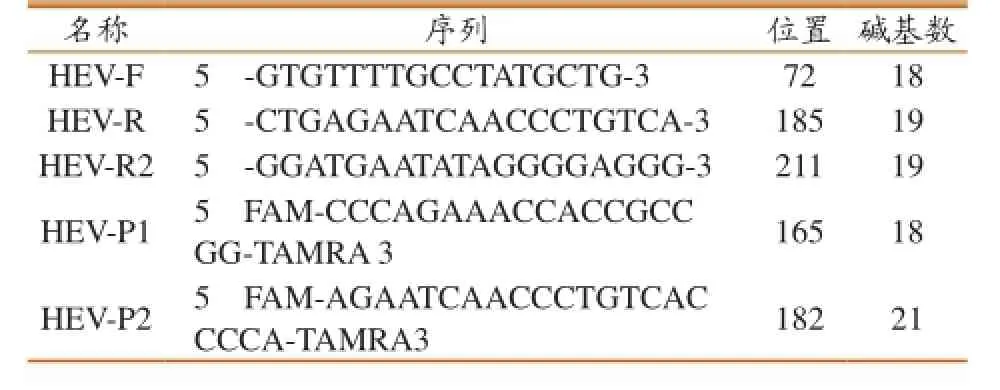
表1 引物和探针序列
1.4模板制备及病毒核酸的提取和反转录
实验所需模板由北京擎科新业生物技术有限公司合成。
取250 μL疫苗毒,加入750 μL Trizol IS混匀,室温静置5 min;向EP管中加入200 μL氯仿,漩涡震荡器上振荡混匀30 s,静置 10 min;之后将离心管置于4 ℃ 12 000 r/min 离心15 min,吸取上清,加入600 μL的异丙醇,置于-20 ℃冰箱30 min;4 ℃ 12 000 r/min离心10 min,弃掉上清,离心管中加新鲜配制的750 mL/L 乙醇1 mL,洗涤沉淀;4 ℃ 12 000 r/min离心5 min,弃上清,沉淀置于室温干燥5~10 min;以30 μL DEPC水溶解,获得RNA,-70 ℃保存备用。
1.5标准品的鉴定和制备
试验所需模板为人工合成。以合成的模板进行PCR反应,反应体系为25 µL,具体如下:10 PCR缓 冲 液 2.5 µL,2.5 mmol/L dNTP 2.0 µL,上、下游引物各(10 pmol/mL)1.0 µL,Ex Taq(5U/mL)0.2 µL,DNA模板2 µL,最后用灭菌去离子水补至25 µL。PCR反应条件为:94 ℃5 min;94 ℃ 30 s,58 ℃ 30 s, 72 ℃ 30 s,30个循环;72 ℃ 10 min。PCR产物经20 g/L琼脂糖凝胶电泳,用 Axgen DNA Gel Extraction Kit回收,将目的片段克隆到 pUC19载体,并转化大肠杆菌DH5-α中。摇菌筛选阳性质粒,提取质粒,并对重组阳性质粒PCR鉴定、测序,筛选基因序列正确的质粒作为标准品。用紫外分光光度计检测质粒浓度,根据公式换算质粒浓度到copies/µL,-20 ℃保存备用。
1.6荧光定量 PCR 反应条件的优化及标准曲线的建立
通过正交法对荧光定量PCR反应体系中的引物浓度、探针浓度和反应条件等进行筛选和优化,最终确定的反应体系为: buffer 10.0 μL,上、下游引物(10 pmol/mL)各1.0 μL,探针(2 pmol/mL)1.2 μL, 模 板1.0 μL,Taq酶 0.4μL,PrimeScript RT酶0.4 μL,加灭菌去离子水至总体积20 μL;最佳反应条件为42 ℃ 5 min;95 ℃ 10 s;95 ℃ 5 s,59 ℃ 30 s,40个循环。10倍梯度稀释质粒标准品pUC19-ORF3,以系列稀释的标准品为模板在LightCycler480II荧光定量PCR仪上进行检测,获得扩增动力学曲线,并依此绘制标准曲线。
1.7实时荧光定量PCR的特异性、敏感性和重复性评价
1.7.1特异性试验。分别提取PRRSV、CSFV、 TGEV、PEDV、PoRV的RNA,以最佳反应体系和最佳反应条件在罗氏LightCycler480II荧光定量PCR仪进行操作,试验过程中同时设立阴性和阳性对照。
1.7.2敏感性试验。梯度稀释已知浓度的重组质粒(108~100copies/μL),吸取1.0 µL不同浓度质粒作为模板,进行Real-time PCR,得出本研究所建立的检测方法所能检出的最低拷贝数。同时取上述相同体积质粒作为模板进行常规RT-PCR,以比较两种方法的敏感性。
1.7.3重复性试验。选取3个已知浓度标准品(106、105、104)作为批间和批内重复试验的模板,进行Real-time PCR,试验数据进行统计学分析。上述3个浓度标准品分别设立3个重复,在同一反应条件下同时检测,通过分析试验所得的Ct值,进而计算其批内变异系数;将上述3个浓度标准品置-20 ℃保存,每次间隔1周连续检测3次,通过分析试验所得的Ct值,计算其批间变异系数。
1.8样品的检测
将2015年的59份进境猪肉样品用液氮研磨,Trizol法提取样品RNA,以最佳反应体系和最佳反应条件进行Real-time RT-PCR检测。同时以上述样品的RNA作为模板,进行常规RT-PCR检测,比较这2种方法检测样品的符合率。
2 结果
2.1引物的特异性
以设计的两组特异性引物进行PCR 扩增, 分得到大小为114 bp和140 bp的目的片段,与预期相符(图1)。将获得的目的片段与载体pUC19 连接构建重组质粒,重组质粒pUC19-ORF3的测序结果显示,试验所扩增的目的片段与亲本HEV基因序列的一致性为100 % 。
2.2Real-time PCR 标准曲线的建立
根据试剂盒说明小量提取阳性重组质粒,并用紫外分光光度计测得质粒DNA的浓度为340 ng/ µL, 经过计算得出其拷贝数为 1.0 1011copies/µL,对该质粒进行10倍梯度稀释, 选择108~102copies/ µL 的质粒作为标准品。

图1 HEV引物特异性的PCR 鉴定
将质粒标准品依最佳反应条件进行Real-time PCR反应,结果呈现良好的线性关系。扩增曲线(图2)分析表明,曲线1、2、3、4、5、6、7、NTC分别为模板浓度108、107、106、105、104、103、102、101copies/µL的质粒标准品动力学曲线;质粒标准品从108~102copies/μL的Ct值分别 为 12.00、15.55、14.20、18.96、22.57、25.57、29.79 和 32.89。标准曲线(图3)分析表明,斜率为-3.491,x轴截距为39.930,直线方程为y = -3.491x + 39.930,相关系数(R2)为0.999,扩增效率为0.934。
2.3特异性
采用Real-time RT-PCR检测PoRV、PRRSV、CSFV、TGEV、PEDV的RNA, 结果均为阴性,其特异性扩增曲线见图4 。

图2 标准品的动力学曲线
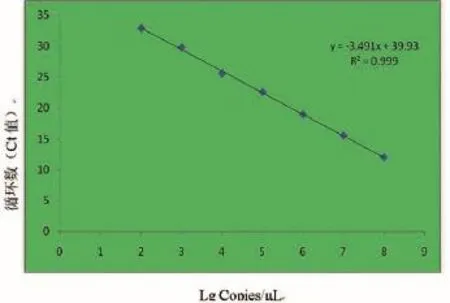
图3 标准曲线
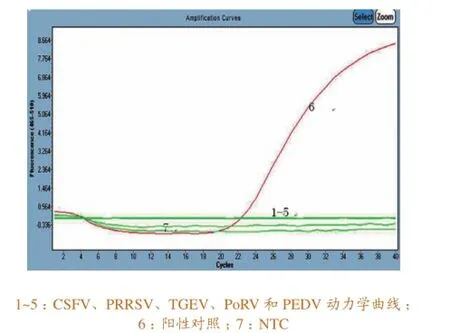
图4 特异性试验结果
2.4重复性
采用Real-time PCR 对106、105、104copies/ μL的标准品,分别进行批内重复试验及批间重复试验,批内变异系数分别为0.59%、0.20%、0.20%;批间变异系数分别为1.23%、0.87%、0.58%(表2)。以上结果表明3个不同浓度标准品作为模板进行Real-time PCR反应所得Ct值的批间和批内的变异系数均小于2%, 表明本研究所建立的方法具有很好的稳定性。
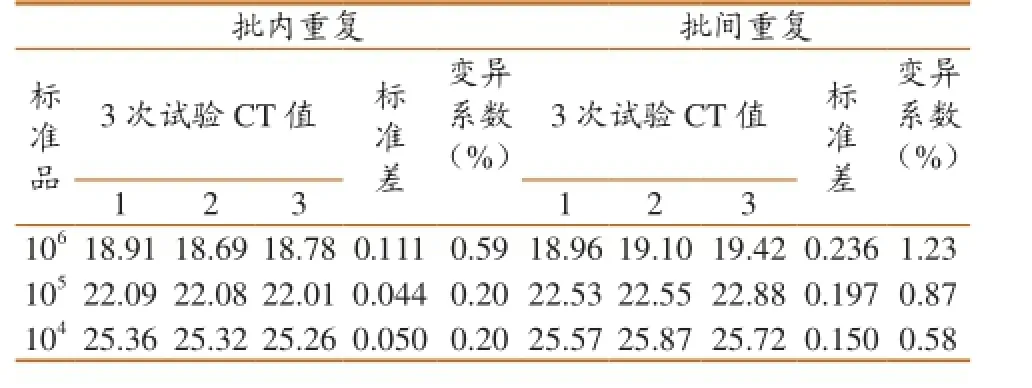
表2 HEV荧光定量PCR重复性试验数据分析
2.5敏感性
以 108~100copies/μL的质粒标准品为模板,每个浓度1.0 μL进行实时荧光定量RT-PCR和常规RT-PCR。Real-time RT-PCR对质粒标准品的检测下限为101copies/μL,而常规PCR的检测下限为103copies/ μL(表3),表明Real-time RT-PCR比常规RT-PCR敏感约100倍。

表3 HEV敏感性试验数据分析
2.6样品的检测
抽检来自英国、德国、西班牙等欧盟国家的猪肉样品61份,应用Real-time PCR、常规RT-PCR对病料进行检测。结果显示,在59份待检样品中,Real-time PCR检出0份阳性,常规RT-PCR 检出0份阳性。检测结果(表4)表明,本试验建立的实时荧光定量PCR与常规RT-PCR方法的符合率为100%。
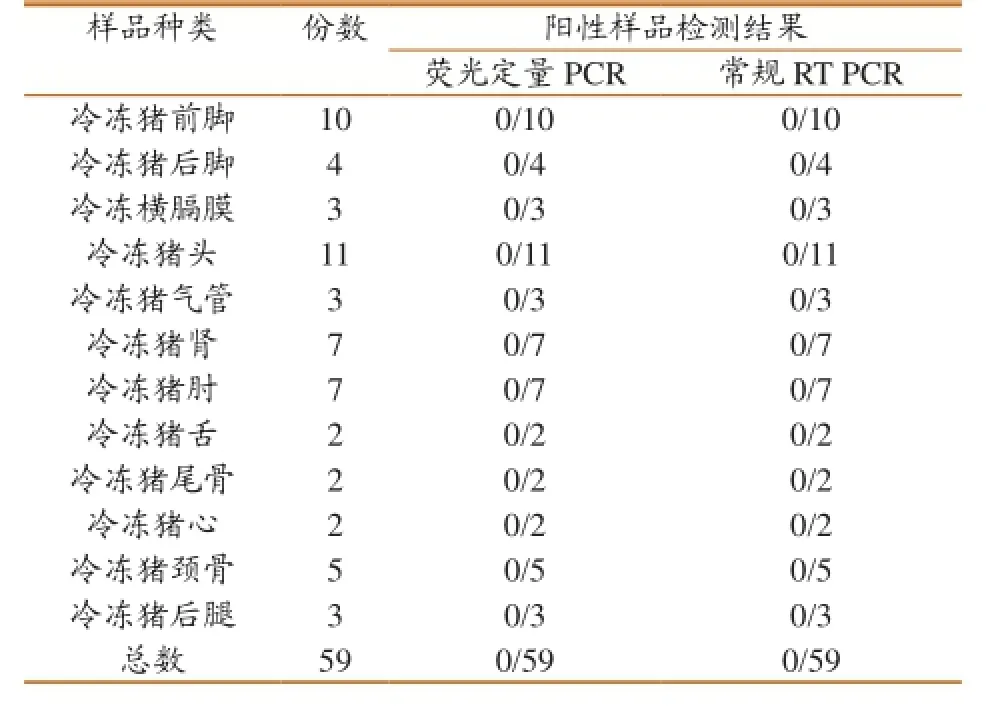
表4 样品检测结果
3 讨论
过去几年进行的流行病学和病毒学研究已清楚地表明,戊型肝炎是一种新出现的人畜共患病。猪是HEV主要动物宿主,由于其与全球猪肉食品链有较大的相关性,未来的公共健康问题备受关注。HEV可以通过食物传播。人类通过摄入具有感染性的肉制品从而感染HEV。在日本,对10例暴发性戊型肝炎患者风险因素和分子特征分析表明,这些患者发病前2~8周有食用烧烤或未煮熟的猪肝的历史,同时发现临床样本HEV RNA序列与市场上出售猪肝或农场猪样本中HEV基因序列相同或相似[8]。在猪肝或猪肉中确认有HEV的存在,且猪肝、肠中的HEV具有传染性,更加凸显了食用的实际风险。除了被感染的动物肉,被含有HEV猪粪、动物或人类排泄物污染的水灌溉土地,可能导致其他食品被污染,如径流流域和沿海流域的农产品或贝类[9],最终引起食用者发病,从而进一步提高公共卫生风险。欧洲国家学者的研究表明,目前欧洲的HEV流行毒株以基因3型为主,且猪为戊型肝炎病毒的主要宿主[10-11]。尤其值得注意的是,2014年底英国每日邮报报道称,在英国超市约四分之一的猪肉中检出HEV阳性,这对所有进口国的食品安全和公共卫生造成威胁。综上所述,加强猪戊型肝炎病毒的检测与监控是非常有必要的,建立快速准确的检测方法对于戊型肝炎的防控有重要意义。
荧光定量PCR具有灵敏度高、重复性好和准确定量等优点,同时荧光定量RT-PCR检测时间更短,检测结果的假阳性低,无需进行电泳从而减少实验室污染。荧光定量RT-PCR检测方法能够实现扩增与检测同步完成,操作更简便,被广泛应用于医学检测、病原体检测、病毒载量测定和食品卫生检疫等方面。通常情况下,对于序列差异比较大的基因片段,在进行目的片段扩增的过程中,可根据基因序列特点设计简并引物。简并引物中每个单独引物的有效浓度较低,难以估算简并引物的Tm值,同时对于简并引物中二级结构和因简并而引起的引物间相互作用也很难进行分析[12-13]。HEV基因组具有异质性,这一特性不仅体现在不同基因型之间,还体现在同一基因型不同毒株之间。HEV基因组中ORF2和ORF3基因的GC含量相对较高,这使得引物和探针设计比较困难。本试验过程中曾分别针对HEV的ORF2和ORF3基因设计特异性引物,也尝试过设计简并引物,筛选到ORF3上设计的两套引物,并依此设计两条特异性探针,最终确定最佳引物为HEV-F和HEV-R2,探针为HEV-P2。文中所建立的TaqMan荧光定量检测方法以ORF3的保守区为靶基因,无需使用简并引物或探针,灵敏度试验结果表明对基因3型猪HEV的检测下限可达10个拷贝,这比常规巢式PCR测定法的检测下限低[14]。
本研究的主要目的是建立猪肉及其制品中基因3型HEV的TaqMan 荧光定量RT-PCR检测方法。试验数据表明,本文建立的TaqMan荧光定量RTPCR测定法是一种可以用于检测进境猪肉样品中HEV的有效方法。但是由于目前收集的样品数量有限,目前尚未检出阳性样品。将来计划将该方法用于检测基因3型HEV动物临床样本,从而进一步验证其有效性。本研究为将来检测试剂盒的研制奠定了技术基础。同时该方法还可用于分子流行病学调查、病毒的致病机理和病毒在机体内的分布等方面的定量研究。
参考文献:
[1]Purcell R H,Emerson S U. Hepatitis E: an emerging awareness of an old disease[J]. J Hepatol, 2008,48(3):494-503.
[2]Meng X J. Recent advances in Hepatitis E virus [J]. J Viral Hepat,2010,17(3):153-161.
[3]Schlauder G G,Mushahwar I K. Genetic heterogeneity of hepatitis E virus[J]. J Med Virol. 2001,65(2):282-292.
[4]Wei H,Zhang J Q,Lu H Q,et al. Construction and screening of hepatitis E virus-specific phage antibody combinatorial library[J]. Journal of Cellular & Molecular Immunology,2003,19(5):473-472.
[5]Vulcano A,Angelucci M,Candelori E,et al. HEV prevalence in the general population and among workers at zoonotic risk in Latium Region [J]. Ann Ig.,2007,19(3):181-186.
[6]Colson P,Borentain P,Queyriaux B,et al. Pig liver sausage as a source of hepatitis E virus transmission to humans [J]. J Infect Dis.,2010,202(6):825-834.
[7]Pavio N,Meng X J,Renou C,et al. Zoonotic hepatitis E: animal reservoirs and emerging risks [J]. Vet Res.,2010,41(6):699-699.
[8]Yazaki Y,Mizuo H,Takahashi M,et al. Sporadic acute or
fulminant hepatitis E in Hokkaido, Japan, may be food-borne,as suggested by the presence of hepatitis E virus in pig liver as food.[J]. J Gen Virol.,2003,84:2351-2357.
[9] Craft J,Takeuchi Y,Dalton H R,et al. Hepatitis E virus genotype 3 in shellfish,United Kingdom.[J]. Emerg Infect Dis.,2012,18(12):2085-2087.
[10]Schlosser J,Eiden M,Vina-Rodriguez A,et al. Natural and experimental hepatitis E virus genotype 3-infection in European wild boar is transmissible to domestic pigs [J]. Vet Res.,2014,45(1):121-121.
[11]Berto A,Backer J A,Mesquita J R,et al. Prevalence and transmission of hepatitis E virus in domestic swine populations in different European countries [J]. BMC Research Notes,2012,5(1):1-6.
[12]Narayanan J,Lowther J A,Kathleen H,et al. Rapid and sensitive detection of noroviruses by using TaqMan-based one-step reverse transcription-PCR assays and application to naturally contaminated shellfish samples[J]. Appl Environ Microbio,2005,71(4):1870-1875.
[13]Stoecklein N H,Andreas E,Oleg S K,et al. SCOMP is superior to degenerated oligonucleotide primed-polymerase chain reaction for global amplification of minute amounts of DNA from microdissected archival tissue samples [J]. Am J Pathol,2002,161(1):43-51.
[14]Williams T P,Kasorndorkbua C,Halbur P G,et al. Evidence of extrahepatic sites of replication of the hepatitis E virus in a swine model [J]. J Clin Microbiol,2001,39(9):3040-3046.
(责任编辑:朱迪国)
Establishment of TaqMan Fluorescence Quantitative RT-PCR Assay for Swine Hepatitis E Virus Detection
Chen Xiaojin,Dong Zhizhen, Zhao Xiangping,Wang Jianhua,Liu Yang,Wang Yuling,CHen Benlong,Xiao Yan,Wang Naifu,Zhang Junzhe
(Animal and Plant and Foodstuffs Inspection Center,Tianjin Entry-Exit Inspection and Quarantine Bureau,Tianjin 300456)
Abstract:Primers and probe were designed based on the ORF3 gene sequences of genotype 3 Hepatitis E virus (HEV)available in GenBank. A recombinant plasmid pUC19-ORF3 containing the target gene was constructed as a standard control,then a real-time PCR assay for the detection of HEV was established. The specificity,sensitivity and reproducibility of the assay were evaluated and compared with conventional RT-PCR. Results showed that the real-time RT-PCR assay was highly specific with a broad linear detection range from 102copies/μL to 108copies/μL,and the correlation coefficient of the assay was 0.996. The sensitivity for HEV was 101copies/μL. The specificity analyses using cDNA of porcine reproductive and respiratory syndrome virus, classical swine fever virus,transmissible gastroenteritis virus of swine,porcine rotovirus and porcine epidemic diarrhea virus as the templates that the amplifications from these viruses were negative while the amplification from HEV were positive. Inter- and intra-assay variables of CV were less than 2%. 59 samples detected by the real-time PCR and RT-PCR were negtive with HEV. The coincidence of the realtime PCR was 100% with RT-PCR for the samples. The results showed that the method established in this study was suitable for detecting the genotype 3 HEV of imported pork samples. This assay also provided an effective method for rapidly diagnosis,vaccine quality control and molecular epidemiological investigation of HEV.
Key words:Hepatitis E virus of swine;TaqMan probe;fluorescence quantitative RT-PCR
中图分类号:S851.3
文献标识码:B
文章编号:1005-944X(2016)07-0072-06
DOI:10.3969/j.issn.1005-944X.2016.07.023

