不同地黄品种叶片中活性氧和抗氧化物质的差异研究
李玉华++赵奇++雷志华++邓培渊


摘要:以河南省焦作市武陟县主栽的地黄品种“金九”和航天搭载诱变后选育出的“HT-102”为材料进行大田试验,研究不同地黄品种叶片中活性氧和抗氧化物质的差异性。结果表明:相同生长期中,HT-102叶片中的活性氧(ROS)水平、抗氧化物质含量及SOD、POD抗氧化酶活性都显著高于金九,差异达显著水平(P<0.05);205 d时2个品种叶片中的ROS水平、抗氧化物质含量及抗氧化酶活性都显著高于155 d的样品,差异达显著水平(P<0.05);同一地黄品种叶片中ROS水平和抗氧化物质含量及抗氧化酶活性呈显著正相关。在205 d时,HT-102叶片干枯现象较金九严重。研究表明ROS水平、抗氧化物质含量及抗氧化酶活性高低可作为地黄栽培品种的特征之一,能作为地黄种质资源评价的一个指标,对于地黄品种的鉴定具有一定的应用价值。
关键词:地黄;活性氧;抗氧化物质;抗氧化酶;脯氨酸
中图分类号: S567.23+9.01文献标志码: A文章编号:1002-1302(2016)06-0377-04
收稿日期:2016-01-07
基金项目:河南省科技发展计划 (编号:132300410355)。
作者简介:李玉华(1980—),女,河南濮阳人,博士,讲师,主要从事植物生理生态和分子生物学方面的研究。E-mail:2010liyuhua@163.com。地黄[Rehmannia glutinosa(Gaertn.)Libosch.],玄参科地黄属多年生草本植物,可全草入药,但主要以块根入药,是我国一种大宗常用中药材。地黄的主要化学成分有环烯醚萜及其苷类、有机酸类、糖类和氨基酸等,地黄及其提取物具有调节免疫系统、降血糖、抗衰老、抗肿瘤功效,而且对造血系统、心血管系统、内分泌系统、中枢神经系统都具有一定的生理药理活性[1],而上述生理、药理活性均与地黄的抗氧化物质密切相关,所以抗氧化物质活性的测定对中药材地黄的质量评价有一定的指导意义。
许多研究表明,植物在生长过程中,细胞会通过多种途径产生超氧阴离子(O-2 · )、羟自由基(·OH)、单线态氧( · O2)和过氧化氢(H2O2) 等活性氧(reactive oxygen species,ROS),影响细胞的正常代谢。当植物生长受到干旱、盐渍、农药、病原菌等胁迫或衰老时,会诱导体内产生过量的ROS,在细胞内造成严重的氧化胁迫[2]。而且,研究还发现ROS及其诱导的氧化反应是导致生物衰老和人体多种疾病的主要起因之一[3]。ROS具有很高的化学反应活性,能氧化DNA、损伤蛋白质,且使脂质过氧化从而破坏细胞[4]。为了保护机体免受ROS的损害,植物在长期的进化过程中,细胞内形成了一套非常高效的非酶促/酶促抗氧化系统来清除ROS,从而减轻氧化胁迫对细胞的伤害和氧化还原状态的紊乱程度。非酶促抗氧化系统即抗氧化剂,包括谷胱甘肽(glutathione,GSH)和抗坏血酸(ascorbate,AsA)等[5-6]。酶促抗氧化系统即抗氧化酶,主要包括超氧化物歧化酶(superoxide dismutase,SOD)、过氧化物酶(peroxidase,POD)、过氧化氢酶(catalase,CAT)、抗坏血酸过氧化物酶(ascorbate peroxidase,APX)和谷胱甘肽还原酶(glutathione reductase,GR)[7]。至今,很多学者对地黄中主要的酚类、糖类、苷类等抗氧化物质进行了大量的研究工作[8-9],而关于不同品种地黄叶片中的ROS和酶促及非酶促抗氧化物质的研究较少。
地黄的品种很多,但由于自然环境和生产措施的影响,经有性杂交和块根变异,形成了很多地黄栽培品种及其变种,不同品种间质量也是参差不齐。金九(03-2)是河南省温县农业科学研究所采用杂交法经多年选育而成的产量高、品质好、综合抗性突出的地黄品种[10],现已成为当地的适优主栽品种。航天一号(HT-102)是地黄种子在2006年9月9日15:00 随“实践八号”育种卫星进入太空进行诱变,再经系统筛选、扩繁获得的高产品种[11]。本试验选用金九和 HT-102这 2个地黄品种,比较其叶片中ROS水平和抗氧化物质的差异,从抗氧化角度分析不同品种地黄对相同生长环境的适应性,为其抗性机理的研究提供参考,进而为地黄的栽培种植和品种选育提供理论依据。
1材料与方法
1.1材料
试验所用的金九和HT-102地黄品种购自河南省焦作市温县农业科学研究所,挑选长度为3~4 cm、直径相近、部位一致的地黄“种栽”(繁殖材料),于2014年4月20日种植于武陟农科种业公司地黄试验田中,株距约10 cm,行距约 30 cm。在同样环境的地块,采用同样栽培管理技术,用随机区组试验方法,重复3次。在地黄栽种后75 d (苗期)、155 d (膨大期)、205 d (收获期)分别选10株长势均匀的植株,采摘同一位置的功能叶片进行指标测试。
1.2测定项目和方法
O-2 · 含量采用羟胺氧化法[12]测定;H2O2含量用 H2O2-Ti(SO4)2 反应溶液比色法[13]测定;脯氨酸(Pro)含量采用茚三酮显色法[13]测定;还原型抗坏血酸(AsA)含量采用钼酸铵溶液比色法[12]测定;还原型谷胱甘肽(GSH)含量采用5,5′-二硫代-(2-硝基苯甲酸)溶液比色法[14]测定。SOD活性测定参照Stewart的方法[15],以SOD抑制氮蓝四唑光还原50%酶量作为1个酶活力单位(U);CAT活性测定参照Abassi等的方法[16];POD 活性测定用愈创木酚比色法[17],以 1 min 内D470 nm变化0.01为1个POD活性单位(U);APX活性测定参照Nakano等的方法[18];GR 活性测定参照Foyer等的方法[19]。酶提取液中总蛋白浓度用Bradford的方法[20]测得。
1.3数据分析
试验3次重复,所有的数据用SPSS 20.0进行统计分析和显著性检验。
2结果与分析
2.1金九和HT-102叶片中ROS含量的差异
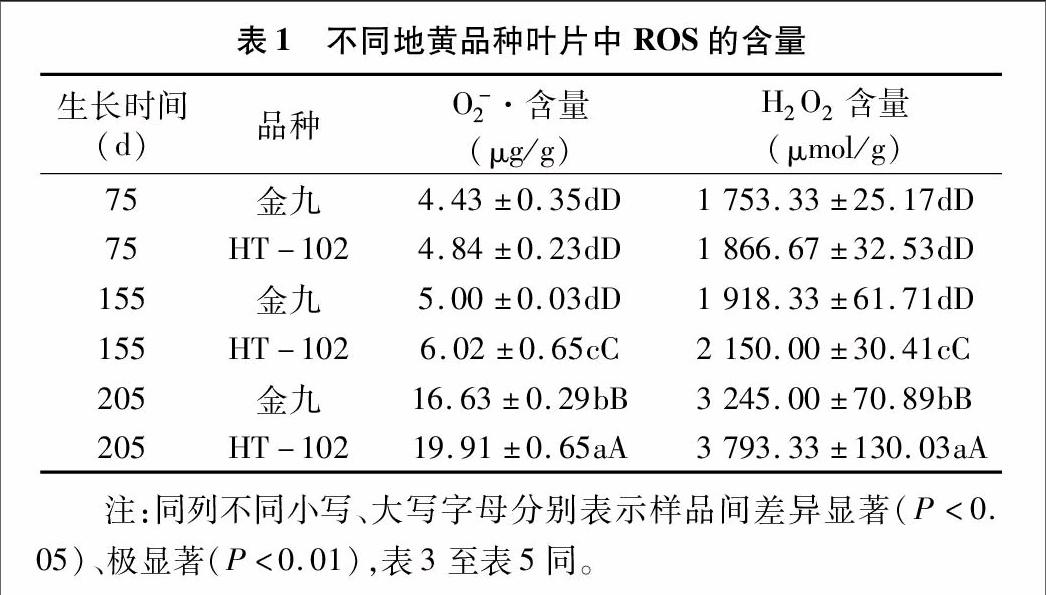
植物在线粒体中进行有氧呼吸和叶绿体中进行光合电子传递过程中,都会产生 O-2 · 。O-2 · 是活性氧的一种,是生物体内生理生化反应的中间产物,能促进脂肪氧化,促使生物体衰老。由表1可知:2种地黄叶片中O-2 · 的含量都随着生长发育期的推进而升高,且在相同生长期内,HT-102叶片中的O-2 · 含量都较金九高。金九叶片中O-2 · 的含量,在生长期 155 d 和75 d时差异不显著;但O-2 · 的含量在205 d时比 155 d 时升高了2.33倍,差异达到极显著。HT-102叶片中O-2 · 的含量,在155 d时比75 d时升高了24.4%,在205 d时比在155 d时升高了2.31倍,差异达到极显著。而且,在 205 d 时,HT-102叶片中O-2 · 的含量比金九高19.7%,差异也达到极显著。
H2O2并不是一种很活跃的ROS,但有时它却可引发 ·OH 的产生而对细胞产生毒性。由表1可知:金九叶片中H2O2含量在205 d时比155 d时升高了69.2%,差异达到极显著;HT-102叶片中H2O2含量在205 d时比155 d时升高了76.4%,差异也达到极显著。HT-102和金九叶片中H2O2含量在75 d时与155 d时差异不显著,但到收获期205 d时,H2O2含量与155 d时相比,差异已达到极显著水平,且HT-102比金九叶片中H2O2 含量高16.9%。由表2可知,随着地黄生长发育进程的推进,逐渐升高的ROS含量也会激活地黄细胞内的抗氧化防御系统。
2.2金九和HT-102叶片中抗氧化物质含量的差异
AsA和GSH是2个重要的防御氧化胁迫的非酶复合物[21],它们能够缓和生物体内的多种氧化应激,保护组织细胞免受内源性ROS的损伤。由表3可知:AsA和GSH的含量在2种地黄叶片中呈现相似的变化趋势,随着生长期的推进,AsA的含量升高更显著。金九叶片中AsA含量在205 d时比155 d时升高了189.0%,HT-102叶片中AsA含量在205 d时比155 d时升高了141.2%,差异达到极显著水平;且在205 d时,HT-102叶片中AsA含量比金九高 32.8%。而对于GSH的水平,金九在205 d时比155 d时升高了26.1%,在155 d 时比75 d时升高了23.9%,差异达到显著水平。但对于HT-102来说,其叶片中GSH水平在205 d时比155 d只上升了9.6%,差异不显著;而在155 d时比75 d时升高了37.0%,差异达到极显著水平。
在逆境(旱、热、盐碱、冷、冻等)条件下,许多植物体内Pro大量积累。积累的Pro作为细胞质内的渗透调节物质,还能稳定蛋白的结构、维持酶的活性、降低细胞酸性以及调节细胞的氧化还原势等[22]。Pro能作为单态氧的淬灭剂和·OH的清除剂,所以它在植物的抗衰老过程中也起着重要的作用。由表3可知:金九Pro水平在205 d时比155 d时升高了 94.4%,HT-102的Pro水平在205 d时比155 d时升高了81.0%。而且,HT-102比金九叶片中Pro含量在205 d时和155 d时都高,差异达到极显著;这也说明:在地黄生长发育后期,HT-102比金九叶片中产生了更多的ROS。因此,HT-102叶片中积累较多的Pro来提高代谢能力。在生长过程中,HT-102和金九2个地黄品种出苗率之间没有明显差异,但到了生长末期,HT-102和金九相比,叶片干枯和死苗现象严重很多。
2.3金九和HT-102叶片中抗氧化酶活性的差异
由表4可见,SOD、POD和CAT 活性在2种地黄叶片中都随着生长发育期的推进而升高。对SOD活性来说,金九叶片在205 d时和155 d时相比上升了72.3%,HT-102叶片在205 d时和155 d时相比上升了77.6%。而且,HT-102叶片中SOD活性在205 d、155 d和75 d时都比金九高,差异达到极显著。POD活性和SOD活性有相似的变化趋势,但2种地黄叶片中POD的活性增强较SOD剧烈。POD活性显著增强表现在:金九叶片在205 d时比155 d时升高了6.78倍,HT-102叶片在205 d时比155 d时升高了4.67倍,差异都达到极显著水平。然而,CAT活性整体上与SOD和POD却表现出不同的变化特性。在2种地黄叶片中,CAT活性在205 d、155 d和75 d时差异都达到极显著水平。但是在205 d时,金九叶片中CAT活性却比HT-102的高。这很可能是地黄在衰老过程中,HT-102叶片中积累了更多的ROS,从而造成了对生物大分子蛋白质、酶等更严重的损伤,损伤导致了蛋白质解离、酶变性失活,这也和表1的结果相吻合。
由表5可见,APX和GR 2种酶活性在金九和HT-102地黄生长发育过程中,整体上表现出相同的变化趋势,而且在生长的75 d、155 d和205 d时差异都达到极显著水平。GR活性变化具体表现在:金九叶片在155 d时比75 d时升高了1.56倍,在205 d时比155 d时升高了73.91%;HT-102叶片在155 d时比75 d时升高了1.25倍,205 d时比155 d时升高了37.04%,差异都达到极显著水平。对于APX活性来说,金九叶片在155 d时比75 d时升高了76.19%,在205 d时比155 d时升高了1.31倍;HT-102叶片在155 d时比 75 d 时升高了93.71%,205 d时比155 d时升高了75.45%。而且,在205 d收获期时,金九叶片中GR和APX活性都比HT-102的高。这也很可能是地黄在衰老过程中,HT-102叶片中积累了更多的ROS,从而造成了GR和APX酶变性失活。这也和表1的结果相符合。
3讨论与结论
近年来,很多研究表明植物叶片的衰老与ROS引起的损伤有关。地黄在生长发育过程中,会产生一定量的ROS,而且,随着生长发育期的推进,直到衰老期,产生过量的ROS远远超出了其自身抗氧化系统的清除能力。本研究中,2个品种地黄在收获期叶片中积累了很高水平的 O-2 · 和H2O2,且HT-102 叶片中 O-2 · 和H2O2 水平都高于金九。这些ROS在细胞内会引起一系列反应,如膜损伤、细胞器功能破坏、代谢反应减缓、电解质渗漏等,最终导致细胞死亡。而且,在生长后期,HT-102 植株叶片的干枯现象较金九严重,这很可能和HT-102 叶片中ROS水平较高有关。
己证实地黄叶片具有很强的抗氧化活性[23]。SOD的主要功能是催化 O-2 · 发生歧化反应,生成H2O2和O2,从而消除 O-2 · 对细胞的损害[24]。正常情况下,SOD活性稳定,植物产生和消除 O-2 · 的能力处于动态平衡。但当植物衰老或遇到逆境时,体内 O-2 · 水平升高,SOD的活性也上升[25],从而对植物起到保护作用。另外,SOD活性强,也间接说明了叶片细胞内具有高水平的 O-2 · ,本研究中对 O-2 · 的直接测定也证明了这一点(表1)。SOD虽然可以清除 O-2 · ,但同时又有H2O2 的形成。植物体中H2O2 的清除需要依赖CAT和POD这2种保护酶的共同作用。细胞中高浓度的H2O2 主要靠CAT清除,从而尽可能使H2O2 控制在较低水平[26]。但是,在各种逆境胁迫或者植物体衰老的条件下,过多的H2O2 积累会造成CAT 活性下降甚至变性失活已被大多数的研究所证实。本研究中HT-102 地黄在衰老期叶片中较高的H2O2 水平和较低的CAT活性,与沈文飚、祁春苗等人的研究结果[27-28]一致。本研究中,POD活性在地黄衰老期大大升高,一方面要清除细胞内的H2O2,另一方面可能它参与了叶绿素的降解[29]、活性氧的产生,并引发膜脂过氧化,是植物衰老到一定阶段的产物。HT-102 叶片中较高的POD活性也说明它较金九更早进入了衰老期,叶片膜脂过氧化更严重。
APX和GR是AsA-GSH循环中清除H2O2的关键酶。APX通过把AsA转变成脱氢抗坏血酸而清除 H2O2,AsA的再生由依赖GSH的脱氢抗坏血酸还原酶催化[30]。本研究中,APX和GR活性在2种地黄叶片中都随着生长发育过程的推进而升高(表5),这些酶活性的升高也导致了AsA和GSH的积累(表3)。因为在地黄生长过程中,为了防治黄斑病、轮纹病、枯萎病及其他常见的病毒病而喷施多种农药后,在一定时期内对地黄叶片造成伤害。以上抗氧化酶活性升高,是为了减轻病害、农药及衰老等因素对地黄细胞的伤害。抗氧化酶活性的升高可能是植物体内新合成或激活了编码这些抗氧化酶基因的转录和翻译[31],进而增强了地黄的抗性。但是,在地黄生长末期,叶绿素的降解快于合成、叶片逐渐黄化、RNA水解、蛋白质也迅速降解,ROS水平超出防御机制所受范围,细胞处于氧化胁迫状态,进而会引发脂质过氧化、蛋白质氧化以及酶失活,最终激活程序性细胞死亡。HT-102 地黄叶片中高水平的 O-2 · 和H2O2 与其叶片出现黄化现象较早以及后期叶片干枯现象更严重有直接的关系。
总之,地黄不同品种ROS和抗氧化物质的差别反映了地黄种质资源在抵抗外界胁迫和适应环境方面的遗传多样性。ROS含量高无疑不利于光合产物的积累和次生代谢产物的合成[32-33],但不同品种产量的高低除与抗氧化物质水平高低有关外,还与其他遗传因素和栽培条件有关。叶片早衰是影响地黄和其他农作物产量和品质的重要因素之一,因此ROS和抗氧化物质含量的高低只是地黄栽培育种的参考指标之一。本研究为今后揭示地黄衰老的分子机制,以及在生产实践中延缓地黄的衰老进程,并进一步提高地黄的产量和品质具有重要的理论价值。
参考文献:
[1]王太霞. 怀地黄块根的发育与有效成分的积累关系及其道地性形成机制的研究[D]. 西安:西北大学,2004:14-17.
[2]张怡,路铁刚. 植物中的活性氧研究概述[J]. 生物技术进展,2011,1(4):242-248.
[3]于震,周红艳,王军. 地黄药理作用研究进展[J]. 中医研究,2001,14(1):43-45.
[4]Valko M,Morris H,Cronin M M. Toxicity and oxidative stress[J]. Current Medicinal Chemistry,2005,12(10):1161-1208.
[5]庞杰,郝丽珍,张凤兰,等. 沙芥叶片活性氧和抗坏血酸对干旱胁迫的响应[J]. 植物生理学报,2013,49(1):57-62.
[6]Vertuani S,Angusti A,Manfredini S. The antioxidants and pro-antioxidants network:an overview[J]. Current Pharmaceutical Design,2004,10(14):1677-1694.
[7]王玉,孔凡英,尹波,等. 过表达单脱氢抗坏血酸还原酶基因提高番茄抗UV-B胁迫能力[J]. 植物生理学报,2014,50(1):95-104.
[8]郭丽娜,白皎,裴月湖. 生地黄化学成分的分离与鉴定[J]. 沈阳药科大学学报,2013,30(7):506-508,542.
[9]张艳丽,冯志毅,郑晓珂,等. 地黄叶的化学成分研究[J]. 中国药学杂志,2014,49(1):15-21.
[10]路翠红,赵正伟,王天亮,等. 地黄新品种金九(03-2)的选育及栽培要点[J]. 农业科技通讯,2012(10):164-165.
[11]王凤娟. 怀地黄航天诱变后生物学效应及新种质的选育[D]. 新乡:河南师范大学,2009:2-3.
[12]高俊凤. 植物生理学实验指导[M]. 北京:高等教育出版社,2006:221-223.
[13]张蜀秋. 植物生理学实验技术教程[M]. 北京:科学出版社,2011:197-198.
[14]苍晶,赵会杰. 植物生理学实验教程[M]. 北京:高等教育出版社,2013:160-162.
[15]Stewart C R. The mechanism of abscisic acid-induced proline accumulation in barley leaves[J]. Plant Physiology,1980,66(2):230-233.
[16]Abassi N A,Kushad M M,Endress A G. Active oxygen scavenging enzymes activities in developing apple flowers and fruits[J]. Sci Hortic,1998,74(3):183-194.
[17]李玲. 植物生理学模块实验指导[M]. 北京:科学出版社,2009:97-98.
[18]Nakano Y,Asada K. Hydrogen-peroxide is scavenged by ascorbate-specific peroxidase in spina-chloroplasts[J]. Plant and Cell Physiology,1981,22(5):867-880.
[19]Foyer C H,Halliwell B. The presence of glutathione and glutathione reductase in chloroplasts:a proposed role in ascorbic acid metabolism[J]. Planta,1976,133(1):21-25.
[20]Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry,1976,72(1/2):248-254.
[21]Shan C J,Liang Z S. Jasmonic acid regulates ascorbate and glutathione metabolism in Agropyron cristatum leaves under water stress[J]. Plant Science,2010,178(2):130-139.
[22]Nanjo T,Kobayashi M,Yoshiba Y,et al. Biological functions of proline in morphogenesis and osmotolerance revealed in antisense transgenic Arabidopsis thaliana[J]. The Plant Journal,1999,18(2):185-193.
[23]朴仁哲,赵洪颜,金玉姬,等. 百草枯胁迫对地黄和苘麻膜脂过氧化及抗氧化酶活性的影响[J]. 江苏农业科学,2008(3):271-274.
[24]童富淡,胡家恕,陈进红,等. 不同育秧方式对早稻叶片SOD活性、电解质渗透率和发根力的影响[J]. 浙江农业大学学报,1997,23(6):74-78.
[25]Youngman R J,Dpdge A D. On the mechanism of paraguat resistance in Conyza sp.[C]. Photosynthesis and productivity,1981:537-544.
[26]潘瑞炽. 茉莉酸甲酯对水分胁迫下花生幼苗SOD活性和膜脂过氧化作用的影响[J]. 花生科技,1996,21(4):34.
[27]沈文飚,叶茂炳,徐朗莱,等. 小麦旗叶自然衰老过程中清除活性氧能力的变化[J]. 植物学报,1997,39(7):634-640.
[28]祁春苗,赵会杰,张秀月. 氯化胆碱对干旱胁迫下地黄抗氧化代谢及梓醇含量的影响[J]. 水土保持学报,2007,21(4):159-163.
[29]曾韶西,王以柔,刘鸿先. 低温光照下与叶绿素降解有关酶促反应[J]. 植物生理学报,1991,17(2):177-182.
[30]Zhang J X,Kirkham M B. Enzymatic responses of the ascorbate-glutathione cycle to drought in sorghum and sunflower plants[J]. Plant Science,1996,113(95):139-147.
[31]Ali B,Hasan S A,Hayat S,et al. A role for brassinosteroids in the amelioration of aluminium stress through antioxidant system in mung bean [Vigna radiata (L.) Wilczek][J]. Environmental and Experimental Botany,2008,62(2):153-159.
[32]张永福,黄鹤平,银立新,等. 冷(热)激对干旱胁迫下玉米活性氧清除及膜脂过氧化的调控机制[J],江苏农业科学,2015,43(5):56-60.
[33]邓琳琼,赵菲菲,张以忠. 细野荞水提液清除活性氧的效果[J]. 江苏农业科学,2014,42(8):298-300.

