穿心莲水提取物联合抗菌药对含fosA3大肠杆菌的作用
吴永继++宋剑武++孙燕杰++刘增援++黄凯++司红彬


摘要:研究穿心莲水提取物与抗菌药联合诱导细菌传代的体外抑菌活性。对临床分离的细菌进行鉴定,确定细菌所含耐药基因种类,用牛津杯法测定穿心莲水提取物的抑菌活性和平板涂布法测定穿心莲水提取物的杀菌活性,采用二倍微量稀释法体外检测穿心莲水提取物与抗菌药的最小抑菌浓度(MIC),穿心莲水提取物与抗菌药联合诱导含fosA3型大肠杆菌细菌传代。研究结果,分离到fosA3型耐药基因大肠杆菌;穿心莲水提取物的MIC为1 g/mL,穿心莲水提取物与抗菌药联用后,可明显地增强头孢菌素类、青霉素类、氟喹诺酮类、喹啉类、磺胺类、氨基糖苷类、酰胺醇类和磷霉素对耐药菌的抑制作用。结果表明,穿心莲水提取物对含fosA3大肠杆菌有一定的抑菌活性和杀菌活性,与部分抗菌药联合应用后,抗菌药体外抗菌活性显著增强。
关键词:穿心莲水提取物;含fosA3大肠杆菌;联合诱导;最小抑菌浓度(MIC)
中图分类号: S853.74文献标志码: A文章编号:1002-1302(2016)06-0348-03
收稿日期:2015-05-05
基金项目:国家自然科学基金(编号:31460675);国家科技支撑计划(编号:2012BAD25B04);广西科技攻关(编号:0992014-2);广西自然科学基金(编号:2012GXNSFBA053052、2013GXNSFAA019070);广西南宁市科技攻关(编号:20141295);广西大学兽医一级学科博士启动基金(编号:2012GXNSFBA053052);广西高校优势特色专业建设项目。
作者简介:吴永继(1991—),女,河南驻马店人,硕士,主要从事中兽药研究。 E-mail:wyjalisa@163.com。
通信作者:司红彬,博士,副教授,主要从事细菌耐药性研究。E-mail:zhuli_2009@163.com。穿心莲(Andrographis paniculata)是中国民间常用中药,是一种具有广泛应用开发前景的植物资源,具有解热[1]、抗炎[2]、抗病毒感染[3]、免疫调节作用[4]、治疗心血管疾病[5]、抗癌[6-8]、治疗消化系统疾病[9]及抗生育[10]等作用,临床应用于肠道感染、呼吸道感染、皮肤疾病等[11]以及急性菌痢、胃肠炎、感冒发热、高血压等心血管疾病的治疗。研究结果表明,穿心莲具有很好的体外抗菌活性,对大肠杆菌、金黄色葡萄球菌、绿脓杆菌、甲型链球菌、乙型链球菌均有明显的抑菌作用[12]。磷霉素是一种广谱抗菌药,对常见革兰氏阳性菌和阴性菌均具有抗菌活性,与其他抗菌药无交叉耐药性,并与多种抗菌药联合应用时呈协同作用。近年研究发现,应用磷霉素治疗各类尿路感染仍然高度有效,且细菌耐药率低。近年来,随着产ESBLs(Extended Spectrum β-Lactamases)细菌的流行,质粒介导的耐磷霉素基因fosA3(fosfomycin resistance gene)[13]的发现,且fosA3为产ESBLs肠杆菌科细菌中常见的Fos基因类型,fosA3基因常与ESBLs基因共同转移,这可能会造成不同耐药的共同传播。这将对畜牧养殖业和公共卫生安全产生巨大的威胁。目前,抗菌药的研发速度缓慢,远远赶不上细菌耐药性产生的速度,这些耐药基因可以在菌株间以质粒介导的形式传播,甚至能够通过直接与人体接触传播或者间接地通过食物链向人体进行传递,这将给人类安全及养殖业带来很大的危害。因此,找到一种可以延缓耐药性产生或逆转病原菌耐药性的药物显得尤为重要。目前,对含fosA3型耐药基因细菌方面的联合用药,尤其是中药成分与抗菌药联合作用鲜见研究报道。本试验旨在探究穿心莲水提取物联合抗菌药对含耐fosA3型大肠杆菌的体外抑菌作用。为减少细菌对临床常用抗菌药的耐药性和对穿心莲的进一步开发利用提供一定的理论基础。
1材料与方法
1.1材料
穿心莲购自广西万丰药业有限公司,批号20111206;牛肉膏蛋白胨、牛津杯、MH肉汤、LB肉汤、MH 琼脂、普通琼脂、麦康凯琼脂、牛肉膏蛋白胨、伊红美蓝琼脂、营养肉汤、生化试剂均购自杭州天和微生物试剂有限公司;Taq酶、dNTP、10×PCR buffer、引物、琼脂糖均购自上海生工生物工程有限公司;抗菌药:头孢曲松钠、阿莫西林、诺氟沙星、黏杆菌素、痢菌净、磺胺间甲氧嘧啶、阿米卡星、头孢他啶、头孢噻呋钠、氟苯尼考、磷霉素,均在有效期范围内。
1.2菌株分离鉴定
病原菌的分离培养从猪场采集患病猪的肠道病料,将其浸入灭菌生理盐水,充分洗脱,将其悬浮液接种于普通平板,37 ℃ 培养18~24 h,挑取可疑菌落接种到麦康凯琼脂和伊红美蓝琼脂平板进行培养。依据标准[14-15 ]对所分离菌株进行糖发酵管试验、吲哚试验、MR试验、V-P试验、枸橼酸钠利用试验。
1.3fosA3基因的检测
1.3.1引物设计与合成参照GenBank中登录的fosA3基因序列JX442754.1,设计fosA3引物,引物序列为:FosA3-F:5′-GCGTCAAGCCTGGCATTT-3′;FosA3-R:3′-GCCGTCAGGGTCGAGAAA-5′。引物由上海生物工程有限公司合成,fosA3型产物扩增长度为250 bp左右。
1.3.2PCR扩增PCR反应体系50 μL [16]:Taq酶0.5 μL,dNTP 4 μL,10×PCR Buffer 5 μL,模板2 μL,上、下游引物各2 μL,去离子水34.5 μL。PCR反应条件:94 ℃预变性3 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃ 延伸1 min,30个循环;72 ℃终延伸10 min。PCR扩增产物经1.0%琼脂糖凝胶电泳,溴化乙锭染色,紫外投射仪下观察结果并用凝胶成像系统摄像。
1.4穿心莲水提取物制备
称取中药200 g,用蒸馏水清洗、浸泡12 h后煎煮,第1次加蒸馏水2 000 mL,加热至沸腾改为文火,保持沸腾状态煎煮60 min,过滤后得到第1次滤液。用相同方法继续煎煮,第2次加水量为1 600 mL,第3次加水量为800 mL,分别得到第2、第3次滤液。合并3次滤液,加热蒸发浓缩到200 mL,此时中药浓度为1 g/mL。药液经高压灭菌后-20 ℃保存备用。
1.5制备菌悬液
将纯化好的含fosA3大肠杆菌接种到MH肉汤培养基中,37 ℃恒温培养箱中培养24 h,取出已培养好的大肠杆菌菌液,调节菌液浓度为107 CFU/mL。
1.6穿心莲水提取物对含fosA3细菌抑菌活性和杀菌活性试验
1.6.1穿心莲水提取物对含fosA3基因细菌抑菌活性试验采用牛津杯法[17]检测穿心莲水提取物对含fosA3细菌抑菌活性。首先在培养皿内倒入15 mL牛肉膏蛋白胨琼脂培养基,凝固后,将含有0.2 mL配好的含fosA3细菌菌悬液的牛肉膏蛋白胨半固体培养基5 mL均匀倒入平板中。待彻底凝固后,在培养基上平均布置无菌牛津杯,1 min后,向其中加入 1 g/mL 的穿心莲水提取物50 μL。置于37 ℃恒温箱中培养24 h后,用直尺测定抑菌圈直径。
1.6.2穿心莲水提取物对含fosA3基因细菌杀菌活性试验采用平板涂布法[18]测定穿心莲水提取物对含fosA3细菌的杀菌活性。细菌经活化培养后接种到MH肉汤,37 ℃恒温箱中培养18 h。然后将菌液稀释至浓度为107 CFU/mL的菌悬液,取此菌液6 mL,加入穿心莲水提取物使其终浓度为 0.5 g/mL,37 ℃恒温箱中培养,分别在2、6、8、10、12、16、24 h取菌液,经适当稀释后涂布在MH琼脂培养基平板上,37 ℃恒温箱中倒置培养24 h后计平板上菌落个数。以菌液不加药为对照组,试验重复3次,取平均值。杀菌率计算:杀菌率=(对照组-穿心莲水提物组)/对照组×100 %。
1.7穿心莲水提取物和抗菌药最小抑菌浓度(MIC)检测
参照美国临床和实验室标准协会CLSI推荐的方法和结果判定标准[19],采用微量稀释法测定各受试药对细菌的最小抑菌浓度值,具体操作参照NCCLS抗菌药敏感性试验操作标准[20]。细菌经活化后,培养至生长对数期,将其稀释至浓度为107 CFU/mL菌悬液。取100 μL于微量药敏反应板的第1孔内,之后每孔加入100 μL至第12孔,在第1孔加入100 μL药液,混匀后吸取100 μL至第2孔,依次稀释混匀至第11孔,第11孔混匀后弃去100 μL,第12孔不加药作为空白对照,加盖于37 ℃恒温箱内培养18~24 h。
1.8穿心莲水提取物联合抗菌药诱导细菌传代
用亚抑菌浓度1/2 MIC值穿心莲水提取物联合抗菌药诱导耐药菌传代培养,并观察穿心莲水提取物作用前后的MIC变化,以便判断穿心莲水提取物对各抗菌药作用细菌的效果,同时设1/2 MIC浓度的穿心莲水提取物对照。
2结果与分析
2.1细菌鉴定结果
病原菌培养24 h后,在麦康凯琼脂培养基上为粉红色(图1)、边缘整齐的菌落;伊红美蓝琼脂平板上生长为光滑边缘整齐、黑色并有金属光泽的小菌落。从麦康凯琼脂培养基上挑取典型菌落,接种于普通琼脂培养基上,培养24 h后可见灰白色隆起、湿润、光滑、直径1~3 mm的菌落。
将纯化后的细菌分别接种到系列生化培养基,结果发现,该分离菌能分解葡萄糖、乳酸、甘露醇、麦芽糖,产酸产气;不分解肌醇和尿素;不产生H2S;MR试验阳性;V.P.试验阴性;枸橼酸钠利用试验阴性;不液化明胶:初步鉴定为大肠杆菌。
2.2PCR检测结果
经1%琼脂糖凝胶电泳结果显示,fosA3型产物扩增长度约250 bp(图2),由上海生工生物有限公司测序,结果表明,该序列长度为258 bp,该菌为含fosA3基因的大肠杆菌。
2.3穿心莲水提取物对含fosA3基因细菌抑菌活性和杀菌活性
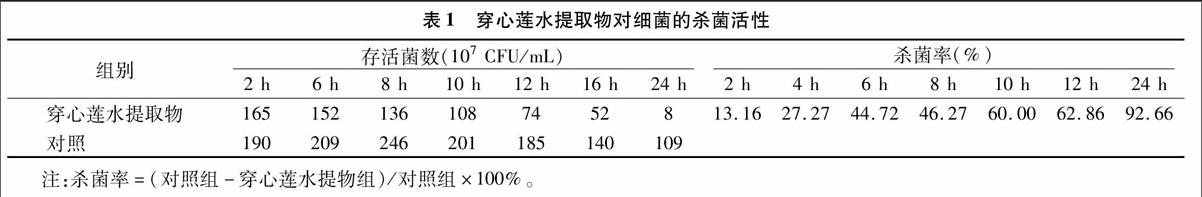
研究结果显示,穿心莲水提取物对含fosA3基因大肠杆菌有较强的抑菌活性,当穿心莲水提取物浓度为1 g/mL时,其抑菌圈直径为13 mm,说明穿心莲水提取物对含fosA3大肠杆菌有较强抑菌活性。从表1可以看出,穿心莲水提取物对含fosA3大肠杆菌有较强杀菌作用,0.5 g/mL穿心莲水提取物在12、16 h可以使含fosA3大肠杆菌的存活菌数由 109 CFU/mL 降低至108 CFU/mL,24 h时,存活菌数下降到107 CFU/mL, 其杀菌率随着穿心莲水提取物的作用时间的增加而提高,当穿心莲水提取物作用24 h时,穿心莲水提取物对含fosA3大肠杆菌的杀菌率为92.66%。
2.4单药及联合传代结果
从表2可以看出,单独使用多种抗菌药MIC值均较大,说明含fosA3型大肠杆菌对多种抗菌药不敏感,已经产生很强的耐药性;而中西联合传代作用后的MIC值普遍减小,头孢曲松钠、阿莫西林、诺氟沙星、黏杆菌素、痢菌净、磺胺间甲氧嘧啶、阿米卡星、头孢他啶、头孢噻呋钠、氟苯尼考、磷霉素均从第1代就开始变小。亚抑菌浓度(1/2MIC=0.5 g/mL)穿心莲水提取物培养基传代引起含fosA3大肠杆菌抗菌药MIC的变化。结果表明,穿心莲水提取物与头孢菌素类、青霉素类、氟喹诺酮类、喹啉类、磺胺类、氨基糖苷类、酰胺醇类和磷霉素等抗菌药联合诱导传代后MIC显著降低,可判断穿心莲水提取物与这些抗菌药联合应用对含fosA3耐药基因大肠杆菌具有明显抑菌作用。
3讨论
本试验采用微生物学常用的牛津杯法检测了穿心莲水提取物对含fosA3大肠杆菌的抑菌活性,试验结果,穿心莲水提取物对含fosA3大肠杆菌有较显著的抑菌活性。本试验就穿心莲水提取物对含fosA3大肠杆菌的杀菌作用进行了研究,结果显示,0.5 g/mL穿心莲水提取物在12、16 h可以使大肠杆菌存活菌数由108 CFU/mL降低到107 CFU/mL,24 h时,存活菌数下降到106 CFU/mL,其杀菌率随着穿心莲水提取物作用时间的增加而提高,当穿心莲水提取物作用24 h时,穿心莲水提取物对含fosA3大肠杆菌的杀菌率为92.66%,表明穿心莲水提取物对大肠杆菌的生长有着明显的抑制作用。
本试验采用二倍微量稀释法来测定穿心莲水提取物与抗菌药联合作用于含fosA3型耐药基因大肠杆菌体外杀菌效果,结果穿心莲水提取物与头孢菌素类、青霉素类、氟喹诺酮类、喹啉类、磺胺类、氨基糖苷类、酰胺醇类和磷霉素等抗菌药联合诱导传代后MIC显著降低。该方法与传统的影印药理学方法相比具有以下优势:(1)能够一次性筛选拟筛选中药影响的大量抗菌药物,1个96孔板至少能够筛选8个抗菌药物,效率高;(2)能够判断中药和抗菌药物之间的关系,如拮抗、协同、相加与是否随着作用时间的延长而增加抗菌药物的最小抑菌浓度值;(3)不受细菌被中药作用后是否仍能存活和继续培养的限制,能够避免中药杀菌作用和耐药逆转作用的冲突,扩大了中药的筛选种类和范围;(4)操作简便。
本研究仅限于体外抑菌试验,穿心莲水提取物在体内作用机制比体外还要复杂,且临床多采用复方治疗,因此,穿心莲水提取物在体内能否达到与体外相同效果尚无定论,下一步应深入研究穿心莲水提取物体内外抗菌作用。
目前,抗感染治疗方面的联合用药多为抗生素之间的联合,中药成分与抗生素的协同作用在临床治疗方案中很少有报道[21]。中药成分和药效的特殊性,细菌很少对其产生耐药性。但是,中药成分的抗菌活性一般较弱,限制了其临床应用。因此,通过将活性微弱的中药成分联合抗生素使用,探索其对常用抗生素的增效作用,有望成为耐药菌感染新的治疗措施。
参考文献:
[1]徐志勇,刘启德,张银卿,等. 穿心莲片的药理作用及急性毒性试验研究[J]. 广州中医药大学学报,2005,22(5):401-404.
[2]陈国祥,丁伯平,徐瑶,等. 穿心莲胶囊的抗炎作用研究[J]. 现代中西医结合杂志,2001,10(11):1004-1005.
[3]Chang R S,Ding L,Chen G Q,et al. Dehydroandrographolide succinic acid monoester as an inhibitor against the human immunodeficiency virus[J]. Proceedings of the Society for Experimental Biology and Medicine,1991,197(1):59-66.
[4]陈爱葵,黄清松,梁光发,等. 穿心莲对小白鼠腹腔巨噬细胞功能影响的研究[J]. 中国中医药信息杂志,1998,5(8):23-24.
[5]Zhang X F,Tan B K. Anti-diabetic property of ethanolic extract of Andrographis paniculata in strepto-ztocin-diabetic rats[J]. Acta Pharmacologica Sinica,2000,21(12):1157-1164.
[6]孙振华,陈志琳,徐立春,等. “莲必治”并用生物、化学疗法抑制体内肿瘤生长的实验研究[J]. 浙江中西医结合杂志,2001,11(2):88-89.
[7]Rajagopal S,Kumar R A,Deevi D S,et al. Andrographolide,a potential cancer therapeutic agent isolated from Andrographis paniculata[J]. Exp Theroncol,2003,3(3):147-158.
[8]李玉祥,樊华,张劲松,等. 中草药抗癌的体外试验[J]. 中国药科大学学报,1999,30(1):39-44.
[9]Zhang X F,Tan B K. Antihyperglycaemic and anti-oxidant properties of Andrographis paniculata in normal and diabetic rats[J]. Clinical and Experimental Pharmacology & Physiology,2000,27(5/6):358-363.
[10]王浴生,邓文龙,薛春生,等. 中药药理与应用[M]. 北京:人民卫生出版社,1998:866-869.
[11]王浴生,邓文龙,薛春生,等. 中药药理与应用[M]. 2版.北京:人民卫生出版社,2000:865.
[12]卢炜,邱世翠,王志强,等. 穿心莲体外抑菌作用研究[J]. 时珍国医国药,2002,13(7):392-393.
[13]Hou J,Huang X,Deng Y,et al. Dissemination of the fosfomycin resistance gene fosA3 with CTX-M β-lactamase genes and rmtB carried on IncFII plasmids among Escherichia coli isolates from pets in China[J]. Antimicrobial Agents and Chemotherapy,2012,56(4):2135-2138.
[14]张致平. 微生物药物学[M]. 北京:化学工业出版社,2003.
[15]赵波,李波,王强,等. 4个动物园灵长类动物肠道克雷伯氏菌的分离鉴定与药敏试验[J]. 中国畜牧兽医,2013,40(2):161-165.
[16]苑丽,刘建华,胡功政,等. 30株鸡大肠杆菌ESBLs基因型检测及耐药性分析[J]. 中国预防兽医学报,2009,31(6):438-443.
[17]马绪荣,苏德模. 药品微生物学检验手册[M]. 北京:科学出版社,2001.
[18]刘波,李雪驼,徐和利,等. 5种中药制剂杀灭幽门螺杆菌的实验研究[J]. 中国新药杂志,2002,11(6):457-459.
[19]Clinical and Laboratory Standards Institute. Performance standards for antimicrobial disk and dilution susceptibility tests for bacteria isolated from animals-third edition:Approved standard M31-A3[S]. CLSI,Wayne,PA,USA,2008.
[20]宗淑杰,吴明江,秦银河,等. 医家金鉴:检验医学卷(下) [M]. 北京:军事医学科学出版社,2007.
[21]Hemaiswarya S,Kruthiventi A K,Doble M. Synergism between natural products and antibiotics against infectious diseases[J].

