外源5—氨基乙酰丙酸(ALA)对盐胁迫下小型西瓜幼苗抗氧化酶活性的影响
陈罡+管安琴++万云龙++冯伟民++樊平声++卢昱宇

摘要:以耐盐性较弱的小型西瓜品种秀丽2号为材料,采用营养液栽培法,研究了外源5-氨基乙酰丙酸(ALA)对NaCl胁迫下西瓜幼苗叶片、根系中超氧阴离子( O-2 · )产生速率、丙二醛(MDA)含量、相对电导率和抗氧化酶活性的影响。结果表明,100 mmol/L NaCl处理下,西瓜幼苗叶片、根系中 O-2 · 产生速率、MDA含量和相对电导率均显著升高;而1.25 mmol/L外源ALA处理显著提高NaCl胁迫下西瓜幼苗叶片、根系超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)等抗氧化酶活性,显著降低了 O-2 · 产生速率、MDA含量和相对电导率。这些结果表明,外源ALA处理可有效清除体内活性氧,降低膜脂过氧化伤害程度,从而缓解盐胁迫对植株生长的抑制,进而有助于增强西瓜植株对盐胁迫的耐受性。
关键词:小型西瓜;5-氨基乙酰丙酸(ALA);盐胁迫;抗氧化酶活性
中图分类号: S651.01文献标志码: A文章编号:1002-1302(2016)06-0252-04
收稿日期:2015-08-13
基金项目:江苏省农业科技自主创新资金[编号:CX(13)5014]。
作者简介:陈罡(1982—),男,安徽颍上人,博士,助理研究员,主要从事蔬菜栽培生理与生物技术研究。Tel:(025)84391293;E-mail:chengang2891@163.com。
通信作者:冯伟民,研究员,主要从事蔬菜无公害栽培技术研究。E-mail:fweimin@126.com。西瓜(Citrullus lanatus),为葫芦科西瓜属的一年生蔓生草本植物,果瓤脆嫩,味甜多汁,含丰富的矿物盐和多种维生素,可清热解暑,还对高血压、肾病具有一定辅助疗效,是深受人们喜爱的消夏食品。西瓜是全球广泛分布的主要园艺作物,也是世界上十大重要水果之一。中国是西瓜生产大国,面积和产量均位居世界首位[1]。近年来随着我国设施园艺的迅速发展,西瓜反季节保护地栽培面积不断扩大。由于园艺设施季节性或常年覆盖生产,土壤长期得不到雨水的淋洗,使盐分聚集,引起土壤次生盐渍化,严重影响西瓜的生长和发育。
利用外源物质提高植物幼苗的抗盐性已在多种植物上应用。外源亚精胺可以提高盐胁迫条件下黄瓜幼苗的耐盐性[2]。外源脯氨酸处理可以通过减少盐胁迫下甜瓜植株体内丙二醛(MDA)含量,保护细胞质膜,从而减轻盐胁迫对植株的伤害[3]。5-氨基乙酰丙酸(5-aminolevulinic acid,ALA),又名δ-氨基乙酰丙酸,是所有卟啉类化合物生物合成的关键前体,参与许多生物体中的生物化学反应,如光合作用、维生素B12和血红素的合成等,并具有植物生长调节剂的作用[4-5]。Watanabe等在比较12种植物生长调节物质对棉花耐盐性影响的试验中观察到,以1.5% NaCl处理的植株全部死亡,而经100~300 mg/L ALA处理的受害率仅为20%~30%,且植株干质量和鲜质量与未经NaCl处理的差异不显著[6]。近几年一些研究表明,ALA可以提高多种蔬菜作物的抗逆性。周月等研究表明,0.1 mmol/L ALA能缓解盐胁迫下豌豆幼苗的氧化损伤,显著提高SOD等保护酶活性[7]。外源ALA 处理可以显著提高樱桃番茄幼苗叶片的保护酶活性,增强樱桃番茄幼苗对盐胁迫逆境的耐受能力,减轻和缓解盐伤害[8]。刘晖等发现,125 mmol/L NaCl处理下添加 15~30 mg/L ALA可以明显缓解盐胁迫对西瓜种子萌发的抑制效应[9]。然而,目前关于ALA如何增强盐胁迫下西瓜幼苗耐盐性的研究尚未见报道。
本研究采用营养液栽培,通过外源ALA处理盐胁迫下小型西瓜幼苗,研究外源ALA对盐胁迫下西瓜幼苗叶片、根系中 O-2 · 产生速率、MDA含量、相对电导率和抗氧化酶活性的影响,探讨外源ALA缓解盐胁迫对西瓜伤害的生理机制,为阐明ALA增强西瓜植株耐盐性机理提供理论依据。
1材料与方法
1.1材料
试验于2014年9—11月在江苏省农业科学院玻璃温室内进行。选用耐盐性较弱的小型西瓜品种秀丽2号(安徽省农业科学院园艺研究所提供)为材料,种子经消毒、浸种后,在30 ℃恒温培养箱中下催芽2 d,待芽长0.5 cm时播于装有基质的50孔塑料穴盘中育苗。温室内昼温20~30 ℃、夜温13~18 ℃,光合有效辐射(PPFD)最大为800 μmol/(m2·s)左右,相对湿度维持在60%~70%,每天浇水保持基质湿润,幼苗第1片真叶展开后浇1/2剂量的Hoagland营养液:Ca(NO3)2· 4H2O 945 mg/L、KNO3 607 mg/L、NH4H2PO4 115 mg/L、MgSO4·7H2O 493 mg/L、H3BO3 2.86 mg/L、MnSO4·4H2O 2.13 mg/L、ZnSO4·7H2O 0.22 mg/L、CuSO4·5H2O 0.08 mg/L、(NH4)6Mo7O24·4H2O 0.02 mg/L、NaFe-EDTA 30 mg/L。3叶1心时选取生长整齐一致的幼苗定植于装有1/2剂量Hoagland营养液的塑料水箱中(20 L),营养液pH值调至6.5±0.1,电导率(EC)2.0~2.2 mS/cm,并早晚各用气泵通气30 min。ALA为Sigma公司生产的分析纯药品。
1.2试验处理
植株预培养5 d后,向营养液中添加NaCl(分析纯),分2次加入,开始处理时营养液中NaCl浓度为50 mmol/L,第2天使营养液中NaCl终浓度为100 mmol/L,此时定为盐胁迫处理开始时间。试验设4个处理:(1)无盐对照(CK):正常营养液栽培;(2)无盐对照+1.25 mmol/L ALA;(3)盐胁迫(NaCl);(4)盐胁迫+1.25 mmol/L ALA(NaCl+ALA)。待幼苗4~5片真叶展开开始NaCl处理时,当天下午17:00用小型喷雾器喷施ALA(添加0.01% Triton作展着剂),叶面、叶背均匀喷洒,以药液附于叶面但不下滴为准,喷施量每株 3 mL。每个水箱15株,试验随机排列,每处理重复3次。开始处理8 d后,选生长点以下第3片展开真叶用液氮速冻后置于 -80 ℃ 超低温冰箱中保存备测。本试验所采用的NaCl胁迫浓度(100 mmol/L)和叶面喷施的ALA浓度(1.25 mmol/L)均由预备试验筛选得出。
1.3生理指标测定
O-2 · 产生速率按照王爱国等的方法[10]测定。丙二醛(MDA)含量采用Heath等的方法[11]测定。相对电导率参照Gong等的电导率仪法[12]测定。超氧化物歧化酶(SOD)活性采用Giiannopolitis等的方法[13]测定,以抑制氮蓝四唑(NBT)光还原50%为1个酶活性单位(U)。过氧化物酶(POD)活性按照曾韶西等的方法[14]测定,以D470 nm 1 min增加0. 01为1个酶活性单位(U)。过氧化氢酶(CAT)活性采用Dhindsa等的方法[15]测定,以1 min减少0.1个吸光度值所需酶量为1个活力单位(U)。
1.4数据分析
试验数据均采用SAS 13.0统计分析软件进行数据分析,Duncans多重比较法进行统计分析。
2结果
2.1外源ALA对NaCl胁迫下小型西瓜幼苗 O-2 · 产生速率、MDA含量和相对电导率的影响
由图1可知,NaCl胁迫处理8 d后,西瓜幼苗叶片和根系 O-2 · 产生速率显著提高,与无盐对照相比,分别显著提高了122.4%和136.2%;NaCl胁迫下喷施外源ALA可以显著降低 O-2 · 产生速率,其叶片和根系分别显著降低了42.5%和44.7%,说明外源ALA能有效降低NaCl胁迫引起的 O-2 · 产生速率的增加,从而降低由活性氧引起的伤害;无盐条件下,施用外源ALA对西瓜幼苗叶片和根系 O-2 · 产生速率无明显影响。
从图1可以看出,NaCl胁迫处理8 d后,西瓜幼苗叶片和根系MDA含量显著增加,与无盐对照相比,分别显著增加了77.7%和94.6%;NaCl胁迫下喷施外源ALA可以显著降低MDA含量,其叶片和根系分别降低了26.7%和30.3%。无盐条件下,施用外源ALA对西瓜幼苗叶片和根系MDA含量无明显影响。MDA是植物在逆境条件下膜脂过氧化的最终分解产物,其含量可以用来衡量植物遭受逆境伤害的程度,此结果说明外源ALA能有效降低NaCl胁迫引起的MDA含量的增加,进而缓解膜脂过氧化损伤,降低细胞膜的受损程度。
由图1可见,NaCl胁迫处理8 d后,小型西瓜幼苗叶片和根系的相对电导率显著增加,与无盐对照相比,分别显著增加了82.7%和83.2%,NaCl胁迫下喷施外源ALA可以显著降低相对电导率,其降低程度分别为22.5%和28.3%;无盐条件下,喷施外源ALA对西瓜幼苗叶片和根系相对电导率无明显影响。叶片和根系相对电导率是反映细胞膜受损程度的重要指标之一,此结果表明NaCl胁迫破坏了西瓜幼苗细胞膜的稳定性,使膜结构受到损伤,造成细胞内电解质渗漏加剧,而喷施外源ALA可以有效减轻NaCl胁迫对西瓜幼苗细胞膜伤害的程度。
以上结果说明,NaCl胁迫下西瓜植株体内 O-2 · 产生速率、MDA含量和相对电导率增加,导致幼苗活性氧伤害和膜脂过氧化,特别是根系直接处于NaCl胁迫的环境中,受到的伤害程度大于叶片;而喷施外源ALA可以降低 O-2 · 产生速率、MDA含量和相对电导率,从而减缓活性氧对幼苗的伤害,降低膜脂过氧化作用,减轻NaCl胁迫对西瓜细胞膜的伤害。
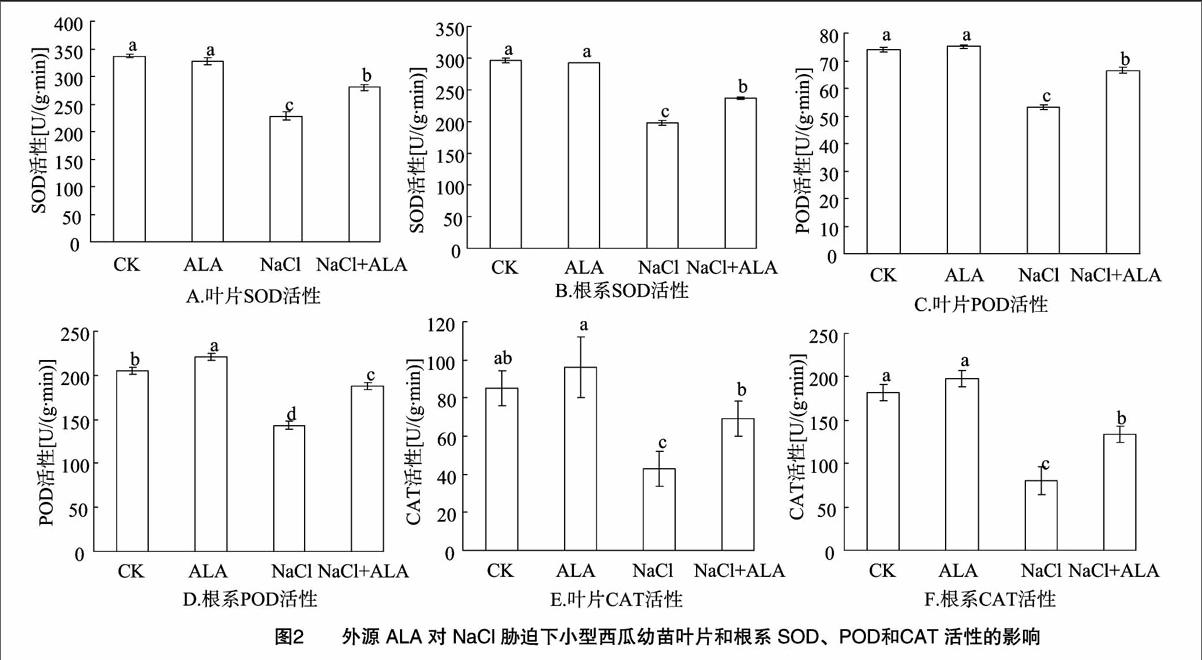
2.2外源ALA对NaCl胁迫下小型西瓜幼苗超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)活性的影响
由图2可见,NaCl胁迫处理8 d后,显著降低了西瓜叶片和根系中SOD、POD、CAT保护酶的活性,其叶片3种酶活性分别降低了32.2%、28.2%、50.0%,而根系3种酶活性分别降低了33.3%、30.2%、55.9%;叶面喷施外源ALA能够显著提高NaCl胁迫下西瓜叶片和根系中SOD、POD、CAT活性,与NaCl胁迫处理相比叶片3种酶活性分别升高了22.5%、25.1%、62.5%,而根系3种酶活性分别升高了19.8%、31.0%、66.7%;无盐条件下,外源ALA对西瓜幼苗叶片和根系中SOD、CAT活性无明显影响;而无盐条件下,外源ALA提高西瓜幼苗根系中POD活性,升高了7.8%。上述结果表明,NaCl胁迫处理8 d后,西瓜幼苗自身的调节能力减弱,内源抗氧化酶系统清除活性氧、防止膜脂过氧化作用的能力下降,幼苗会受到伤害;叶面喷施外源ALA可以提高NaCl胁迫下西瓜幼苗体内抗氧化酶的活性,增强植株对体内活性氧的清除能力,有效降低氧化损伤,从而提高植株的抗盐性。3讨论
植物自身的抗氧化酶和抗氧化剂防御系统能使体内活性氧的产生与清除之间维持在一个动态平衡之中。非生物逆境诱导植物体内活性氧(ROS)积累增多,过量的ROS攻击植物体内蛋白质、脂质、碳水化合物和DNA,最终导致氧化胁迫抑制植物的生长[16]。Parida 等指出,盐胁迫加快了植物体内膜脂过氧化作用的进程,植物体内ROS代谢平衡被打破,ROS含量增加,细胞膜脂过氧化和脱脂化,细胞膜结构和完整性被破坏,引起膜流动性降低,使质膜透性增加,植物细胞生理代谢发生紊乱,而导致细胞的伤害或死亡,抑制植物生长[17]。本试验中,NaCl胁迫处理8 d后,西瓜幼苗叶片和根系 O-2 · 产生速率加快,SOD、POD和CAT活性降低,对ROS的清除能力降低,来不及清除大量的ROS,导致了西瓜幼苗膜脂过氧化伤害,进一步抑制了植株的生长。
细胞膜是受逆境胁迫最敏感的部位之一。环境胁迫会使植物体内活性氧自由基大量积累,而积累的活性氧自由基会导致膜脂肪酸中的不饱和键被过氧化形成MDA。活性氧自由基诱导的膜脂过氧化是胁迫造成的细胞水平上的伤害,膜脂过氧化过程中产生的MDA含量的高低和相对电导率的大小都是反映细胞膜脂过氧化作用强弱和质膜破坏程度的重要指标[18]。MDA积累多,说明 O-2 · 与羟自由基(·OH)可能是高水平。本研究发现,西瓜幼苗受到NaCl胁迫后,其MDA含量和组织相对电导率显著升高,说明细胞质膜发生了过氧化作用,引起质膜正常生理功能发生紊乱;但当用外源ALA处理以后,其MDA含量和组织相对电导率显著降低,说明ALA对减缓盐胁迫所造成的过氧化伤害具有积极的缓解作用,并以1.25 mmol/L的ALA处理效果最好。
盐胁迫逆境会提高细胞ROS水平,而造成氧化损伤的ROS主要包括 O-2 · 和H2O2,其中 O-2 · 对植物体的伤害更重。植物抗氧化酶系统的SOD、POD和CAT酶在维持膜结构完整性、清除ROS自由基、缓解膜脂过氧化伤害方面发挥着重要作用,可有效提高植物对逆境胁迫的适应性[19]。SOD主要存在于细胞质、叶绿体和线粒体内,是植物体内抵御氧化胁迫的第一道防线。当植物受胁迫、活性氧增加时,SOD的合成表达便会增强, O-2 · 在SOD的催化作用下发生歧化反应,生成H2O2和O2。同时POD、CAT在植物组织中广泛存在,POD能够催化以H2O2为氧化剂的氧化还原反应,将H2O2还原为H2O;CAT可将代谢中产生的H2O2分解为H2O和O2。这3种抗氧化酶协同作用可以有效降低植株体内自由基的水平,保护细胞膜结构,从而防止自由基对植物的伤害[20]。本研究中,NaCl胁迫下施用ALA处理能显著提高西瓜幼苗叶片和根系SOD、POD和CAT酶活性,而 O-2 · 产生速率、MDA含量和相对电导率显著降低。说明施用ALA后高活性的SOD、POD和CAT酶能协同作用,提高了西瓜幼苗叶片和根系的抗氧化能力,减少细胞中ROS的含量,降低膜脂过氧化,使得膜脂过氧化产物MDA含量和相对电导率显著降低。
外源喷施适宜浓度的ALA能够刺激诱导抗氧化酶的活性,加速ROS的清除[21],这可能是ALA提高胁迫条件下植物抗性的一种作用机制。ALA是亚铁血红素(Heme)的合成前体,而Heme作为辅基普遍存在于POD和CAT中,因此推测作为四吡咯类化合物合成的关键前体,外源ALA可能通过转化为Heme进而导致POD活性增加,从而提高抗氧化胁迫能力[4,22],并认为ALA可能是促进NaCl胁迫下西瓜种子萌发的原因之一[9]。在豌豆、樱桃番茄等多种蔬菜作物上发现,ALA提高抗逆性总是伴随着抗氧化酶活性的增加,因此推测ALA诱导SOD、POD、CAT等抗氧化酶活性上升是其增强植物抗逆性的主要原因[7-8,23-24]。
综上所述,盐胁迫显著抑制小型西瓜幼苗生长,施用 1.25 mmol/L ALA能有效缓解盐胁迫诱导的生长抑制,ALA通过提高盐胁迫下西瓜幼苗的抗氧化酶活性,加强清除活性氧能力,降低了膜脂过氧化程度,维持了细胞膜的稳定性,从而缓解西瓜幼苗所受的氧化损伤,增强植株对盐胁迫的抗性。
参考文献:
[1]别之龙. 我国西瓜甜瓜嫁接育苗产业发展现状和对策[J]. 中国瓜菜,2011,24(2):68-71.
[2]李斌,郭世荣,孙锦,等. 外源Spd对盐胁迫下黄瓜幼苗生长和活性氧代谢的影响[J]. 江苏农业学报,2012,28(1):152-157.
[3]颜志明,孙锦,郭世荣. 外源脯氨酸对NaCl胁迫下甜瓜幼苗生长和活性氧物质代谢的影响[J]. 江苏农业学报,2011,27(1):141-145.
[4]汪良驹,姜卫兵,章镇,等. 5-氨基乙酰丙酸的生物合成和生理活性及其在农业中的潜在应用[J]. 植物生理学通讯,2003,39(3):185-192.
[5]Akram N A,Ashraf M. Regulation in plant stress tolerance by a potential plant growth regulator,5-aminolevulinic acid[J]. Journal of Plant Growth Regulation,2013,32(3):663-679.
[6]Watanabe K,Tanaka T,Hotta Y,et al. Improving salt tolerance of cotton seedlings with 5-aminolevulinic acid[J]. Plant Growth Regulation,2000,32(1):97-101.
[7]周月,徐亮,杨立,等. 外源ALA对盐胁迫下豌豆幼苗生理特性的影响[J]. 西南师范大学学报:自然科学版,2012,37(8):111-115.
[8]孟长军,邹志荣. 外源ALA对樱桃番茄幼苗盐伤害的缓解效应[J]. 江苏农业学报,2011,27(2):378-381.
[9]刘晖,康琅,汪良驹. ALA 对盐胁迫下西瓜种子萌发的促进效应[J]. 果树学报,2006,23(6):854-859.
[10]王爱国,罗广华.植物的超氧物自由基与羟胺反应的定量关系[J]. 植物生理学通讯,1990,26(6):55-57.
[11]Heath R L,Packer L. Photoperoxidation in isolated chloroplasts. Ⅰ. Kinetics and stoichiometry of fatty acid peroxidation[J]. Archives of Biochemistry and Biophysics,1968,125(1):189-198.
[12]Gong M,Li Y J,Chen S Z. Abscisic acid-induced thermotolerance in maize seedlings is mediated by calcium and associated with antioxidant systems[J]. Journal of Plant Physiology,1998,153(3/4):488-496.
[13]Giannopolitis C N,Ries S K. Superoxide dismutases:Ⅱ. purification and quantitative relationship with water-soluble protein in seedlings[J]. Plant Physiology,1977,59(2):315-318.
[14]曾韶西,王以柔,李美如. 不同胁迫预处理提高水稻幼苗抗寒性期间膜保护系统的变化比较[J]. 植物学报,1997,39(4):308-314.
[15]Dhindsa R S,Plumb-Dhindsa P,Thorpe T A. Leaf senescence:correlated with increased levels of membrane permeability and lipid peroxidation,and decreased levels of superoxide dismutase and catalase[J]. Journal of Experimental Botany,1981,32(1):93-101.
[16]Gill S S,Tuteja N. Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants[J]. Plant Physiology and Biochemistry,2010,48(12):909-930.
[17]Parida A K,Das A B. Salt tolerance and salinity effects on plants:a review[J]. Ecotoxicology and Environmental Safety,2005,60(3):324-349.
[18]张春平,何平,韦品祥,等. 外源5-氨基乙酰丙酸对盐胁迫下紫苏种子萌发及幼苗抗氧化酶活性的影响[J]. 中草药,2011,42(6):1194-1200.
[19]刘志媛,朱祝军,钱亚榕,等. 等渗Ca(NO3)2和NaCl对番茄幼苗生长的影响[J]. 园艺学报,2001,28(1):31-35.
[20]王丽萍,孙锦,郭世荣,等. 等渗Ca(NO3)2和NaCl胁迫对黄瓜砧用南瓜幼苗生长和活性氧代谢的影响[J]. 西北植物学报,2011,31(10):2045-2051.
[21]Liu D,Wu L T,Naeem M S,et al. 5-aminolevulinic acid enhances photosynthetic gas exchange,chlorophyll fluorescence and antioxidant system in oilseed rape under drought stress[J]. Acta Physiologiae Plantarum,2013,35(9):2747-2759.
[22]Hunter G A,Rivera E,Ferreira G C. Supraphysiological concentrations of 5-aminolevulinic acid dimerize in solution to produce superoxide radical anions via a protonated dihydropyrazine intermediate[J]. Archives of Biochemistry and Biophysics,2005,437(2):128-137.
[23]张治平,於丙军,汪良驹,等. 低温下ALA对番茄光合色素和抗氧化酶活性的影响[J]. 江苏农业学报,2014,30(1):222-224.
[24]张治平,张丽丽. 5-氨基乙酰丙酸对油菜幼苗抗冷性和抗氧化系统的影响[J]. 江苏农业科学,2014,42(2):52-55.

