拟南芥突变体kea的表型分析及对生长素的响应特征
韩蕾 李俊林 苏彦华

摘要:对拟南芥kea突变体表型分析的结果表明,在黑暗条件下,单个KEA缺失后下胚轴和主根伸长与野生型相比没有明显差异,而多个KEA缺失导致幼苗出现去黄化现象,表现为下胚轴伸长受到抑制,子叶完全打开,真叶开始出现,主根发育良好。qRT-PCT结果表明,呈现去黄化现象的kea多突变体内生长素合成基因[WTBX][STBX]IAA1、IAA3、IAA17[WTBZ][STBZ]的表达下调,而生长素转运基因[WTBX][STBX]AUX1、PIN1、PIN3、PIN7[WTBZ][STBZ]的表达没有明显变化。外源施加生长素类似物NAA能够恢复kea多突变体去黄化现象。上述结果暗示KEA在调控拟南芥光调控发育的某些方面发挥重要作用。
关键词:拟南芥;去黄化;生长素;暗形态建成
中图分类号: Q945.12文献标志码: A 文章编号:1002-1302(2016)06-0030-03
植物在光照下和黑暗中表现为不同的生长特性;光照下萌发的幼苗表现为:下胚轴伸长受抑制、主根伸长、子叶展开、叶绿素累积,称为光形态建成(photomorphogenesis)。在黑暗中,植物的生长呈现出多种黄化特征,称为暗形态建成(skotomorphogenesis)[1]。黄化苗主要特点为迅速生长和伸长的下胚轴、发育迟缓的主根、闭合的子叶形成顶端弯钩(apical hook)[2]。在自然界中,种子发芽起始于暗形态建成过程:种子萌发后,大部分营养资源流向下胚轴,用于下胚轴伸长而不是子叶和根系的发育,这种快速伸长的方式为幼苗更早的接收光照提供了物理支持。此外,子叶通过紧闭形成顶端弯钩以保护地上部分生组织在幼苗破土而出时免遭伤害。这一生长策略能够保证幼苗在光合作用之前种子中贮备的有限营养物质更有效利用[3]。
暗形态建成过程受多种植物激素如生长素、脱落酸、细胞分裂素、油菜素内酯、赤霉素和乙烯的调控[2,4-7]。生长素能够促进多种植物器官的伸长,例如:下胚轴、胚芽鞘和根,其机理早在20世纪70年代由酸生长理论所解释[8-9]。此理论表明在数分钟内,通过细胞质膜H+-ATPase生长素促进质子外排,此过程降低了质外体间pH值,促进细胞壁松弛[10]。本研究筛选到几个kea突变体,其暗形态过程发生改变,通过分析下胚轴、主根的表观特征,并利用基因表达和药理学试验初步研究了其去黄化特征对生长素响应的改变,以期探讨KEA基因在拟南芥发育过程中的功能,为进一步阐述拟南芥光发育的相关机制提供良好的试验材料。
1材料与方法
1.1供试材料
1.1.1[JP2]植物材料拟南芥野生型Col-0,单突变体[WTBX][STBX]kea3、kea4、kea5、kea6[WTBZ][STBZ];双突变体[WTBX][STBX]kea4/5[WTBZ][STBZ]和[WTBX][STBX]kea4/6[WTBZ][STBZ],多突变体体[WTBX][STBX]kea4/5/6[WTBZ][STBZ]。其中[WTBX][STBX]kea3、kea4、kea5、kea6[WTBZ][STBZ]单突变体种子从ABRC拟南芥种子资源库购得。双突变体和多突变体通过杂交方法得来。[JP]
1.1.2生长条件和培养基光照培养箱(MMM,Germany)的培养条件为:温度23 ℃,相对湿度70%,连续黑暗培养。培养基修改自Pilot 等的配方[11],成分包括:1 mmol/L CaSO4,2 mmol/L NH4NO3,1 mmol/L KH2PO4,1 mmol/L MgSO4,50 μmol/L NaFe-EDTA,50 μmol/L H3BO3,12 μmol/L MnCl2,1 μmol/L CuCl2,1 μmol/L ZnCl2,30 nmol/L (NH4)6Mo7O24,2.4 mmol/L MES(2-吗啉己磺酸),10 g/L蔗糖,8 g/L琼脂,用1 mmol/L KOH调至pH值5.7,121 ℃,100 kPa 灭菌20 min。
1.2试验方法
1.2.1拟南芥种子消毒和播种拟南芥种子,先用70%乙醇冲洗30 s,再用含有体积分数1%次氯酸钠和5 g/L SDS (十二烷基硫酸钠)的消毒液冲洗,并且剧烈振荡5 min,然后用无菌水冲洗5次,最后再加少量无菌水,4 ℃冰箱放置 48 h。播种于培养基,用医用胶带密封后竖直放置在生长箱培养。
1.2.2激素处理试验配制10 mmol/L 生长素类似物NAA,待培养基灭菌冷却至65 ℃左右,在超净工作台中,将NAA母液按照一定的稀释倍数添加到培养基。
1.2.3下胚轴和主根长测量拟南芥野生型和突变体在正常培养基或含有不同浓度NAA的培养基黑暗培养8 d后,以直尺为参照进行拍照(Cannon G8),使用ImageJ软件按照直尺比例分析下胚轴和主根长。
1.2.4拟南芥RNA提取及反转录采用Trizol(TaKaRa)分别提取野生型和突变体总RNA,并且用DNA酶去除基因组DNA污染。取2份RNA,一份用于测定在260 nm和 280 nm 处的吸光度,通过D260 nm/D280 nm的值得出总RNA的纯度,此比值介于1.8~2.2之间为佳;另一份通过变性胶检测RNA完整性,如果28S和18S清晰无拖尾,而且亮度比值约为 2 ∶[KG-*3]1,说明提取的总RNA无降解且完整性较高。取2 μg RNA,用反转录试剂盒(TAKARA)合成cDNA。
1.2.5实时定量荧光PCR采用荧光染料SYBR Green I (TaKaRa) 进行分析。本研究所用引物见表1。定量PCR加样量:2 × SYBR green Ⅰ Premix 10 μL,PrimerF (10 μmol/L) 0.4 μL,PrimerR (10 μmol/L)0.4 μL,cDNA模板(稀释4倍)2.5 μL,去离子水补充至20 μL。PCR程序如下:95 ℃ 3 min;95 ℃ 15 s,60 ℃ 15 s,72 ℃ 15 s,45个循环;熔解曲线从 65 ℃ 到95 ℃,每0.5 ℃进行记录;最后16 ℃。PCR结束后先分析熔解曲线,每对引物的溶解曲线一致,说明该PCR特异,数据可信。另外分析扩增曲线,我们用Actin2为内参,以2-ΔΔCT相对定量的方法计算目的基因的相对表达量。cDNA模板的CT值基本保证在15~30之间,超出此范围,数据不可信。根据经验,一般稀释4倍。
1.2.6数据统计与作图所得统计结果用Microsoft Excel软件进行计量,用Sigmaplot 10.0软件进行计算和作图。
2结果与分析
2.1KEA多突变体黄化苗出现去黄化现象
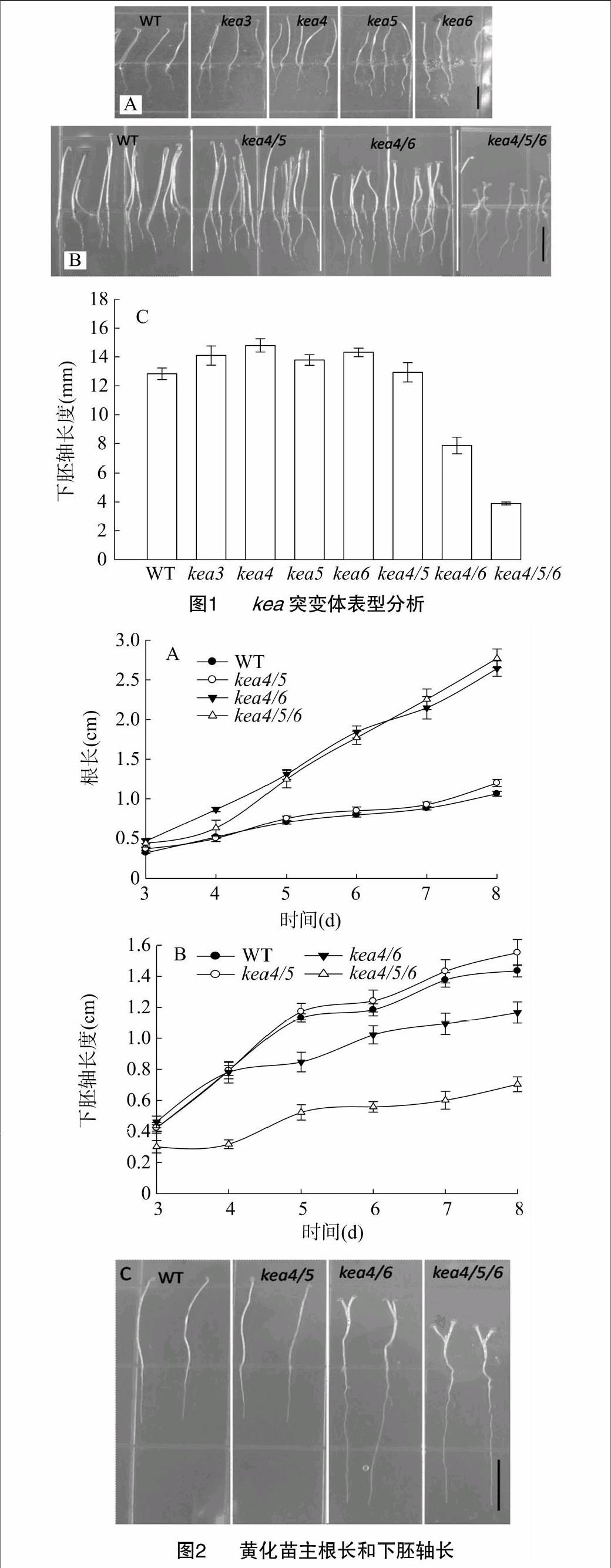
试验发现,在黑暗条件下生长5 d,与野生型(WT)相比,KEA单突变体的下胚轴长度略长或者没有差别(图1-A);而KEA多突变体,除了[WTBX][STBX]kea4/5[WTBZ][STBZ]外,[WTBX][STBX]kea4/6[WTBZ][STBZ]和[WTBX][STBX]kea4/5/6[WTBZ][STBZ]与单突变体或野生型相比,下胚轴长度较小,主根较长,特别是[WTBX][STBX]kea4/5/6[WTBZ][STBZ],其下胚轴长度比野生型减小了2/3(图1-B、图1-C)。另外还发现,除了[WTBX][STBX]kea4/5[WTBZ][STBZ],大多数多突变体[WTBX][STBX]kea4/6[WTBZ][STBZ]和[WTBX][STBX]kea4/5/6[WTBZ][STBZ]子叶已经完全展开,而野生型和单突变体子叶还处于弯钩(hook)状态(图1-B)。
为了更进一步了解多突变体黄化苗发育状况,连续测量黄化苗在生长3 d至8 d的生长情况。如图2-A、图2-B所示,从生长4 d开始,多突变体就开始表现为根伸长量增加而下胚轴伸长量减少。具体到生长8 d时,野生型和双突变[WTBX][STBX]kea4/5[WTBZ][STBZ]表现为典型的黄化现象(etiolated),即较长的下胚轴,较短的主根;而多突变体则表现出明显的去黄化现象(de-etiolated),除了主根和下胚轴外,子叶完全展开,真叶开始冒出,呈现出类似于光照下的表型(图2-C)。
2.2kea突变体内生长素合成基因表达下调
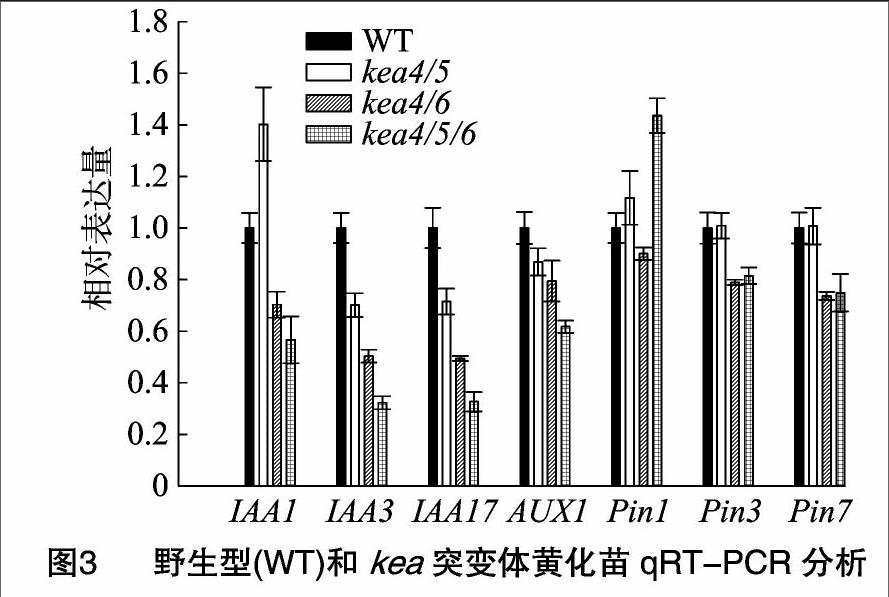
通过定量PCR,发现突变体内生长素合成相关基因下调,如[WTBX][STBX]IAA1、IAA3、IAA17[WTBZ][STBZ],而生长素运输基因[WTBX][STBX]AUX1[WTBZ][STBZ]或PIN等表达没有发现明显变化(图3),因此推断,突变体的去黄化表型可能是与生长素的合成有关,而与生长素运输关系不大。
2.3生长素类似物NAA能够恢复kea突变体去黄化现象
为了验证kea突变体去黄化现象是否与生长素合成有关,向培养基添加一系列浓度 (0.01、0.1、1 μmol/L) 生长素类似物萘乙酸NAA,如图4所示,黑暗条件下,低浓度NAA (0.01、0.1 μmol/L)对野生型和突变体[WTBX][STBX]kea4/5[WTBZ][STBZ]下胚轴生长没有明显的抑制作用,当NAA浓度达到1 μmol/L时,其下胚轴生长明显受到抑制,抑制率约为17%、21%。[JP2]而对于突变体[WTBX][STBX]kea4/6[WTBZ][STBZ]和[WTBX][STBX]kea4/5/6[WTBZ][STBZ],NAA对其下胚轴生长有明显的促进作用,[JP]
[FK(W30][TPHL4.tif;S+1mm][FK)]
特别是对[WTBX][STBX]kea4/5/6[WTBZ][STBZ],1 μmol/L NAA使其下胚轴伸长增加约82%。同时发现,NAA(0.01、0.1 μmol/L)对野生型和突变体根系都有明显抑制作用,尤其是当浓度达到 1 μmol/L,所试株系的主根伸长均被抑制。
总之,NAA处理后,去黄化突变体[WTBX][STBX]kea4/6[WTBZ][STBZ]和[WTBX][STBX]kea4/5/6[WTBZ][STBZ]恢复或部分恢复黄化苗特征:较长的下胚轴,较短的主根,子叶保持弯钩状态或部分展开。
3讨论
在正常生长条件下,不同于单突变,kea多突变体[WTBX][STBX]kea4/6[WTBZ][STBZ]和[WTBX][STBX]kea4/5/6[WTBZ][STBZ]呈现出明显的发育表型:下胚轴较短,主根较长,弯钩消失,子叶完全展开,真叶开始出现,这说明KEA基因在控制拟南芥生长发育的某些方面发挥重要作用。同样作为双突变体,[WTBX][STBX]kea4/5[WTBZ][STBZ]的表型明显不同于[WTBX][STBX]kea4/6[WTBZ][STBZ],这可能是由于[WTBX][STBX]KEA4[WTBZ][STBZ]和[WTBX][STBX]KEA5[WTBZ][STBZ]之间存在功能冗余。生长素在植物地上部和根系发育过程起着重要的调控作用,kea多突变体内生长素合成基因表达变化,暗示KEA基因突变可能影响了拟南芥体内的生长素相关路径。外源添加一定浓度的生长素类似物NAA,kea多突变体下胚轴长度能够恢复到野生型的水平。生长素也促进植物根系的伸长生长,但生长素促进根系生长的最适浓度比促进下胚轴生长的最适浓度要低,稍高浓度的生长素就会抑制根系的伸长生长。在本研究所使用的NAA浓度下,野生型和突变体主根均被抑制。此外,黑暗条件下萌发的幼苗,顶端弯钩的作用在于,降低其地上部顶端分生组织在冲破泥土接收光照过程中所受的伤害[13]。如果在地上部冲破泥土前弯钩过早打开,其子叶和分生组织会遭到破坏;此外,黑暗条件下,下胚轴快速生长能够加速地上部冲破泥土的进程。以上结果显示,KEA参与了拟南芥暗形态建成过程。[JP]
参考文献:
[1][ZK(#]Josse E M,Halliday K J. Skotomorphogenesis:the dark side of light signalling[J]. Current Biology,2008,18(24):R1144-R1146.
[2]Barrero J M,Rodríguez P L,Quesada V,et al. The [WTBX][STBX]ABA1[WTBZ][STBZ] gene and carotenoid biosynthesis are required for late skotomorphogenic growth in Arabidopsis thaliana[J]. Plant Cell and Environment,2008,31(2):227-234.
[3]Alabadí D,Blázquez M A. Integration of light and hormone signals[J]. Plant Signaling & Behavior,2008,3(7):448-449.
[4]Alabadí D,Gallego-Bartolomé J,Orlando L,et al. Gibberellins [JP2]modulate light signaling pathways to prevent Arabidopsis seedling de-[JP]etiolation in darkness[J]. Plant Journal,2008,53(2):324-335.
[5]Wu S H. Gene expression regulation in photomorphogenesis from the perspective of the central dogma[J]. Annual Review of Plant Biology,2014,65:311-333.
[6]Alabadí D,Blázquez M A. Molecular interactions between light and hormone signaling to control plant growth[J]. Plant Molecular Biology,2009,69(4):409-417.
[7]Symons G M,Reid J B. Hormone levels and response during de-etiolation in pea[J]. Planta,2003,216(3):422-431.
[8]Rayle D L,Cleland R. Enhancement of wall loosening and elongation by acid solutions[J]. Plant Physiology,1970,46(2):250-253.
[9]Hager A,Debus G,Edel H G,et al. Auxin induces exocytosis and the[ZK)]
[FL)][LM]
[KH*4D]
[HT8.][KG1*2/3][ZK(#] rapid synthesis of a high-turnover pool of plasma-membrane H+-ATPase[J]. Planta,1991,185(4):527-537.[ZK)]
[10][ZK(#][JP2]Takahashi K,Hayashi K I,Kinoshita T. Auxin activates the plasma membrane H+-ATPase by phosphorylation during hypocotyl elongation in Arabidopsis[J]. Plant Physiology,2012,159(2):632-641.[JP]
[11][JP2]Pilot G,Gaymard F,Mouline K,et al. Regulated expression of Arabidopsis shaker K+channel genes involved in K+uptake and distribution in the plant[J]. Plant Molecular Biology,2003,51(5):773-787.[JP]
[12]Lilley J L,Gee C W,Sairanen I A,et al. An endogenous carbon-sensing pathway triggers increased auxin flux and hypocotyl elongation[J]. Plant Physiology,2012,160(4):2261-2270.
[13]Mazzella M A,Casal J J,Muschietti J P,et al. Hormonal networks involved in apical hook development in darkness and their response to light[J]. Frontiers in Plant Science,2014,5(1):52-58.

