白三叶根系分泌物的化感作用及其GC-MS分析
王晓英
(唐山师范学院 生命科学系,河北 唐山063000)
白三叶根系分泌物的化感作用及其GC-MS分析
王晓英
(唐山师范学院 生命科学系,河北 唐山063000)
为探明白三叶入侵禾本科草坪是否与其根系分泌物的化感作用有关,采用琼脂培养法研究白三叶根系分泌物对高羊茅和草地早熟禾种子萌发和幼苗生长的化感作用及其作用机制,并采用气相色谱-质谱(GC-MS)联用技术对白三叶根系分泌物化学成分进行分析。结果表明,白三叶根系分泌物对高羊茅和草地早熟禾种子萌发和幼苗生长均有化感抑制作用,抑制程度不同,抑制率介于4.42%~53.16%。经白三叶根系分泌物处理后,高羊茅和草地早熟禾幼苗超氧化物歧化酶(SOD)、过氧化物酶(POD)活性均受到抑制,丙二醛(MDA)含量升高,可溶性蛋白含量降低,过氧化氢酶(CAT)活性表现为高羊茅幼苗升高,而草地早熟禾幼苗受到抑制。用乙酸乙酯、正丁醇、乙醚萃取白三叶根系分泌物,共鉴定出66种化合物,主要是紫薇缩醛、油酸酰胺、壬醛、硬脂酰胺、2,4-二叔丁基苯酚、2,6-二叔丁基对甲酚。可见,白三叶根系分泌物的化感作用是其入侵禾本科草坪的原因之一。
化感作用; 白三叶; 高羊茅; 草地早熟禾; 根系分泌物; 气相色谱-质谱
白三叶(TrifoliumrepensL.)又称白车轴草,为豆科(Leguminosae)车轴草属(Trifolium)多年生地被植物,具有分枝多、适应力强、生长速度快等特点,在园林绿化中可形成单一的植物群落。在多年的种植过程中发现,白三叶常入侵其他禾本科草坪,破坏禾本科草坪的均一性和观赏性。白三叶除了与禾本科植物争夺光照和水分外[1],还具有化感作用。前人对白三叶化感作用的研究主要集中在植株浸提液[2-5]、挥发物[6]和腐解物[7]方面。关于白三叶根系分泌物的化感作用研究较少,仅余婷等[8]采用水培收集根系分泌物的方法对其进行了研究,但未对白三叶根系分泌物的实际浓度进行分析。
根系分泌是指健康完整的活体植株通过根系向生长基质中释放无机离子或者有机物的过程,它是自然界的普遍现象,也是化感物质释放的重要途径[9]。根系分泌物不仅影响植物种子的萌发和幼苗生长,而且对植物幼苗的生理也有影响[10-11]。关于白三叶根系分泌物在生产中的实际浓度能否起到化感作用未见报道,为此本试验采用琼脂培养的方法收集白三叶根系分泌物,研究其在生产中的实际浓度对高羊茅和草地早熟禾种子萌发、幼苗生长、生理的影响,并采用气相色谱-质谱(GC-MS)联用技术分析白三叶根系分泌物的化学组分,探讨其与白三叶入侵禾本科草坪的关系,为园林绿化中植物配置提供一定的理论依据。
1 材料和方法
1.1 试验材料
白三叶、高羊茅与草地早熟禾种子购自克劳沃公司。
1.2 试验方法
1.2.1 白三叶根系分泌物的获得及处理 在无菌条件下将白三叶种子用0.1%的升汞溶液消毒8~10 min后,无菌水冲洗3~5次,再将种子浸入70%乙醇溶液中30 s,无菌水冲洗3~5遍后,将其播入装有50 mL琼脂培养基(7‰)的三角瓶中,每瓶约播入50粒种子,将三角瓶置于人工气候箱中培养。前3 d,25 ℃暗培养;从第4天起在25 ℃、4 000 lx光照、12 h,20 ℃、暗培养、12 h的无菌条件下培养,45 d后取出白三叶幼苗,培养基中即含有白三叶根系分泌物。期间若发现有污染的培养瓶立即取出。通过称质量在培养基中补足被白三叶幼苗吸收的水分,融化培养基,使其混匀,即得到含有白三叶根系分泌物的培养基。对照组不播白三叶种子,其余处理相同。
1.2.2 白三叶根系分泌物对高羊茅和草地早熟禾化感作用的测定 高羊茅和草地早熟禾种子按照上述白三叶种子的消毒方法消毒后,播入含有白三叶根系分泌物的培养基中。高羊茅每瓶接种30粒种子,草地早熟禾每瓶接种50粒种子。以不含白三叶根系分泌物的培养基为对照(CK)。将接有高羊茅和草地早熟禾种子的培养基放入人工气候箱中25 ℃、暗培养3 d,从第4天起在25 ℃、4 000 lx光照、12 h,20 ℃、暗培养、12 h条件下培养。从种子露白起每隔24 h记录萌发的种子数,连续记录7 d发芽率,计算发芽势、发芽指数和活力指数。培养15 d后对受试植物幼苗的根长、苗高、保护酶活性、丙二醛(MDA)含量、可溶性蛋白含量进行测定。超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)的活性测定均参照《植物生理学实验指导》[12];MDA含量参照赵世杰等[13]的方法测定;可溶性蛋白含量采用Bradford方法[14]测定。
抑制率(IR)=(对照值-处理值)/对照值×100%(IR<0表示促进,IR>0表示抑制)。
1.2.3 白三叶根系分泌物的提取及成分测定 将含有白三叶根系分泌物的培养基经8层纱布挤压、滤纸过滤后的液体,在45 ℃条件下旋转蒸发20 min,将浓缩后的提取液用细菌过滤器过滤,得到含有白三叶根系分泌物的提取液。
分别取5 mL白三叶根系分泌物提取液,加入1 mL乙酸乙酯、乙醚、正丁醇萃取,吸取1 μL萃取液进样,用Shimadzu GCMS-QP2010气相色谱-质谱联用仪进行GC-MS 分析。GC(TraceTM2000,CE Instrument Company)条件为,色谱柱:rxi-5ms石英毛细管柱(30 m×0.25 mm×0.25 μm);升温程序:初始温度50 ℃,以15 ℃/min 的速率升至180 ℃,保持5 min,再以10 ℃/min 升到220 ℃,保持15 min;载气:He(99.99%),柱流速0.8 mL/min;进样口温度:250 ℃。MS(Voyager,Finnigan Thermo-Quest Company)条件:电离方式EI;电子能量70 eV;离子源温度200 ℃;传输线温度250 ℃;扫描质量范围39~450 amu。采用Xcalibur 1.2 版本软件、NIST08.LIB和NIST08S.LIB谱图库兼顾色谱保留时间定性。
1.3 数据处理与分析
数据统计分析采用Excel 2007软件进行,方差分析采用SPSS 19.0进行,文中数据以均值±标准差表示。
2 结果与分析
2.1 白三叶根系分泌物对高羊茅和草地早熟禾种子萌发和幼苗生长的化感作用
由表1可知,经白三叶根系分泌物处理的高羊茅和草地早熟禾的种子萌发和幼苗生长均受到抑制,抑制程度不同。白三叶根系分泌物处理对高羊茅和草地早熟禾种子发芽率、发芽势、发芽指数、活力指数的抑制率分别为11.22%、5.79%、11.74%、27.45%和4.42%、19.17%、11.28%、21.43%。其中仅处理的高羊茅种子发芽率与对照相比差异显著(P<0.05),其余指标与对照相比差异均不显著。就2种受体植物来说,白三叶根系分泌物对高羊茅发芽率的抑制作用大于对发芽势的抑制作用,而对草地早熟禾发芽势的抑制作用大于对发芽率的抑制作用。白三叶根系分泌物处理后高羊茅和草地早熟禾苗高、根长均与对照差异显著(P<0.05),抑制率分别为44.76%、44.33%和33.22%、53.16%。白三叶根系分泌物对高羊茅苗高和根长的抑制作用相近,对草地早熟禾根长的抑制作用大于对其苗高的抑制作用。
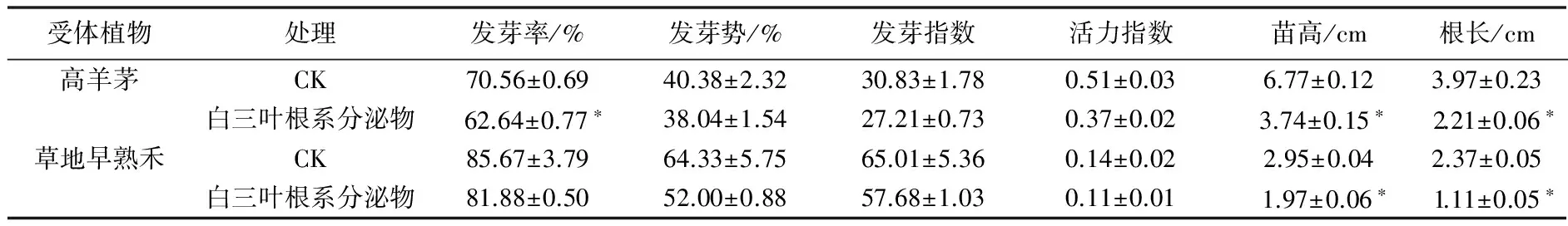
表1 白三叶根系分泌物对高羊茅和草地早熟禾种子萌发及幼苗生长的影响
注:*表示与对照相比差异显著(P<0.05),下同。
2.2 白三叶根系分泌物对高羊茅和草地早熟禾幼苗生理指标的化感作用
由表2可知,经白三叶根系分泌物处理后,高羊茅和草地早熟禾幼苗保护酶活性及可溶性蛋白含量均发生变化,变化程度不同。二者幼苗SOD、POD活性均受到抑制,抑制率在5.39%~28.96%。其中高羊茅幼苗SOD、POD活性与对照差异显著(P<0.05);草地早熟禾幼苗SOD活性与对照差异不显著,POD活性与对照差异显著(P<0.05)。高羊茅幼苗CAT活性经白三叶根系分泌物处理后与对照相比显著升高(P<0.05),而草地早熟禾则显著下降(P<0.05)。二者幼苗MDA含量均显著升高(P<0.05),分别较对照升高142.40%和297.59%,说明白三叶根系分泌物处理后受体植物膜脂过氧化作用加剧。可溶性蛋白是植物体内的渗透调节物质,经白三叶根系分泌物处理后的高羊茅和草地早熟禾幼苗体内可溶性蛋白含量均显著降低。
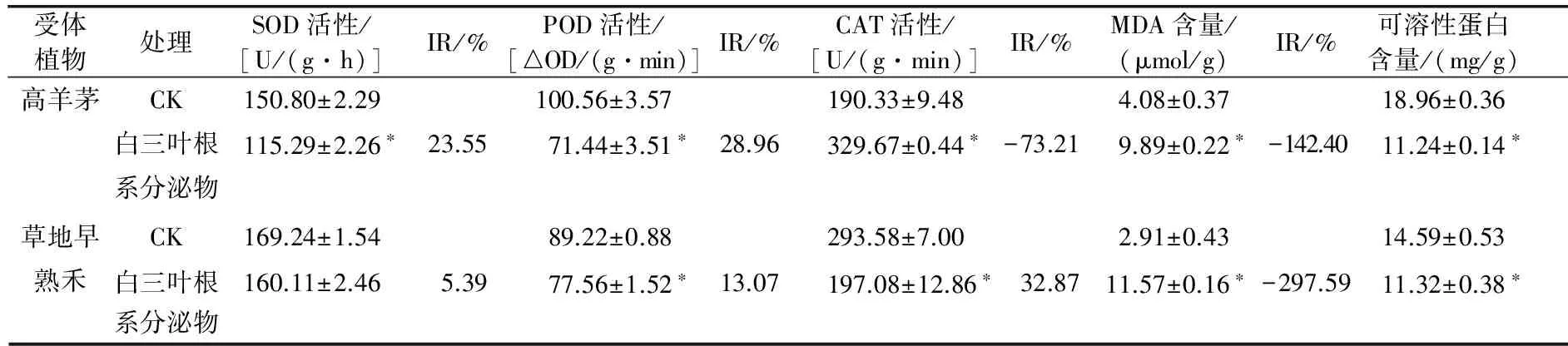
表2 白三叶根系分泌物对高羊茅和草地早熟禾幼苗生理指标的影响
2.3 白三叶根系分泌物的化学成分分析
白三叶根系分泌物提取液经正丁醇、乙酸乙酯、乙醚萃取后进行GC-MS分析,得到总离子流色谱图(图1—3)。由图1—3可见,不同萃取物中所含的物质成分有差异。经GC-MS联用仪标准质谱数据库NIST08.LIB和NIST08S.LIB的计算机检索,各组分分别鉴定出18、17、42种化合物,并采用面积归一化法确定了它们的相对含量(表3)。
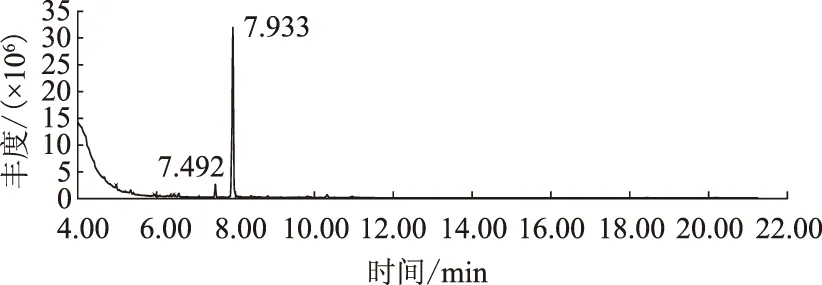
图1 白三叶根系分泌物正丁醇萃取相总离子流色谱图

图2 白三叶根系分泌物乙酸乙酯萃取相总离子流色谱图
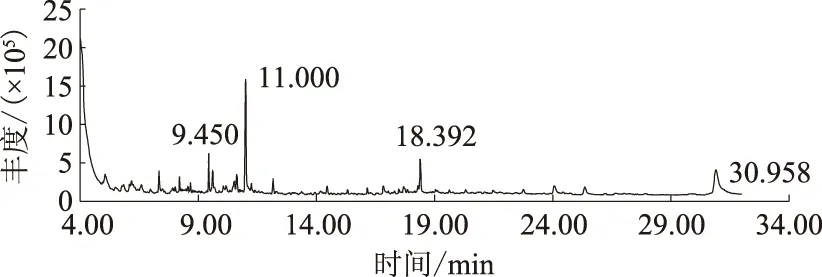
图3 白三叶根系分泌物乙醚萃取相总离子流色谱图
白三叶根系分泌物正丁醇萃取组分共鉴定出18种化合物,主要包含烷烃、烯烃、酸、醛、酰胺、酚、酯、酮、醚等化合物,其中含量较高的为紫薇缩醛(84.29%)、油酸酰胺(1.54%)、丁酸丁酯(1.05%)、叔丁醚(1.00%)、壬醛(0.78%)等物质。乙酸乙酯萃取组分共鉴定出17 种化合物,主要包含烃、酸、醛、酰胺、酚、含氮化合物类等,其中含量较高的为油酸酰胺(23.78%)、壬醛(13.65%)、硬脂酰胺(12.80%)、2,4-二叔丁基苯酚(10.04%)、2,2,4,6,6-五甲基庚烷(8.13%)等物质。乙醚萃取组分共鉴定出42种化合物,主要包含烷烃、烯烃、酸、醛、酰胺、酚、酯、醇、含氮化合物、含硫化合物、苯类等,其中含量较高的为2,6-二叔丁基对甲酚(19.08%)、油酸酰胺(11.29%)、十四烷(4.62%)、2,2,4,6,6-五甲基庚烷(4.54%)等物质。

表3 白三叶根系分泌物化学组分
3 结论与讨论
白三叶是已被证实的具有化感作用的植物种类之一,其常入侵其他禾本科草坪,破坏禾本科草坪的均一性和观赏性。本试验采用更接近自然状态下白三叶根系分泌物浓度的琼脂培养方法研究其对高羊茅和草地早熟禾的化感作用。结果表明,白三叶根系分泌物对高羊茅和草地早熟禾种子萌发和幼苗生长均有抑制作用,抑制程度不同,抑制率在4.42%~53.16%,说明在自然状态下白三叶根系分泌物含量对高羊茅和草地早熟禾具有化感抑制作用,与前人研究结果一致[8];只是不同受体不同指标在感受根系分泌物的化感作用时,表现的结果不一致。
抗氧化能力的提高与渗透调节物质的积累是植物在逆境下得以生存的2种重要机制[15]。植物体内SOD、POD和CAT等酶系的相互协调作用,使体内活性氧维持在一个较低的水平上,从而避免活性氧对膜脂造成伤害。关于白三叶根系分泌物中化感物质对抗氧化酶活性的影响,不同受体植物变化趋势有差异。经白三叶根系分泌物处理后,高羊茅和草地早熟禾幼苗SOD、POD活性均受到抑制,高羊茅幼苗CAT活性显著升高,而草地早熟禾幼苗CAT活性则显著下降,说明白三叶根系分泌物破坏了受体幼苗体内的保护酶活性平衡,使其对自由基的清除能力降低,而受体植物幼苗体内MDA含量均显著升高,则进一步表明受体植物质膜氧化加剧,细胞结构及生理功能被破坏。
在逆境中,植物水解作用增强,合成作用减弱[16];同时为保持细胞的渗透调节能力和保护细胞内某些酶的活性,植物细胞自身会积累一些渗透调节物质。白三叶根系分泌物处理使得受体植物幼苗可溶性蛋白含量均降低,这与前人研究结果一致[16]。有研究表明,逆境胁迫下植物体内可溶性糖含量增加[17],白三叶根系分泌物处理下受体植物体内的可溶性糖含量是否增加以及其与可溶性蛋白含量降低的关系尚不清楚。因此,逆境下植物体内可溶性蛋白的转化分解过程需进一步研究。
本研究分别用乙酸乙酯、正丁醇、乙醚进行萃取,采用GC-MS方法对白三叶根系分泌物化学成分进行分析,结果表明,在3种萃取相中,鉴定出的根系分泌物种类多少依次为:乙醚>正丁醇>乙酸乙酯,这是根系分泌物在不同的萃取剂中溶解程度不同导致的。
化感物质是一类具有生物活性的次生代谢物质,一般分子量较小,结构较简单。3种萃取相中共鉴定出66种化合物,有烷烃、烯烃、酸、醛、酰胺、酚、酯、醇、酮、醚、含氮、含硫化合物、苯类等。酚类物质为重要的水溶性化感物质[18],白三叶根系分泌物中酚类物质有2种,分别是2,6-二叔丁基对甲酚和2,4-二叔丁基苯酚,二者均是已经证实的具有化感作用的物质[19-20]。根系分泌物中鉴定出的壬醛[21]、邻苯二甲酸二丁酯[22-23]也已被证明对植物具有化感作用。根系分泌物中所含化合物种类最多的是烷烃,其化学性质极为稳定,不是生理活性物质,故成分中的烷烃类可能不是白三叶根系分泌物中的化感物质。有研究表明,硬脂酰胺对烟草没有直接的化感作用[24],其对禾草是否具有化感作用尚不清楚。紫薇缩醛在正丁醇相中含量较多,其是否具有化感作用尚不清楚。植物化感作用是几个或几类化感物质综合作用的结果,根据以上分析推测,白三叶根系分泌物中起化感作用的主要物质可能是酚类、酯类和醛,多种化感物质间具体的协同效应方式,还需进一步研究。
[1] 李剑峰,张淑卿,师尚礼,等.白三叶对禾草草坪的侵占性研究[J].现代农业科技,2008(22):93-94.
[2] 刘迎.白三叶草对杂草化感作用的初步研究[D].泰安:山东农业大学,2007.
[3] 朱旺生,沈益新.白三叶和高羊茅对青菜幼苗生长的化感抑制效应[J].草业学报,2004,13(5):106-111.
[4] 谢苑,高素萍.白三叶水浸液对高羊茅种子萌发及幼苗生长的影响[J].安徽农业科学,2008,36(9):3616-3618.
[5] 张来,张显强.白三叶提取液对3种植物种子萌发和幼苗生长的影响[J].种子,2011,30(2):21-25.
[6] 张晓芳,王金信,谢娜,等.白三叶草挥发物的化感作用及其化学成分分析[J].植物保护学报,2011,38(4):374-378.
[7] 梁静,程智慧,徐鹏,等.白三叶腐解液对5种草坪草的化感作用研究[J].草地学报,2011,19(2):257-263.
[8] 余婷,孟焕文,温艳斌,等.白三叶根系分泌物对5种草坪草的化感作用[J].草地学报,2013,21(4):729-736.
[9] 余婷.白三叶根系分泌物的化感作用研究[D].杨凌:西北农林科技大学,2013.
[10] 邵财,刘继永,张玉红,等.人参化感物质对其幼苗根尖解剖结构的影响[J].天津农业科学,2014,20(9):11-13.
[11] 程月琴,王红卫,段景勉,等.入侵杂草曼陀罗对作物化感机理的初步研究[J].河南农业大学学报,2011,45(2):215-219.
[12] 张志良.植物生理学实验指导[M].北京:高等教育出版社,2003.
[13] 赵世杰,许长成,邹琦,等.植物组织中丙二醛测定方法的改进[J].植物生理学通讯,1994,30(3):207-210.
[14] Bradford M M.A rapid and sensitive method for quantization of microgram quantities of protein utilizing the principle of protein dye binding[J].Analytical Biochemistry,1976,72:248-254.
[15] 王娟,李德全.逆境条件下植物体内渗透调节物质的积累与活性氧代谢[J].植物学通报,2001,18(4):459-465.
[16] 王硕,慕小倩,杨超,等.黄花蒿浸提液对小麦幼苗的化感作用及其机理研究[J].西北农林科技大学学报(自然科学版),2006,34(6):106-110.
[17] 高英志,王艳华,王静婷,等.草原植物碳水化合物对环境胁迫响应研究进展[J].应用生态学报,2009,20(11): 2827-2831.
[18] 曹璞,沈益新.狗牙根对5种禾本科杂草化感作用的研究[J].草地学报,2010,18(3):452-455.
[19] 周艳丽,程智慧.大蒜根系分泌物化感作用及化感物质的比较[J].西北农林科技大学学报(自然科学版),2012,40(2):116-120.
[20] 张新慧,张恩和,柴强,等.2,4-二叔丁基苯酚对啤酒花幼苗光合特性的影响[J].甘肃农业大学学报,2006,41(5):50-54.
[21] 韩宝瑞,黄耀阁,李向高.西洋参果肉中的六种发芽抑制物质[J].特产研究,2000,22(1):13-17.
[22] 张文明,邱慧珍,张春红,等.连作马铃薯不同生育期根系分泌物的成分检测及其自毒效应[J].中国生态农业学报,2015,23(2):215-224.
[23] 孙海燕,王炎.辣椒根系分泌的潜力化感物质对生菜幼苗抗氧化代谢的影响[J].植物生理学报,2012,48(9):887-894.
[24] 于会泳,申国明,高欣欣,等.烟田土壤化感物质研究[C]//中国烟草学会2012年学术年会论文集.南京:中国烟草学会,2012:189-195.
Allelopathic Effect and GC-MS Analysis of Root Exudates ofTrifoliumrepenseL.
WANG Xiaoying
(Department of Life Science,Tangshan Teachers College,Tangshan 063000,China)
The allelopathic effects of root exudates ofTrifoliumrepensL. on seed germination,seedling growth and seedling physiology of kentucky bluegrass and tall fescue were tested by agar culture in laboratory,aiming to approach whether the allelopathy effect exists in the invasion ofTrifoliumrepensL. to gramineous turfgrass.And the chemical components of the exudates were analyzed using GC-MS.The results showed that the root exudates ofTrifoliumrepensL. had allelopathic effects on seed germination and seedling growth of kentucky bluegrass and tall fescue,and the inhibition varied greatly,ranging from 4.42% to 53.16%.The exudates ofTrifoliumrepensL. reduced the activities of superoxide dismutase(SOD) and peroxidase(POD),as well as the content of soluble protein of the seedlings of kentucky bluegrass and tall fescue,and increased the content of malondialdehyde(MDA) of both seedlings.The activity of catalase(CAT) of the seedlings of kentucky bluegrass decreased,whereas that of the seedlings of tall fescue increased.Sixty six compounds in exudates ofTrifoliumrepensL. were identified after extracted by ethyl ether,ethyl acetate and n-butanol,including lageracetal,oleamide,nonanal,octadecanamide,2,4-di-tert-butyl-phenol,butylated hydroxytoluene,etal.We conclude that the allelopathy effect of root exudates is one of the reasons whyTrifoliumrepensL. invases to gramineous turfgrass.
allelopathic effect;TrifoliumrepensL.; tall fescue; kentucky bluegrass; root exudates; GC-MS
2015-11-02
唐山市科技计划项目(15130264a);唐山师范学院科学研究基金项目(2013D07)
王晓英(1984-),女,山西运城人,实验师,硕士,主要从事植物化感作用研究。E-mail:64979385@qq.com
S688.4
A
1004-3268(2016)05-0096-06

