高血压脑出血患者血清中IL-1β和TNF-α的表达及其与脑水肿的关系
张陇平,韩小芳,李 雅
(西安医学院附属宝鸡医院神经外科,陕西宝鸡 721006)
·经验交流·
高血压脑出血患者血清中IL-1β和TNF-α的表达及其与脑水肿的关系
张陇平,韩小芳,李 雅
(西安医学院附属宝鸡医院神经外科,陕西宝鸡 721006)
目的 探讨高血压脑出血患者血清中白细胞介素1β(IL-1β)、肿瘤坏死因子α(TNF-α)的表达水平,以及其与血肿周围脑水肿程度的关系。方法 选取2013年4月至2014年6月该院收治并确诊的高血压脑出血患者56例(观察组),同期在该院门诊行体检的健康志愿者28例(对照组)。采用酶联免疫吸附测定(ELISA)法检测外周血血清中IL-1β、TNF-α水平,血肿周围脑水肿程度采用无创脑水肿动态监护仪检测高血压脑出血患者出血侧电阻抗扰动系数。结果 观察组急性期血清IL-1β、TNF-α水平均明显高于恢复期及对照组(P<0.05),且恢复期血清TNF-α水平明显高于对照组(P<0.05);高血压脑出血后电阻抗扰动系数显著增高,且急性期较恢复期增高幅度大(P<0.05);观察组患者血清IL-1β、TNF-α水平与出血侧电阻抗扰动系数呈正相关(r=0.547、0.604,P<0.05)。结论 高血压脑出血急性期患者血清中IL-1β、TNF-α释放增加,IL-1β、TNF-α高水平与出血后脑水肿的形成有关。
颅内出血,高血压性;白细胞介素1β;肿瘤坏死因子α;脑水肿
脑水肿是影响高血压脑出血患者病情进展和转归的重要因素,严重时可危及患者生命。随着对脑出血血肿周围脑水肿带的病理及生理变化的深入研究,脑出血早期炎症反应及其继发性脑损害作用逐渐受到重视。已有多项动物实验研究表明,炎症反应介质白细胞介素1β(IL-1β)、肿瘤坏死因子α(TNF-α)与脑出血后继发性脑损害密切相关[1-2],而人类脑出血后血清IL-1β、TNF-α水平与脑水肿关系的研究报道较少。因此,本研究通过对高血压患者脑出血后血清IL-1β、TNF-α水平的检测,以探讨二者水平变化与脑水肿的关系,现报道如下。
1 资料与方法
1.1 一般资料 选取2013年4月至2014年6月本院收治的高血压脑出血住院治疗患者56例(观察组)。患者均符合1995年全国第四届脑血管病学术会议制订的高血压脑出血诊断要点,均行头颅CT或MRI证实。其中男29例,女27例;年龄36~72岁,平均(56.78±10.09)岁;出血量25~70 mL,平均(47.92±9.97)mL。患者均于发病24 h内住院治疗,均积极行常规止血、脱水治疗。排除非高血压脑出血、混合性卒中或出血性梗死、伴有严重心肝肾功能不全、严重肺部感染、糖尿病者。对照组选自本院同期门诊体检的健康志愿者28例,其中男16例,女12例;性别35~73岁,平均(55.82±10.05)岁,排除近期发生感染、具有高血压、高脂血症或糖尿病等卒中危险因素者。
1.2 方法
1.2.1 血清IL-1β、TNF-α水平检测 分别于高血压脑出血急性期(发病后7 d内)、恢复期(发病21 d后)各抽取空腹肘静脉血1次,健康志愿者于体检当天清晨空腹抽取肘静脉血1次。将采集的肘静脉血注入抗凝试管中,于4 ℃条件下置于离心机以速率3 000 r/min离心15 min,取上清液,采用酶联免疫吸附测定(ELISA)法检测IL-1β、TNF-α水平。IL-1β、TNF-α试剂盒均来自法国DIACLONE公司,具体操作严格按照IL-1β、TNF-α试剂盒说明书进行。
1.2.2 脑水肿检测 分别于高血压脑出血急性期、恢复期采用无创脑水肿动态监护仪(重庆市博恩科技有限公司)检测电阻抗扰动系数,间接反映脑水肿程度。采用驱动电极,刺激电流频率50 kHz,电流强度0.1 mA,连续测量出血侧脑半球的电阻抗值,转换为电阻抗扰动系数,电阻抗扰动系数越高,脑水肿程度越重[3]。健康志愿者于体检当天清晨单次测定后再持续检测3~6 h。

2 结 果
2.1 两组对象血清中IL-1β、TNF-α水平比较 56例高血压脑出血患者均于急性期入院,其中4例患者于发病21 d内死亡,22例于发病21 d内出院,30例于发病21 d后出院。观察组急性期血清IL-1β、TNF-α水平均明显高于恢复期及对照组,差异有统计学意义(P<0.05);观察组恢复期血清TNF-α水平明显高于对照组,差异有统计学意义(P<0.05),IL-1β与对照组比较差异无统计学意义(P>0.05),见表1。

表1 两组对象血清中IL-1β、TNF-α水平比较
a:P<0.05,与对照组比较;b:P<0.05,与观察组恢复期比较。
2.2 两组对象电阻抗扰动系数比较 观察组急性期患者出血侧电阻抗扰动系数为8.98±1.14,明显高于恢复期(8.12±1.07)和对照组(7.48±0.94),差异有统计学意义(P<0.05);观察组恢复期患者出血侧电阻抗扰动系数明显高于对照组,差异有统计学意义(P<0.05)。
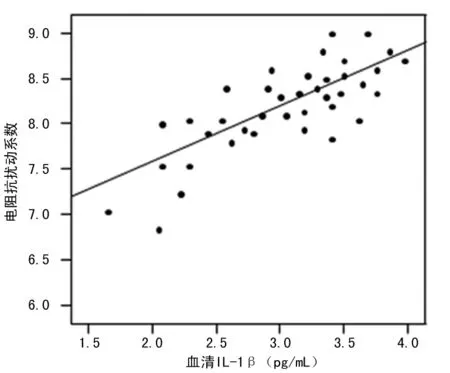
图1 患者血清IL-1β水平与电阻抗扰动系数的关系
2.3 观察组患者血清IL-1β、TNF-α水平与脑水肿程度的关系 观察组患者血清IL-1β、TNF-α水平与出血侧电阻抗扰动系数呈正相关(r=0.547、0.604,P<0.05),间接反映高血压脑出血患者血清IL-1β、TNF-α水平与脑水肿程度呈正相关,见图1、2。
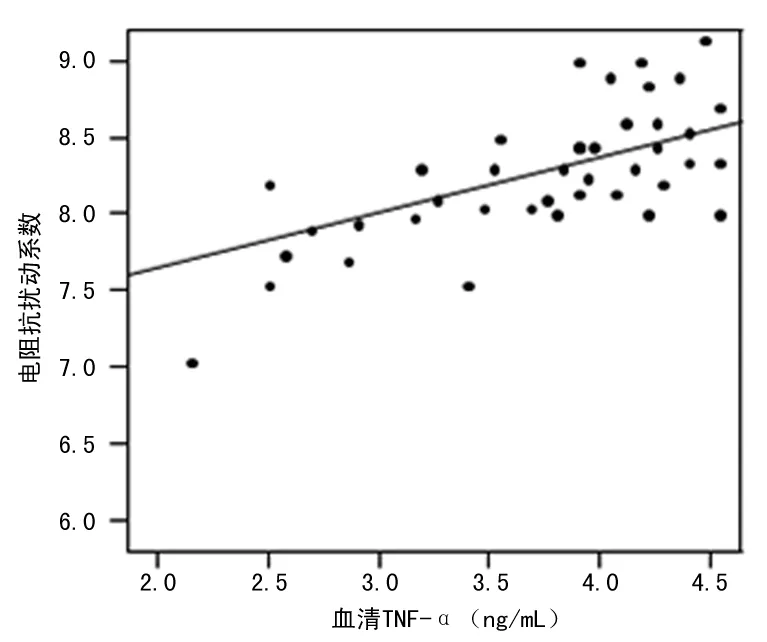
图2 患者血清TNF-α水平与电阻抗扰动系数的关系
3 讨 论
高血压脑出血后血肿及其周围脑组织炎症反应的发生、发展是引起颅内压增高并导致脑疝形成的重要因素,是造成继发性颅脑损伤的主要原因之一[4],直接影响高血压脑出血患者病情的发展和预后。IL-1β、TNF-α均为血肿及其周围脑组织炎症反应发生时表达的促炎细胞因子,共同参与了脑出血后脑水肿的病理、生理变化过程,并加重脑出血后继发性脑损伤[5]。
IL-1β是具有多向性生物功能的炎症介质,对炎症和免疫反应具有调节作用[6]。本研究结果显示,脑出血急性期患者血清IL-1β水平显著升高,恢复期降至正常水平。另外相关性分析显示,血清IL-1β水平与患者脑出血侧电阻抗扰动系数呈正相关。表明血清IL-1β与脑出血后脑水肿的形成密切相关,且血清IL-1β越高,反应脑出血后脑水肿程度越重。血清IL-1β水平显著升高是脑出血后炎症反应的重要标志[7],其促进脑出血后脑水肿程度加重的机制可能是通过刺激胶质细胞释放其他细胞因子和黏附因子促进炎症反应;同时可直接破坏血脑屏障,增加其通透性,加重外周白细胞浸润和脑出血早期形成的血管源性脑水肿,促进脑损伤的发展;通过刺激花生四烯酸的代谢产生过量的自由基和一氧化氮,从而增加神经毒性[8-10]。
TNF-α是一种多肽类细胞因子,主要由单核-巨噬细胞产生[11]。TNF-α具有广泛的生物学活性,正常生理情况下,正常水平的TNF-α对维持多种细胞的分化和成活具有重要作用,而病理情况下,其为有效的肿瘤杀伤因子和机体炎症及免疫应答的重要调节因子[12]。本研究结果显示,高血压脑出血患者血清TNF-α水平显著升高,且与出血侧电阻抗扰动系数呈正相关,提示血清中高水平TNF-α与出血后脑水肿的形成具有一定的关系。同时,本研究发现,高血压脑出血急性期患者血清TNF-α水平均明显高于健康志愿者,而恢复期患者血清TNF-α水平有所下降,但仍高于健康志愿者,表明TNF-α与脑出血急性期脑水肿的形成密切相关。随着脑出血后病程的延长和治疗,血肿周围炎症反应减退,脑损伤有所改善,因而患者血清TNF-α水平有所下降,而高血压动脉硬化、冠心病等病因导致恢复期血清TNF-α水平仍较高[13-14]。
综上所述,高血压脑出血急性期患者血清中IL-1β、TNF-α释放增加,两者参与了脑出血后炎症反应过程,促进脑水肿的形成。脑出血后适当的炎症反应有利于机体抵抗外界的损害,但过度的炎症反应可加重脑水肿,进而加重脑出血后病理损伤[15]。通过阻断或抑制炎性因子IL-1β和TNF-α的大量释放,可有效控制脑出血后炎症反应,以达到减轻脑水肿,进而减轻脑出血后病理损伤的目的,为临床提供新的、可行的治疗策略。
[1]游潮,陈浩,何俊,等.脑出血大鼠模型中血清IL-1β的表达与脑水肿关系及意义探讨[J].中风与神经疾病杂志,2014,31(4):307-309.
[2]齐向前,于明琨,卢亦成,等.创伤性脑水肿合并海水淹溺大鼠IL-1β和TNF-α表达的变化[J].第二军医大学学报,2008,29(8):990-993.
[3]张苓,张泉,陈礼刚,等.无创动态监测在开颅术后脑水肿的临床应用研究[J].重庆医科大学学报,2011,36(6):728-731.
[4]施清晓,吴钢.高血压脑出血后血肿周围脑水肿形成机制与治疗靶点[J].国际脑血管病杂志,2009,17(6):434-439.
[5]程娟,柯开富.脑出血后继发性脑损伤机制[J].国际脑血管病杂志,2010,18(10):787-791.
[6]乔智慧,黄秀兰,蔡娜莉,等.抵抗素及IL-1β在新生大鼠缺氧缺血性脑损伤中的表达及其意义[J].免疫学杂志,2010,26(12):1104-1106.
[7]孔渝菡,秦新月.不同缺血后处理对缺血再灌注大鼠脑内IL-1β、IL-6表达的影响[J].中国老年学杂志,2012,32(14):2984-2986.
[8]Wei P,You C,Jin H,et al.Correlation between serum IL-1beta levels and cerebral edema extent in a hypertensive intracerebral hemorrhage rat model[J].Neurol Res,2014,36(2):170-175.
[9]安利峰,胜利,吴昇祥,等.脑脊液IL-1β和TNFα-表达水平与出血性脑损伤预后的关系研究[J].中国免疫学杂志,2011,27(12):1085-1087.
[10]Wang Y,Jin S,Sonobe Y,et al.Interleukin-1β induces blood-brain barrier disruption by downregulating sonic hedgehog in astrocytes[J].PLoS One,2014,9(10):e110024.
[11]王宏,王文宏,游洋,等.高血压脑出血后血浆脂联素浓度变化及其与炎症因子相关性研究[J].南京医科大学学报:自然科学版,2012,32(3):378-381.
[12]王学慧,毛旭强.炎性反应与细胞凋亡在脑梗死后的动态变化及其机制[J].中国老年学杂志,2013,33(19):4771-4773.
[13]阳永东,周晓坤,杜怡庆,等.高血压脑出血患者血清肿瘤坏死因子-α水平的变化及临床意义[J].现代预防医学,2012,39(7):1741-1742.
[14]李琼,冯来会,刘伯语,等.高血压脑出血患者TNF-α表达与血肿周围组织细胞凋亡的关系[J].江苏医药,2014,40(14):1665-1667.
[15]Qureshi AI,Palesch YY,Martin R,et al.Effect of systolic blood pressure reduction on hematoma expansion,perihematomal edema,and 3-month outcome among patients with intracerebral hemorrhage:results from the antihypertensive treatment of acute cerebral hemorrhage study[J].Arch Neurol,2010,67(5):570-576.
10.3969/j.issn.1671-8348.2016.05.036
张陇平(1970-),副主任医师,大学本科,主要从事神经外科疾病的诊治研究。
R741
B
1671-8348(2016)05-0682-03
2015-06-09
2015-10-13)

