大鼠伏核注射甘丙肽对神经病理性痛的镇痛作用及其对星形胶质细胞活化的影响*
张筱敏,李崇阳,赵 敏,李 君,徐世莲△
(昆明医科大学:1.基础医学院生理学系,昆明 650500;2.第四附属医院肿瘤科,昆明 650021;3.基础医学院解剖学与组织胚胎学系,昆明 650500)
·论 著·
大鼠伏核注射甘丙肽对神经病理性痛的镇痛作用及其对星形胶质细胞活化的影响*
张筱敏1,李崇阳2#,赵 敏3,李 君1,徐世莲1△
(昆明医科大学:1.基础医学院生理学系,昆明 650500;2.第四附属医院肿瘤科,昆明 650021;3.基础医学院解剖学与组织胚胎学系,昆明 650500)
目的 探讨神经病理性痛大鼠伏核注射甘丙肽的镇痛作用及其对星形胶质细胞活化的影响。方法 左侧坐骨神经结扎构建神经病理性痛大鼠模型,伏核注射甘丙肽,测定伤害性热刺激和压力刺激诱发的后爪缩爪潜伏期(HWL),观察甘丙肽的镇痛作用;Western bolt法检测星形胶质细胞的特异性标志物-胶质原纤维酸性蛋白(GFAP)的表达,观察伏核注射甘丙肽对星形胶质细胞活化的影响。结果 左侧坐骨神经结扎引起大鼠双侧HWL缩短,且伏核GFAP的表达增加;神经病理性痛大鼠伏核注射甘丙肽引起双侧HWL延长,GFAP的表达减少。结论 伏核微量注射甘丙肽对神经病理性痛的镇痛作用可能通过抑制星形胶质细胞的活化来完成。
甘丙肽;伏核;星形胶质细胞;神经病理性痛;镇痛作用
在临床,由疾病和损伤引起的慢性疼痛已经成为影响健康的一个主要问题,而神经病理性痛是慢性疼痛中最为常见的一种。以往对疼痛的形成机制及其镇痛的研究多集中在神经元的作用上,但近几年的研究发现,胶质细胞(glial cells)参与了许多神经系统的疾病,这其中就包括了疼痛[1]。在神经元和胶质细胞之间存在着相互协作的关系,致使疼痛发生,且愈演愈烈[2]。本实验通过检测伏核(nucleus accumbens,NAc)星形胶质细胞(astrocytes)的特异性标志物-胶质原纤维酸性蛋白(glial fibrillary acidic protein,GFAP)的表达,进一步探讨星形胶质细胞在神经病理性痛的产生和调制中的作用。 甘丙肽(galanin)是一种29 aa(在人类中为30 aa)的多肽,它广泛分布于中枢神经系统与外周组织中,是一种以抑制性作用为主的神经肽[3-4]。1994年瑞典Hokfelt等[5]提出甘丙肽可能具有镇痛作用,是一种内源性镇痛物质。本课题前期研究也表明在正常大鼠和炎症大鼠的伏核注射甘丙肽具有镇痛作用[6-7]。但甘丙肽的镇痛作用机制不清,目前多认为甘丙肽通过激活其受体来完成作用[8]。伏核是一个重要的中枢镇痛部位。近年来,越来越多的研究报道伏核在痛觉信息的产生和调制中具有重要作用[9-11]。因此,本实验研究大鼠伏核注射甘丙肽对神经病理性痛的镇痛作用及对星形胶质细胞活化的影响,探索甘丙肽的镇痛作用是否通过抑制星形胶质细胞的活化来完成。
1 材料与方法
1.1 材料 (1)实验动物:实验选用雄性Sprague-Dawky大鼠40只,体质量180~250 g,由昆明医科大学实验动物中心提供,实验期间动物分笼饲养,自由取食和饮水,自然光照。实验采取各种措施以减小对动物的伤害,所有操作均符合国际疼痛研究协会(international association for the study of pain,IASP)[12]和昆明医科大学动物伦理委员会的规定。(2)实验药品:实验所用微量注射溶液均用生理盐水配制,0.5 nmol/L的甘丙肽(rat甘丙肽,Tocris,UK)。
1.2 方法
1.2.1 测量后爪缩爪潜伏期(hindpaw withdrawal latency,HWL) 实验使用热板智能仪(YLS-6B,济南益延科技有限公司) 测试热刺激诱发的HWL,温度维持在(52.0±0.2)℃[13-14]。将大鼠一侧后爪足底平放于热板,并保证大鼠整个足底充分接触热板,大鼠缩爪时间即为热刺激诱发的HWL。使用Randall Selitto(UGO Basile 37215,意大利)测试压力刺激诱发的HWL。 Randall Selitto的楔形压力阀压在鼠爪的爪背靠近脚趾处,踩住开关,步进马达推动砝码向前移动,此时施加在大鼠后爪上的压力以30 g/s的速度增加,读出大鼠后爪回缩时砝码所指的刻度,即为压力刺激诱发的HWL。实验前大鼠需进行5 d热板和Randall Selitto测试的训练,以使动物对伤害性刺激的HWL较为平稳,维持在3~6 s。
1.2.2 Western blot检测伏核GFAP的表达 将大鼠用4%异氟醚麻醉后断头取脑,提取伏核部位蛋白质,以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参,Western blot法检测GFAP的表达。经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),转膜后将膜以5%脱脂奶粉封闭1 h,加入洗膜缓冲液(tris buffered saline tween,TBST)稀释的多克隆GFAP抗体 (小鼠抗GFAP,1∶5 000,Millipore) 或者单克隆GAPDH抗体(小鼠抗GAPDH,1∶5 000,Millipore),4 ℃过夜 。 弃一抗,以 TBST洗涤3次,每次10 min。 加入TBST稀释的辣根过氧化物酶(horse reddish peroxidase,HRP)标记的相应二抗(1∶4 000,Pierce)中,室温孵育1 h。弃二抗,以TBST洗涤3次,每次10 min。显影和定影,用image J 软件分析条带。
1.2.3 神经病理性痛动物模型建立 将14只大鼠分为假手术组和坐骨神经结扎组,每组7只。两组大鼠均采用腹腔注射戊巴比妥钠(45 mg/kg)麻醉,在其左侧大腿中部暴露约8~10 mm长的坐骨神经;坐骨神经结扎组使用4号羊肠线轻度结扎神经,共结扎4圈,最后用4号丝线缝合皮肤[15];假手术组暴露坐骨神经后即缝合皮肤,不做神经结扎。术后14 d测定大鼠对伤害性热刺激和压力刺激诱发的HWL,并检测伏核GFAP的表达。
1.2.4 伏核埋管和微量注射方法 用45 mg/kg的戊巴比妥钠将大鼠麻醉,进行伏核内埋管[16]。将外径为0.8 mm的不锈钢套管垂直插入,使用牙科水泥将套管牢固固定。实验时用外径为0.4 mm的不锈钢管作注射管,注射时其尖端伸出套管1 mm,以1 μL/min的速度均匀推进1 μL的药物。
1.2.5 检测左侧坐骨神经结扎大鼠伏核注射甘丙肽对HWL和GFAP表达的影响 将26只大鼠坐骨神经结扎14 d后,分为生理盐水注射组(对照组)和0.5 nmol 甘丙肽注射组(甘丙肽组),每组13只,测定对照组或甘丙肽组第1、3、5天大鼠双侧HWL的变化,每次测定都在注射后15 min开始。行为学测定后迅速取伏核组织,检测GFAP的表达。

2 结 果
2.1 假手术组和坐骨神经结扎组大鼠HWL和伏核GFAP表达的比较 与假手术组比较,坐骨神经结扎组大鼠双侧HWL 缩短(热板测试:t左侧=10.91,P=0.000 1;t右侧=4.37,P=0.000 9。Randall Selitto测试:t左侧=5.87,P=0.000 1;t右侧=4.72,P=0.000 5),见图1。两组大鼠行为学测定后取伏核组织蛋白质,Western blot法测定GFAP的表达,与假手术组比较,坐骨神经结扎组GFAP的表达上调 (t=3.47,P=0.013),见图2。

a:P<0.01,与假手术组比较。
图1 假手术组和坐骨神经结扎组大鼠HWL的比较
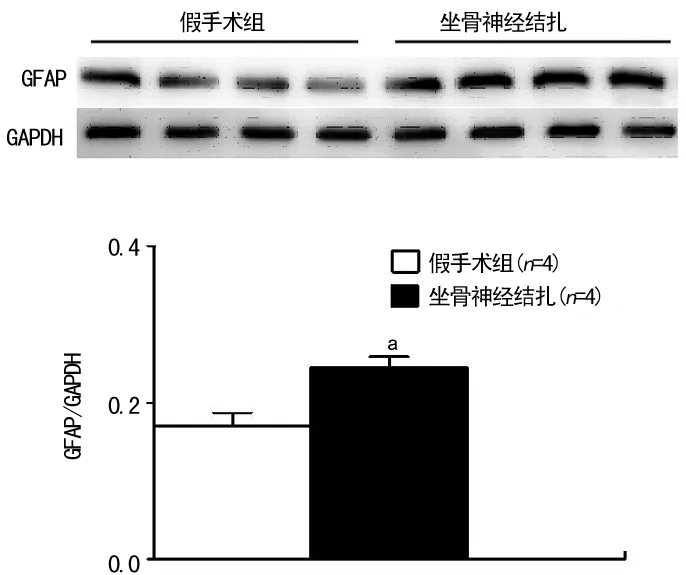
a:P<0.05,与假手术组比较。
图2 假手术组和神经结扎组大鼠伏核GFAP的表达
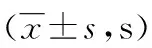
表1 对照组与甘丙肽组大鼠对热刺激引起的 HWL比较
a:P<0.05,b:P<0.01,与对照组比较。
2.2 对照组与甘丙肽组大鼠HWL和GFAP表达的比较 与对照组比较,甘丙肽组注射第1天(热板测试:t左侧=2.27、P=0.032 1,t右侧=3.45、P=0.002 1;Randall Selitto测试:t左侧=2.74、P=0.011 3,t右侧=4.43、P=0.000 2)、第3天(热板测试:t左侧=4.31、P=0.000 4,t右侧=7.08、P=0.000 1;Randall Selitto测试:t左侧=2.81、P=0.012 0,t右侧=4.17、P=0.000 6)、第5天(热板测试:t左侧=4.84、P=0.000 4,t右侧=3.23、P=0.007 2;Randall Selitto测试:t左侧=4.61、P=0.000 6,t右侧=4.52、P=0.000 7)HWL都延长(表1、2)。各组行为学测定结束后,取伏核组织蛋白质,Western blot检测注射甘丙肽第1、3、5天伏核GFAP的表达。与对照组比较,甘丙肽组第1天GFAP的表达(t=2.36,P=0.142 5)差异无统计学意义(P>0.05),但甘丙肽组第3天(t=2.93,P=0.042 9)和第5天(t=5.84,P=0.004 3)GFAP的表达下调,见图3。
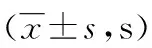
表2 对照组与甘丙肽组大鼠对压力刺激引起的 HWL比较
a:P<0.05,b:P<0.01,与对照组比较。

a:P<0.05,b:P<0.01,与对照组比较。
图3 对照组与甘丙肽组大鼠GFAP表达比较(n=3)
3 讨 论
虽然病理性神经痛是临床最常见的慢性疼痛之一,但因其产生机制不完全清楚,故仍缺乏有效的治疗措施。Bennett等[15]在1988年描述了结扎一侧坐骨神经干的动物模型,是目前公认的一种造成外周神经损伤、导致神经痛的一种常用方法。坐骨神经干结扎后,神经水肿引起血液供应障碍和外周轴突损伤,包括有髓神经纤维和无髓神经纤维,尤其是有髓神经纤维。结扎7~10 d后出现疼痛综合征,其特点是对热刺激和压力刺激的痛敏或触摸痛,痛敏高峰在14~28 d[15]。本实验研究观察到大鼠左侧坐骨神经结扎后14 d引起双侧HWL缩短,大鼠痛阈降低,产生神经痛。
近年来,有关胶质细胞在痛觉信息的调制中的作用的研究日渐增多。先前的研究报道脊髓星形胶质细胞的激活在炎症痛[17-18]和神经痛[19-20]的产生和维持中都具有重要作用。星形胶质细胞一旦被激活,便可释放多种神经活性物质,包括白细胞介素(IL)-1、IL-6、肿瘤坏死因子α、一氧化氮、前列腺素、兴奋性氨基酸、神经生长因子等,这些物质通过提高初级传入神经释放P物质、兴奋性氨基酸和增加产生疼痛物质的神经元的兴奋性来调节疼痛[21]。GFAP是星形胶质细胞的特异性标志蛋白[22],本实验研究显示左侧坐骨神经结扎引起大鼠伏核GFAP的表达上调,也提示伏核星形胶质细胞的活化在神经痛的产生和维持中具有重要作用。
自从1983年Tatemoto 等[23]从猪的小肠中分离提取了甘丙肽,越来越多的研究表明甘丙肽在痛觉信息的传递和调制中具有重要作用。有研究报道坐骨神经结扎大鼠中脑导水管周围灰质注射甘丙肽有镇痛作用[24]。Gu等[25]报道坐骨神经结扎大鼠下丘脑弓状核注射甘丙肽有镇痛作用。本实验研究表明左侧坐骨神经结扎大鼠伏核注射甘丙肽15 min后引起双侧HWL延长,提示甘丙肽在伏核对神经痛具有镇痛作用。
尽管研究表明甘丙肽具有镇痛作用,但其作用机制并不十分清楚,先前的研究表明甘丙肽受体的非选择性拮抗剂galantide能阻断甘丙肽的作用,提示甘丙肽受体的激活在甘丙肽的镇痛作用中具有重要作用[6,24,26]。有研究报道体外培养的大鼠星形胶质细胞有甘丙肽受体的表达[27],在体外星形胶质细胞的培养中甘丙肽具有转录激活因子的作用[28],这些结果提示甘丙肽和星形胶质细胞之间具有密切的联系。因此,本实验研究甘丙肽是否通过影响星形胶质细胞的活化来完成镇痛作用。结果显示坐骨神经结扎大鼠伏核注射甘丙肽第1天GFAP的表达差异无统计学意义(P>0.05),但注射甘丙肽第3、5天GFAP的表达下调,提示甘丙肽可能通过抑制星形胶质细胞的活化来发挥镇痛作用,但星形胶质细胞参与痛觉调制的作用可能是延迟性的[29]。
总之,本实验研究显示坐骨神经结扎致神经痛大鼠伏核星形胶质细胞被激活;甘丙肽在伏核对神经痛具有镇痛作用,且这一作用的产生可能涉及星形胶质细胞的活化被抑制。这些结果提示星形胶质细胞的活化在病理性神经痛的产生和维持中有重要作用,抑制星形胶质细胞的活化可能是治疗神经痛的有效措施。但对于这些变化的生理意义以及星形胶质细胞如何参与疼痛的调制等都需要进一步深入的研究。
[1]Scholz J,Woolf CJ.The neuropathic pain triad:neurons,immune cells and glia[J].Nat Neurosic,2007,10(11):1361-1368.
[2]Wang W,Mei X,Huang J,et al.Crosstalk between spinal astrocytes and neurons in nerve injury-induced neuropathic pain[J].PLoS One,2009,4(9):1-10.
[3]Ryan MC,Gundlach AL.Localization of preprogalanin messenger RNA in rat brain:identification of transcripts in a subpopulation of cerebellar purkinje cells[J].Neurosci,1996,70(3):709-728.
[4]Kask K,Berthold M,Bartfai T.Galanin receptors:involvement in feeding,pain,depression and Alzheimer′s disease[J].Life Sci,1997,60(18):1523-1533.
[5]Hokfelt T,Zhang X,Wiesenfeld-Hallin Z.Messenger plasticity in primary sensory neurons following axotomy and its functional implications[J].Trends Neurosci,1994,17(1):22-30.
[6]Xu SL,Li J,Zhang JJ,et al.Antinociceptive effects of galanin in the nucleus accumbens of rats[J].Neurosci Lett,2012,520(1):43-46.
[7]Yang Y,Zhang Y,Li XH,et al.Involvements of galanin and its receptors in antinociception in nucleus accumbens of rats with inflammatory pain[J].Neurosci Res,2015,97(8):20-25.
[8]Hobson SA,Bacon A,Elliot-Hunt CR,et al.Galanin acts as a trophic factor to the central and peripheral nervous systems[J].Cell Mol Life Sci,2008,65(12):1806-1812.
[9]Gear RW,Aley KO,Levine JD.Pain-induced analgesia mediated by mesolimbic reward circuits[J].J Neurosci,1999,19(16):7175-7181.
[10]Millan MJ,Audinot V,Honoré P,et al.Blockade of NMDA receptors in the nucleus accumbens elicits spontaneous tail-flicks in rats[J].Eur J Pharmacol,2000,388(1):37-47.
[11]Gu XL,Yu LC.Involvement of opioid receptors in oxytocin-induced antinociception in the nucleus accumbens of rats[J].The J of Pain,2007,8(1):85-90.
[12]Zimmermann M.Pathobiology of neuropathic pain[J].Eur J Pharmacol,2001,429(1/2/3):23-37.
[13]Yu LC,Hansson P,Lundeberg T.The calcitonin gene-related peptide antagonist CGRP8-37 increases the latency to withdrawal responses bilaterally in rats with unilateral experimental mononeuropathy,an effect reversed by naloxone[J].Neurosci,1996,71(2):523-531.
[14]Yu LC,Lundeberg S,An H,et al.Effects of intrathecal galanin on nociceptive responses in rats with mononeuropathy[J].Life Sci,1999,64(13):1145-1153.
[15]Bennett GJ,Xie YK.A peripheral neuropathy in rat that produces disorders of pain sensation like those seen in man[J].Pain,1988,33(1):87-107.
[16]Paxinos G,Watson C.The Rat Brain in Stereotaxic Coordinates[M].4th ed.Sydney:Academic Press,1998.
[17]Ji RR,Kawasaki Y,Zhuang ZY,et al.Possible role of spinal astrocytes in maintaining chronic pain sensitization:review of current evidence with focus on bFGF/JNK pathway[J].Neuron Glia Biol,2006,2(4):259-269.
[18]Wieseler-Frank J,Maier SF,Watkins LR,et al.Glial activation and pathological pain[J].Neurochem Int,2004,45(8):389-395.
[19]Gao YJ,Ji RR.Targeting astrocyte signaling for chronic pain[J].Neurotherapeutics,2010,7(4):482-493.
[20]Svensson CI,Brodin E.Spinal astrocytes in pain processing:non-neuronal cells as therapeutic targets[J].Mol Interv,2010,10(1):25-38.
[21]Watkins LR,Miligan ED,Maier SF.Spinal cord glia:new players in pain[J].Pain,2001,93(3):201-105.
[22]Gomes FC,Paulin D,Moura Neto V.GFAP modulation by growth factors and its implication in astrocyte differentiation[J].Braz J Med Biol Res,1999,32(5):619-631.
[23]Tatemoto K,Rokaeus A,Jornvall H,et al.Galanin-a novel biologically active peptide from porcine intestine[J].FEBS Lett,1983,164(1):124-128.
[24]Wang D,Lundeberg T,Yu LC.Antinociceptive role of galanin in periaqueductal grey of rats with experimentally induced mononeuropathy[J].Neurosci,2000,96(4):767-771.
[25]Gu XL,Sun YG,Yu LC.Involvement of galanin in nociceptive regulation in the arcuate nucleus of hypothalamus in rats with mononeuropathy[J].Behav Brain Res,2007,179(2):331-335.
[26]Sun YG,Gu XL,Lundeberg T,et al.An antinociceptive role of galanin in the arcuate nucleus of hypothalamus in intact rats and rats with inflammation[J].Pain,2003,106(1/2):143-150.
[27]Hösli E,Ledergerber M,Kofler A,et al.Evidence for the existence of galanin receptors on cultured astrocytes of rat CNS:colocalization with cholinergic receptors[J].J Chem Neuroanat,1997,13(2):95-103.
[28]Priller J,Haas CA,Reddington M,et al.Cultured astrocytes express functional receptors for galanin[J].Glia,1998,24(3):23-28.
[29]倪衡建,郁晓燕,高永静.外周炎性痛刺激诱导杏仁核内星形胶质细胞激活及细胞因子的表达[J].神经解剖学杂志,2008,24(2):161-165.
Analgesic effects of nucleus accumbens injection of galanin in rats with neuropathic pain and its influence on astrocyte activation*
ZhangXiaomin1,LiChongyang2#,ZhaoMin3,LiJun1,XuShilian1△
(1.DepartmentofPhysiology,SchoolofBasicMedicine,KunmingMedicalUniversity,Kunming,Yunnan650500,China;2.DepartmentofOncology,FourthAffiliatedHospital,KunmingMedicalUniversity,Kunming,Yunnan650021,China;3.DepartmentofAnatomyandHistoembryology,SchoolofBasicMedicine,KunmingMedicalUniversity,Kunming,Yunnan650500,China)
Objective To research the analgesic effect of nucleus accumbens (NAc) injection of galanin in rats with neuropathic pain and its influence on astrocyte activation.Methods The rat left sciatic nerve was ligated for constructing the neuropathic pain rat model.Galanin was injected by intra-NAc.The rat hindpaw withdrawal latency (HWL) induced by the damaging thermal and pressure stimuli was determined for researching the analgesic effect of galanin;the expression of glial fibrillary acidic protein (GFAP) as the astrocyte specific marker was detected by Western blot.The influence of NAc injection on the astrocyte activation was investigated.Results The bilateral HWL induced by the left sciatic nerve ligation was shortened,moreover the GFAP expression in NAc was upregulated;the intra-NAc injection of galanin induced an increase in bilateral HWL and a downregulation of GFAP expression.Conclusion The NAc microinjection of galanin may play the analgesic role on neuropathic pain via inhibiting the astrocyte activation.
galanin;nucleus accumbens;astrocytes;neuropathic pain;analgesic role
10.3969/j.issn.1671-8348.2016.05.003
国家自然科学基金资助项目(31360245,31460258);云南省应用基础研究计划项目基金(2011FZ111);云南省科技厅-昆明医科大学应用基础研究联合资金项目(2015FB012)。 作者简介:张筱敏(1984-),讲师,博士研究生,主要从事生理学科研与教学工作。 # 共同第一作者:李崇阳(1968-),主治医师,大学本科,主要从事肿瘤学的研究。△
,Tel:15887826597;E-mail:shilianxu@126.com。
R338.3
A
1671-8348(2016)05-0584-04
2015-08-13
2015-10-24)

