pcDNA3.1/mB7-H4-Fc在小鼠体内表达的实验性研究*
肖 欢,潘卫民,王超群,陈鸿颜,徐军发
(1.海南医学院附属医院核医学教研室,海南海口 570102;2.海南医学院附属医院核医学科,海南海口 570102;3.广东省医学分子诊断重点实验室,广东东莞 523808)
论著·基础研究
pcDNA3.1/mB7-H4-Fc在小鼠体内表达的实验性研究*
肖 欢1,2,潘卫民1,2,王超群2,陈鸿颜2,徐军发3
(1.海南医学院附属医院核医学教研室,海南海口 570102;2.海南医学院附属医院核医学科,海南海口 570102;3.广东省医学分子诊断重点实验室,广东东莞 523808)
目的 获得重组pcDNA3.1/mB7-H4-Fc在肝内的高效稳定表达。方法 采用流体动力法将表达mB7-H4-hIg融合蛋白的真核表达载体输注小鼠体内,通过酶联免疫吸附测定(ELISA)和实时定量PCR(RT-PCR)的方法,定量检测pcDNA3.1/mB7-H4-Fc在小鼠体的内表达。结果 经尾静脉注射的pcDNA3.1/mB7-H4-Fc能在肝组织中稳定表达,在48 h时间点分泌的量达到最高,最大量约120 ng/mL。结论 成功将pcDNA3.1/mB7-H4-Fc表达载体导入了小鼠肝脏,并获得了pcDNA3.1/mB7-H4-Fc在肝内的高效稳定表达。
B7-H4;pcDNA3.1/mB7-H4-Fc;流体动力学
B7-H4[1]分子自发现以来一直被公认为是T细胞活化一个强有力的负性调控因子。在机体的免疫应答过程中,B7-H4分子为免疫细胞的激活提供了刺激信号。活化的T细胞产生以白细胞介素(IL)-10[2]、IL-2[3]、IL-12[4]、肿瘤坏死因子-α(TNF-α)[5]、γ-干扰素(IFN-γ)[6]为主的细胞因子。而IL-2、TNF-α、IFN-γ等细胞因子介导的肝细胞免疫性损伤正是病毒性肝炎的重要致病机制。本研究通过流体动力法将重组pcDNA3.1/mB7-H4-Fc 表达载体导入小鼠体内,采用实时定量PCR(RT-PCR)和酶联免疫吸附测定(ELISA)法分别在mRNA水平和蛋白水平检测mB7-H4-hIg在体内的表达水平和表达持续时间。为进一步研究可溶性mB7-H4-hIg融合蛋白对Con A诱导肝损伤的保护作用奠定基础。
1 材料与方法
1.1 材料 (1)主要实验材料:真核表达质粒(pcDNA3.1/mB7-H4-hIg)[7]由广东医学院临床免疫学教研室赠送;DH5a宿主菌为本室保存;辣根过氧化物酶(HRP)标记山羊抗兔IgG二抗、羊抗人IgG多克隆抗体、HRP标记抗人IgG单抗和羊抗人IgG-HRP购自北京中山生物技术有限公司;TRIzol RNA提取试剂盒、逆转录试剂盒和PCR试剂盒购自美国Gibco公司;质粒小量提取试剂盒和无内毒素质粒大提试剂盒购自上海华舜生物工程有限公司;限制性内切酶和T4 DNA连接酶购自美国NEB公司。(2)实验动物:KM小鼠54只,8~10周龄,体质量18~22 g,雌雄各半,由海南医学院动物中心提供。
1.2 方法
1.2.1 实验动物分组 KM小鼠由本院实验动物中心常规饲养,整个实验过程自由摄食及饮水。根据注射成分不同分成3组,即注射空载体pcDNA3.1组(A组)、注射表达载体pcDNA3.1/mB7-H4-hIg组(B组)、空白对照组(C组)。将B组小鼠按照时间,共分成6个组,即8 h组(1组),24 h组(2组),48 h组(3组),72 h组(4组),96 h组(5组)及120 h组(6组)。
1.2.2 pcDNA3.1/mB7-H4-Fc在小鼠体内的表达 按去内毒素大提质粒试剂盒说明书提取质粒,将分别携带pcDNA3.1/mB7-H4-hIg重组质粒和pcDNA3.1空载体的DH5a宿主菌分别接种于500 mL Amp+ LB培养基,增菌至饱和状态。收集菌体,并提取质粒,紫外吸光度法鉴定备用。参照Liu等[8]的方法,质粒溶于生理盐水中,每只小鼠注入100 μg质粒,使终体积(mL)为小鼠体质量(g)的1/10,使用一次性无菌注射器通过尾静脉注入小鼠体内。注射前75%乙醇消毒,注射后用无菌棉球压迫止血。不同时间点即8、24、48、72 h,每组取3只小鼠,从尾静脉取血,每次每只约1 mL。不同时间点即8、24、48、72 h,引颈处死小鼠(每个时间点取3只小鼠),取肝脏(从相同解剖部位取材)用于总RNA提取。其中B组喂养有96、120 h时间点上的小鼠,但由于肝组织提取污染,没有进行总RNA提取。
1.2.3 RT-PCR检测pcDNA3.1/mB7-H4-Fc在小鼠体内的表达 经过体内表达的KM小鼠,分别在相应的时间点,即0、8、24、48、72 h,给予每只小鼠去眼球取血后(留血清备用),脱臼处死。无菌条件下,取肝组织,行RT-PCR检测pcDNAmB7-H4-Fc在小鼠体内的表达。取5 μL PCR产物,加1 μL 6×上样缓冲液混匀,于1.5%琼脂糖凝胶电泳。电压梯度为10 V/cm,电泳40 min。用1%EB染液染色15 min,置紫外线投射仪观察结果并拍照。采用Bandscan5.0软件进行图像分析,并以mB7-H4-hIg/β-actin mRNA 比值结果表示mB7-H4-hIg表达的水平。
1.2.4 融合蛋白mB7-H4-hIg分泌表达水平的检测 mB7-H4-hIg蛋白中含有人IgG Fc片断,因而检测Fc即可间接反映B7-H4-hIg 融合蛋白的量。本研究采用抗人IgG多克隆抗体作为捕获抗体包被酶标板,以人IgG作为标准品,并用HRP标记的抗人IgG单抗作为检测抗体,建立ELISA法检测mB7-H4-hIg融合蛋白水平。

2 结 果
2.1 双抗体夹心ELISA法的建立及pcDNA3.1/mB7-H4-Fc在体内的即时表达 本研究成功建立了检测mB7-H4-hIg的ELISA检测方法,最低检测浓度为6.25 ng/mL;线性范围为6.25~400.00 ng/mL,图1为不同浓度人IgG标准品检测绘制的标准曲线,r2=0.976 2,提示线性关系较好。采用建立好的ELISA检测技术,测定小鼠可溶性mB7-H4-hIg融合蛋白的表达,结果表明,经尾静脉注射的pcDNA3.1/mB7-H4-Fc能在体内表达,并且在48 h时间点分泌的量达到最高,最大量约120 ng/mL,见图2。
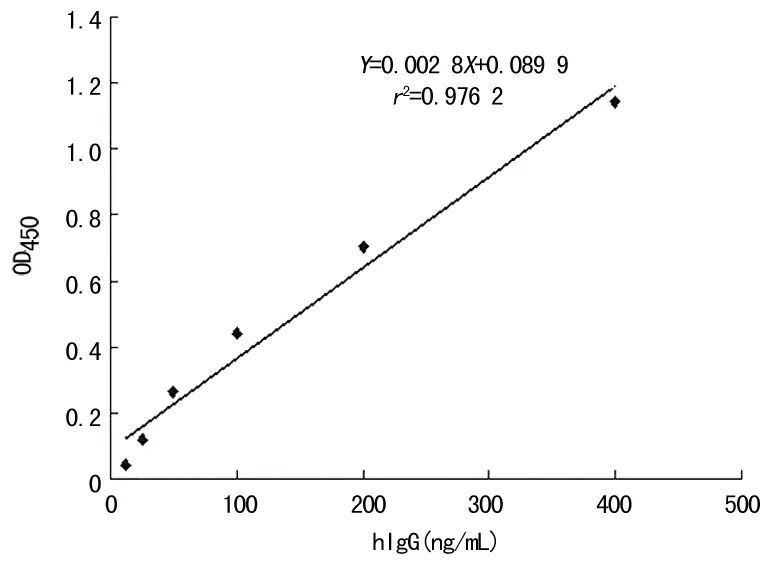
图1 可溶性整合蛋白mB7-H4-hIg的ELISA的标准曲线
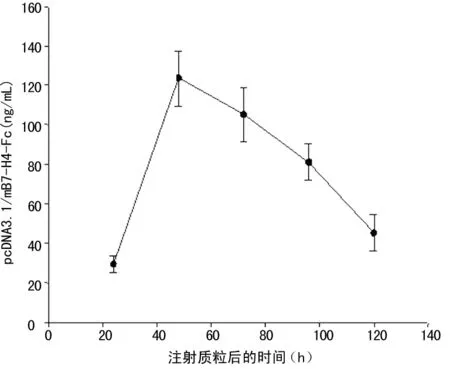
图2 转染后小鼠血清mB7-H4-hIg浓度测定结果
2.2 B7-H4-Fc mRNA在体内的即时表达 本研究采用RT-PCR技术,取小鼠肝脏用于总RNA提取。结果表明,pcDNA3.1/mB7-H4-Fc经小鼠尾静脉注射,能够在小鼠肝脏内表达mB7-H4-Fc融合基因mRNA,并在48 h达到最高值,见图3、4。
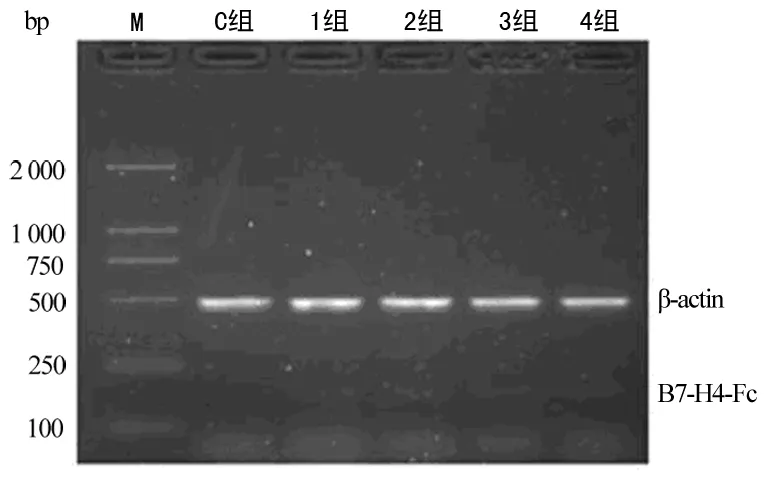
图3 RT-PCR检测小鼠肝脏mB7-H4-Fc mRNA表达
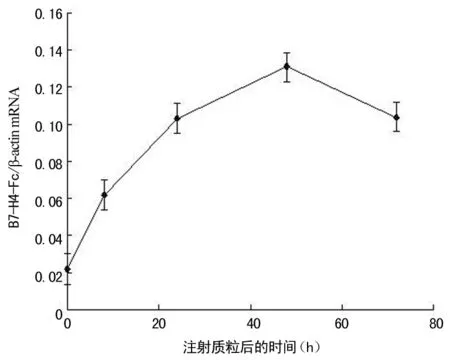
图4 小鼠肝脏mB7-H4-Fc mRNA的表达水平
3 讨 论
目前对B7-H4的研究主要集中在肿瘤方面,如卵巢癌[9]、胃癌[10]等,B7-H4在这些癌症中均高表达。B7-H4在炎症方面的研究较少,主要集中于类风湿关节炎[11]、肾病[12]等自身免疫性疾病。而关于B7-H4在自身免疫性肝炎中的表达情况尚少有相关研究。本研究思路为构建表达mB7-H4-hIg融合蛋白的真核表达载体,并将该载体输入小鼠体内,使其在肝脏内高表达可溶性mB7-H4-hIg融合蛋白。
B7-H4[1]在单核/巨噬细胞、T细胞、B细胞和树突状细胞(DC)表面可诱导性表达,但在其他组织中不表达或低表达,说明B7-H4的表达可能存在某种调控机制。为了成功表达可溶性mB7-H4-hIg融合蛋白,本研究采用了高水平真核表达系统pcDNA3.1(+)[7],pcDNA3.1(+)在多种哺乳类细胞中稳定转染或瞬时转染时可高表达目的蛋白。该表达系统HAI还具有CMV启动子和新霉素抗性基因供稳定表达筛选位点,尤其在COS-1和COS-7细胞中高表达。本课题前期研究已经成功地将人IgG1α Fc基因克隆到pcDNA3.1(+)多克隆位点,构建pcDNA3.1-hIg载体[7],该载体无信号肽,故不能单独表达人IgG1α Fc蛋白,但载体上游留取了多个酶切位点,为本研究表达带人IgG Fc标签的mB7-H4融合蛋白奠定了基础。带Fc标签的融合蛋白具有如下优点[7]:(1)Fc可形成链间二硫键,使目的蛋白形成二价,有利于受体交联,从而更有利于可溶性蛋白发挥生物学功能;(2)因携带Fc标签,可用蛋白A或蛋白G亲和层析法进行纯化;(3)使可溶性蛋白分子增大,在体内难以降解;(4)应用抗Fc抗体即可方便地检测。本研究在前期成功克隆mB7-H4基因的基础上,构建了表达可溶性mB7-H4-hIg的真核表达载体pcDNA3.1/mB7-H4-Fc,并转染COS-7细胞后成功表达了可溶性mB7-H4-hIg融合蛋白。
流体动力法(hydrodynamics-based procedure)是将裸露DNA转移到肝脏的较有效的办法,目前已应用于IL-10[13]、HDV[14]、肝细胞生长因子[15]等基因在肝脏的表达,结果表明流体动力法能非常高效的将这些基因转移到肝脏,并且获得高水平表达。本项研究通过流体动力法将重组pcDNA3.1/ mB7-H4-Fc 表达载体导入小鼠体内,采用RT-PCR和ELISA检测法分别在mRNA水平和蛋白水平检测mB7-H4-hIg在体内的表达水平和表达持续时间。采用建立好的ELISA检测技术,测定小鼠可溶性mB7-H4-hIg融合蛋白的表达,结果表明,经尾静脉注射的pcDNA3.1/mB7-H4-Fc能在体内表达,并且在48 h时间点分泌的量达到最高,最大量约120 ng/mL。采用RT-PCR技术,取小鼠肝脏用于总RNA提取。结果表明,pcDNA3.1/mB7-H4-Fc经小鼠尾静脉注射,能够在小鼠肝脏内表达mB7-H4-Fc融合基因mRNA,也在48 h达到最高值。这为进一步研究可溶性mB7-H4-hIg融合蛋白对Con A诱导肝损伤的保护作用奠定基础。
[1]Sica GL,Choi IH,Zhu G,et al.B7-H4,a molecule of the B7 family,negatively regulates T cell immunity[J].Immunity,2003,18(6):849-861.
[2]He C,Qiao H,Jiang H,et al.Heinhibitoryrole of b7-h4 inantitumor immunity:association with cancel progression and survival[J].Clin Dev Immunol,2011,20(11):695-704.
[3]Sica GL,Choi IH,Zhu G,et al.B7-H4,amolecule of the B7 family,negatively regulates T cell immunity[J].Immunity,2003,18(6):849-861.
[4]Wang X,Hao J,Metzger DL,et al.B7-H4 treatment of T cells in-hibits ERK,JNK,p38,and AKT activation[J].PLoS One,2012,7(1):28-32.
[5]Zhu G,Augustine MM,Azuma T,et al.B7-H4-deficient mice display augmented neutrophil-mediated innate immunity[J].Blood,2009,113(8):1759-1767.
[6]Chen L.Co-inhibitory molecules of the B7-CD28 family in the control of T cell immunity[J].Nature Rev Immunol,2004,4(6):336-347.
[7]徐军发,袁春雷,杨衡,等.小鼠B7-H4基因克隆及真核表达载体的构建[J].细胞与分子免疫学,2007,23(7):665-667.
[8]Zhang G,Budkar V,Wolff JA.High levels offoreigngene expression in hepatoeytes after tail vein injeetions of naked plasmid DNA.Hum[J].GeneTher,2011,10(10):1735-1737.
[9]Zhang LL,Shao SL,Wu Y.Expression of osteopontin and B7-H4 in epithelial ovarian neoplasm and their significance[J].Clin J Cancer,2010,29(1):25-29.
[10]Arigami T,Uenosono Y,Hirata M,et al.Expression of B7-H4 in blood of patients with gastric cancer predicts tumor progression and prognosis[J].Surg Oncol,2010,102(7):748-752.
[11]郭国宁,向强,文亮,等.B7-H4在类风湿关节炎组织内的表达及分布研究[J].现代免疫学,2011,31(2):130-134.
[12]俞大亮,厉小梅,王喜梅,等.共刺激分子B7-H4在狼疮性肾炎肾组织及血清中的表达[J].安徽医学,2012,33(7):793-796.
[13]Jiang J,Yamato E,Miyazaki J.Intravenous delivery of naked plasmid DNA for in vivo cytokine expression[J].Biochem Biophys Res Commun,2001,289(5):1088-1092.
[14]Jiang J,Yamato E,Miyazaki J.Intravenous delivery of naked plasmid DNA for in vivo cytokine expression[J].Bioehem Biophys Res Commun,2011,289(5):1088-1092.
[15]Miao CH,Ohashi K,Patijn GA,et al.Inclusion of the hepatie locus control region,an intron,and untranslated region increases and stabilizes hepatie factor IX gene expression in vivo but not in vitro[J].Mol Ther,2013,1(6):522-532.
Experimental study of pcDNA3.1/mB7-H4-Fc expression of mice in vivo*
XiaoHuan1,2,PanWeimin1,2,WangChaoqun2,ChenHongyan2,XuJunfa3
(1.TeachingandResearchingSectionofNuclearMedicine;2.DepartmentofNuclearMedicine,AffiliatedHospitalofHainanMedicalCollege,Haikou,Hainan570102,China;3.GuangdongProvincialKeyLaboratoryofMedicalMolecularDiagnosis,Dongguan,Guangdong523808)
Objective To obtain efficient and stable expression of recombination pcDNA3.1/mB7-H4-Fc in liver.Methods The eukaryotic expression vector for expressing mB7-H4 fusion protein was infused into the mouse body by adopting the hydrodynamic method.ELISA and real-time RT-PCR were used to quantitatively detect the pcDNA3.1/mB7-H4-Fc expression in mouse.Results The pcDNA3.1/mB7-H4-Fc by via tail vein injection could be stably expressed in liver tissue,which reached the highest at time point of 48 h,the maximal amount was about 120 ng/mL.Conclusion The pcDNA3.1/mB7-H4-Fc expression vector is successfully guided into the mouse liver and efficient and stable expression of pcDNA3.1/mB7-H4-Fc in liver is obtained.
B7-H4;PcDNA3.1/mB7-H4-Fc;hydrodynamics-based procedure
10.3969/j.issn.1671-8348.2016.05.006
海南省卫生厅科研基金资助项目(琼卫2010-3);海南省自然科学基金资助项目(309393)。 作者简介:肖欢(1976-),副主任医师,硕士研究生,主要从事分子探针及肿瘤免疫逃逸的研究。
R392.12
A
1671-8348(2016)05-0595-03
2015-05-08
2015-10-16)

