喜炎平注射液辅助治疗对支原体肺炎患儿的临床效果观察
林敏姿,郑映,朱小舟
(1.温州医科大学附属第二医院 药剂科,浙江 温州 325000;2.温州医科大学附属第二医院 儿科,浙江 温州 325000)
喜炎平注射液辅助治疗对支原体肺炎患儿的临床效果观察
林敏姿1Δ,郑映1,朱小舟2
(1.温州医科大学附属第二医院 药剂科,浙江 温州 325000;2.温州医科大学附属第二医院 儿科,浙江 温州 325000)
目的 探究喜炎平注射液辅助治疗对支原体肺炎患儿血清Clara细胞分泌蛋白、降钙素原及免疫炎性因子水平的影响。方法 选取2014年10月~2015年8月温州医科大学附属第二医院儿科收治的支原体肺炎患儿72例,根据随机对照表分为对照组和实验组,各36例,2组均实施常规治疗及对症治疗,对照组给予乳糖酸红霉素,阿奇霉素治疗;实验组在对照组的基础上联合喜炎平注射液,2组患者均治疗2个疗程。治疗结束后对比分析2组临床疗效、C反应蛋白(CRP)、降钙素原(PCT)、Clara细胞分泌蛋白(CCSP)、白介素-6(IL-6)及治疗期间不良反应发生情况。结果 治疗后,与对照组比较,实验组临床总有效率较高(P<0.05),实验组患者CRP、PCT、IL-6水平较低(P<0.05),Clara细胞分泌蛋白水平较高(P<0.05),实验组不良反应总发生率8.33%显著低于对照组19.44%(P<0.05)。结论 喜炎平注射液辅助治疗对支原体肺炎患儿的临床疗效显著,能显著提高血清Clara细胞分泌蛋白水平,降低CRP、PCT、IL-6水平,改善临床症状,且安全性高。
喜炎平注射液;辅助治疗;支原体肺炎患儿;Clara细胞分泌蛋白;C反应蛋白;降钙素原;白介素-6
支原体肺炎(mycoplasma pneumoniae pneumonia,MPP)是由肺炎支原体间质病变导致的一种急性呼吸道感染性疾病,患者出现发热、轻度鼻塞、咽部耳鼓膜充血、流涕、淋巴结肿大及斑丘疹、红疹等临床表现[1]。本病多发于青少年或儿童,近年发病呈低龄趋势,且其发病率逐年增高,严重威胁患儿身体健康,影响其健康成长[2]。研究显示[3],关于肺炎支原体肺炎发病机制的猜想更倾向于免疫学说,呼吸道上皮细胞吸附、免疫功能不全及病原体侵入机体。有研究发现[4],血清降钙素原、Clara细胞分泌蛋白、IL-6水平可有效检测早期肺炎支原体肺炎。喜炎平注射液是一种以穿心莲内酯总酯磺化物为主要成分的中药制剂,消炎、抗病毒功效较高,不产生耐药性,具有不良反应小、安全性高的优点[5]。为缓解患者病痛,改善症状,本研究以72例支原体肺炎患儿为研究对象,探究喜炎平注射液辅助治疗对支原体肺炎患儿血清Clara细胞分泌蛋白、CRP、PCT及IL-6水平影响,现报道如下。
1 资料与方法
1.1 一般资料 选取2014年10月~2015年8月温州医科大学附属第二医院儿科收治的支原体肺炎患儿72例,年龄 3~11岁,平均(5.83±0.62)岁,根据随机数字法随机分为实验组和对照组,各36例,2组患者一般资料比较差异无统计学意义。本研究经患者或其监护人知情同意并签署知情同意书,经本院医学伦理委员会审核批准。
纳入标准:参照《儿童社区获得性肺炎管理指南》[6]中关于支原体肺炎诊断标准拟定如下标准:①起病急缓不一,多数有发热,可高可低,发病初起出现乏力、鼻翼扇动、恶心、口干、刺激性干咳,继而严重呼吸窘迫、拒食或者脱水征、意识障碍;②肺部听诊呼吸音降低,或闻及中湿啰音,胸壁吸气性凹陷,呼吸音增粗或少许喘鸣音;③X线胸显示肺纹理增粗,存在斑片状阴影,甚至波及节段;④部分患儿血沉速度加快,白细胞数增加;抗体检测MP-Ab-IgM阳性,寒冷凝集≥1:32;⑤年龄<14岁,病程≤30 d。
排除标准:①对本实验药物过敏者,先天性或继发性免疫抑制或缺陷者;②既往患支气管哮喘、反复呼吸道感染、支气管肺发育不全、慢性肺疾病、肾脏或肝脏疾病、心血管疾病及结缔组织疾病等重大基础性疾病者;③混合感染者(入院7 d内发现血、尿、痰细菌培养或病毒检测阳性);④患者或其监护人不同意参与本研究。
1.2 方法
1.2.1 治疗方法:所有患者入院后均根据其年龄、病情及病原学检查结果给予对症治疗,抗感染、纠正酸碱离子平衡、补液、咨询病史、常规体格检查及完善入院资料等常规治疗。对照组给予注射用乳糖酸红霉素(大连美罗大药厂,国药准字:H21021678)20 mg/(kg·d)静脉滴注,1次/天,7 d为1个疗程,口服注射用阿奇霉素(辰欣药业股份有限公司,国药准字:H20066776)10 mg/(kg·d),1次/天,一个周期为3 d。实验组在对照组的基础上联合喜炎平注射液(江西青峰药业有限公司,国药准字:Z20026249)0.2 mg/(kg·d)+5%葡萄糖注射液236 mL,1次/天,7 d为1个疗程。2组患者均治疗2个疗程。
1.2.2 疗效评定标准[7]:痊愈:呼吸恢复正常,肺部听诊湿啰音消失及X线检查肺部炎症阴影吸收,发热、咳嗽等症状均完全消失;显效:呼吸恢复正常,肺部听诊干湿啰音消失,X线检查肺部炎症阴影基本吸收,症状体征均显著改善;有效:呼吸基本恢复正常,肺部听诊干湿啰音减少,X线检查肺部部分阴影吸收,症状体征部分缓解;无效:症状体征无明显变化或加重,肺部听诊及X线检查肺部炎症阴影仍存在。总有效率=[(痊愈例数+显效例数+有效例数)/本组总例数]×100%。
1.2.3 血清CRP、PCT、IL-6、Clara细胞分泌蛋白水平检测:分别于治疗前后,采集静脉血5 mL至不抗凝管中,静置2 h后,2 000 r/min 条件下离心10 min,分离上层血清,-20 ℃冰箱保存待测。采用免疫透射比浊法,应用日本日立7170全自动生化仪(北京富众科技发展有限公司)检测CRP、PCT水平;采用双抗体法夹心酶联免疫吸附(ELISA)法检测血清IL-6、Clara细胞分泌蛋白水平。试剂盒均购于北京博奥森生物技术有限公司。
1.2.4 不良反应情况:治疗期间,密切观察记录2组患者不良反应情况。

2 结果
2.1 2组患者一般资料比较 2组患者年龄、病程、心率、血压一般资料比较差异无统计学意义。见表1。
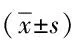
表1 2组患者一般资料比较Tab.1 Comparison of the general infromations between two groups (±s)
2.2 2组患者临床疗效比较 治疗后,实验组患者临床总有效率显著高于对照组,2组比较差异具有统计学意义(P<0.05)。见表2。
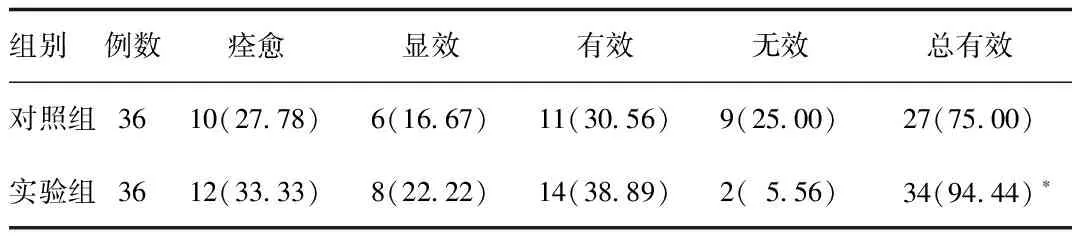
表2 2组患者临床疗效比较[n(%)]Tab.2 Comparison of clinical effect between two groups[n(%)]
*P<0.05,与对照组比较,compared with control group
2.3 2组患者血清PCT、CRP水平比较 治疗前,2组患者血清PCT、CRP水平比较无显著差异;治疗后,2组血清PCT、CRP水平均显著下降(P<0.05),且实验组血清PCT、CRP水平显著低于对照组(P<0.05)。见表3。

表3 2组患者血清PCT、CRP水平比较Tab.3 Comparison of serum PCT and CRP levels between two groups (±s)
*P<0.05,与同组治疗前比较,comparedwiththesamegrouppre-treatment;#P<0.05,与对照组比较,comparedwithcontrolgroup
2.4 2组患者血清Clara细胞分泌蛋白水平比较 治疗前,2组患者血清Clara细胞分泌蛋白水平比较无显著差异;治疗后,2组血清Clara细胞分泌蛋白水平均显著升高(P<0.05),且实验组血清Clara细胞分泌蛋白水平显著高于对照组(P<0.05)。见表4。
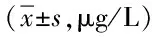
表4 2组患者血清Clara细胞分泌蛋白比较Tab.4 Comparison of serum CCSP levels between two groups (±s,μg/L)
*P<0.05,与同组治疗前比较,comparedwiththesamegrouppre-treatment;#P<0.05,与对照组比较,comparedwithcontrolgroup
2.5 2组患者血清IL-6水平比较 治疗前,2组患者血清IL-6水平比较无显著差异;治疗后,2组血清IL-6水平均显著降低(P<0.05),且实验组血清IL-6水平显著低于对照组(P<0.05)。见表5。
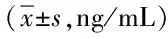
表5 2组患者血清IL-6水平比较Tab.5 Comparison of serum IL-6 levels between two groups (±s,ng/mL)
*P<0.05,与同组治疗前比较,comparedwiththesamegrouppre-treatment;#P<0.05,与对照组比较,comparedwithcontrolgroup
2.6 不良反应 治疗期间,实验组出现头痛1例,胃纳减退1例,皮疹1例,总不良反应发生率为8.33%(3/36),停药后不良反应均消失;对照组出现1例头痛,1例胃绞痛,2例皮疹,1例嗜酸粒细胞增多,2例恶性呕吐,总不良反应发生率为19.44%(7/36)。与对照组比较,实验组不良反应发生率显著较低(P<0.05)。
3 讨论
支原体肺炎是急性肺部感染的一种,支原体是介于病毒和细菌之间的一种致病性微生物。近年来其感染源已成为社区获得性肺部疾病的主要致病菌,多通过口、鼻等通道经空气传播,引起小范围流行性感染,儿童青少年多见,秋冬季发病较多[8]。占肺炎发病率9%,严重者可导致死亡[9]。每隔3~7年发生一次地区性流行,持续时间较长,很多门诊病人症状较轻,如不进行血清学检查,极易出现漏诊。近年来,由于儿童免疫力较低,是易感群体,肺炎支原体肺炎的发病率逐渐增加,已成为医学界的关注重点[10]。临床治疗首选大环内脂类抗生素,多为红霉素,临床疗效较高,但严重的胃肠道刺激及较低的耐受性,使机体内血胆红素和转氨酶水平升高,造成患者预后较差,产生耐药菌,病情易反复[11]。喜炎平注射液能够调节机体免疫功能、提高应激能力,产生高度药物敏感性,且临床不良反应较低;通过,抑制炎症发应过程中毛细血管通透性增强,对多种病原菌的灭活及抑制作用较高;同时增强白细胞、中性粒细胞及巨噬细胞吞噬病毒细菌的功能,使血清溶菌酶水平增高,刺激免疫球蛋白的分泌合成,增强机体免疫力[12-13]。治疗后,与对照组相比,实验组临床总有效率较高(P<0.05),实验组不良反应发生率为8.33%,显著低于对照组19.44%(P<0.05),证实喜炎平注射液辅助治疗对支原体肺炎患儿的临床疗效显著,安全性高。
研究表明[14],降钙素原(pro-calcitonin,PCT)、C反应蛋白(C reactive protein,CRP)及免疫功能可有效检测早期肺炎支原体肺炎。PCT由甲状腺、神经内分泌细胞、肺以及肝脏等分泌产生的炎性细胞因子,用于临床细菌感染辅助诊断,在肺炎的早期诊断中阳性检出率较高,可作为肺炎的早期诊断指标。CRP是一种具有激活巨噬细胞,进而激发巨噬细胞吞噬,降解外来细菌和异物的时相反应蛋白[15]。研究显示[16],肺炎患者血清CRP水平随着肺炎的发展而升高。本研究结果显示,与对照组比较,实验组血清PCT、CRP水平较低(P<0.05),提示喜炎平注射液辅助治疗能够有效改善支原体肺炎患儿病情,抑制疾病继续发展。
Clara细胞分泌蛋白(Clara cell secretory protein,CCSP)是由Clara细胞分泌分布于气道远端的的小分子蛋白,具体缓解远端呼吸道损伤的作用。相关研究显示[17],呼吸道的损伤程度及肺-血屏障的完整程度可以由血清中CCSP浓度水平反映,因此可作为支原体肺炎抗炎情况的诊断标准。白介素6(interleukin 6,IL-6)是临床重要的促炎细胞因子,其作用与呼吸系统疾病、肿瘤以及肾脏疾病等紧密相连。有研究表明[18],肺炎小儿气管黏膜受侵后,血清中IL-6水平升高,IL-6可作为诊断肺炎的敏感指标。本研究结果显示,经喜炎平注射液辅助治疗后患者血清Clara细胞分泌蛋白水平显著高于对照组(P<0.05),血清IL-6水平显著低于对照组(P<0.05),证实喜炎平注射液辅助治疗对支原体肺炎患儿显著降低IL-6水平,提高Clara细胞分泌蛋白水平,抗炎作用良好。
本研究通过对本院呼吸科收治的支原体肺炎患儿72例的临床疗效、CRP、PCT、CCSP、IL-6及不良反应进行研究,证实喜炎平注射液辅助治疗对支原体肺炎患儿具有显著的临床疗效,显著升高血清Clara细胞分泌蛋白水平,降低IL-6水平,改善临床不良反应症状,具有较高的安全性。在以后的研究中,本研究组将从药理学方面进一步探讨本实验试验结果。
[1] Youn YS,Lee KY. Mycoplasma pneumoniae pneumonia in children[J].J Korean pediat, 2012,55(2):42-47.
[2] 马香,丁明杰,赵秀侠,等.不同胸部影像学表现的肺炎支原体肺炎儿童的肺功能变化特征[J].中国当代儿科杂志,2014,16(10):997-1000.
[3] 姚艳青,王子威,丁瑛雪,等.支肺合剂联合西药对支原体肺炎患儿症状及体征的影响[J].中国中西医结合杂志,2014,34(5):522-525.
[4] Chen ZR,Zhang GB,Wang YQ,et al.Soluble B7-H3 elevations in hospitalized children with Mycoplasma pneumoniae pneumonia[J].Diagn Micr Infec Dis,2013,77(4):362-366.
[5] 苏海燕,金尾静,张海邻,等.支气管肺炎合并肺栓塞一例临床分析[J].中华儿科杂志,2012,50(2):151-154.
[6] 陆权.儿童社区获得性肺炎管理指南 (试行)(上)[J].中华儿科杂志,2007,45(2):83-90.
[7] 李旭斌,李锁更,张贤.小儿支原体肺炎 82 例临床分析[J].基层医学论坛,2014,18(29):3965-3966.
[8] Wood PR,Hill VL, Burks ML,et al.Mycoplasma pneumoniae in children with acute and refractory asthma[J].Ann Allerg Asthma Im,2013,110(5):328-334.
[9] 安淑华,张丽君,李金英.气道黏液栓形成的肺炎支原体患儿的预后分析[J].中国当代儿科杂志,2015,17(5):487-491.
[10] Yamada M,Buller R,Bledsoe S,et al.Rising rates of macrolide-resistant Mycoplasma pneumoniae in the central United States[J].Pediatri Infect Dis J, 2012,31(4):409-411.
[11] Yang E,Gang MH, You SY,et al.Clinical characteristics of children with lobar pneumonia caused by Mycoplasma pneumoniae[J].Pediatri Allerg Res Dis,2012,22(3):256-264.
[12] Chang HY, Chang LY, Shao PL,et al.Comparison of real-time polymerase chain reaction and serological tests for the confirmation of Mycoplasma pneumoniae infection in children with clinical diagnosis of atypical pneumonia[J].J Microbiol Immunol Infect,2014,47(2):137-144.
[13] Hong KB,Choi EH,Lee HJ,et al.Macrolide resistance of Mycoplasma pneumoniae, South Korea,2000-2011[J].Emerg Infect Dis,2013,19(8):1281.
[14] Jeong YC, Yeo MS,Kim JH,et al.Mycoplasma pneumoniae infection affects the serum levels of vascular endothelial growth factor and interleukin-5 in atopic children[J].Allerg Asthma Im Res,2012,4(2):92-97.
[15] Sung JJ,Kim EJ, Sun YH,et al.Clinical presentations of Chlamydia pneumoniae in children hospitalized for acute respiratory infections:a comparison to Mycoplasma pneumonia[J].Allerg Asthma Res Dis,2015,3(5):346-351.
[16] 陈玲玲,成云改,陈志敏,等.肺炎支原体肺炎患儿混合感染的研究[J].中华儿科杂志,2012,50(3):211-215.
[17] Hong SJ.The role of Mycoplasma pneumoniae infection in asthma[J].Allerg Asthma Im Res,2012,4(2):59-61.
[18] Kim JH,Cho T,Moon JH,et al.Serial changes in serum Eosinophil-associated mediators between atopic and non-atopic children after mycoplasma pneumoniae pneumonia[J].Allerg Asthma Im Res,2014,6(5):428-433.
(编校:苗加会)
Effect of Xiyanping injection adjuvant therapy in children with mycoplasma pneumonia
LIN Min-zi1Δ, ZHENG Ying1, ZHU Xiao-zhou2
(1.Department of Pharmacy, The Second affiliated Hospital of Wenzhou Medical University, Wenzhou 325000, China; 2.Department of Pediatrics, The Second Affiliated Hospital of Wenzhou Medical University, Wenzhou 325000, China)
ObjectiveTo investigate the effect of the serum Clara cell secretory protein and IL-6 levels by Xiyanping injection adjuvant therapy in children with mycoplasma pneumonia.Methods72 cases of children with mycoplasma pneumonia from October 2014 to August 2015 in our hospital department of pediatrics were selected and randomly divided into the control group and the experiment group,36 cases in each group.The control group were treated by erythromycin erythromycin, and azithromycin,the experiment group were treated on the base of the control group with Xiyanping injection.two groups of patients were treated for two cycles.The CRP,PCT,CCSP,IL-6 and adverse reactions were compared after treatment.ResultsAfter treatment,the clinical total effective rate in experimental group was higher than in control group (P<0.05),the CRP,PCT,CCSP and IL-6 levels were lower(P<0.05).The incidence of adverse reactions in the experimental group 8.33% was obviously lower than that of the control group 19.44% (P<0.05).ConclusionXianyanping injection adjuvant treatment of mycoplasma pneumonia in children with significant clinical efficacy,can significantly increase serum Clara cell secretory protein levels,reduce CRP, PCT, IL-6 levels,improve clinical symptoms and with high safety.
Xiyanping injection;adjuvant therapy;children with mycoplasma pneumonia;clara cells secrete proteins;c-reactive protein;procalcitonin;interleukin-6
10.3969/j.issn.1005-1678.2016.12.040
林敏姿,通信作者,女,大专,药师,研究方向:临床药学,E-mail:jiangqianfenggz@163.com。
R536.1
A

