返青期醉马草水浸液对红豆草种子萌发的影响
朱习雯,靳瑰丽,张鲜花,黄国强,赛米拉克孜·台外库力,马青成
(1新疆农业大学草业与环境科学学院/新疆草地资源与生态重点实验室,乌鲁木齐 830052;2 内蒙古阿拉善吉兰泰动物卫生监督站,内蒙古阿拉善盟 750333)
返青期醉马草水浸液对红豆草种子萌发的影响
朱习雯1,靳瑰丽1,张鲜花1,黄国强1,赛米拉克孜·台外库力1,马青成2
(1新疆农业大学草业与环境科学学院/新疆草地资源与生态重点实验室,乌鲁木齐830052;2 内蒙古阿拉善吉兰泰动物卫生监督站,内蒙古阿拉善盟750333)
摘要:【目的】研究返青期醉马草(Achnatherum inebrians)株体和根际土壤不同部位、不同浓度水浸液对红豆草(Onobrychis viciaefolia)种子萌发的影响。【方法】采用培养皿滤纸法,研究返青期醉马草株体水浸液在0.2、0.1、0.05和0、025 g/mL和根际土壤水浸液在2.0、1.0、0.2和0.1 g/mL浓度下,对红豆草种子萌发的化感作用。【结果】醉马草水浸液对红豆草种子萌发指标由强到弱依次为萌发指数>发芽势>发芽率;叶水浸液的抑制作用大于根水浸液;根际土壤不同土层水浸液呈现出0~5、5~10和15~20 cm为促进作用,而10~15 cm表现为抑制作用;不同浓度的株体水浸液化感效应均表现出抑制作用,根际土壤水浸液则表现为低促高抑作用。【结论】醉马草水浸液对红豆草种子萌发表现为抑制性,叶的水浸液抑制作用远强于根,且浓度越大抑制效应越明显。
关键词:返青期;醉马草;红豆草;种子萌发
0引 言
【研究意义】醉马草(Achnatheruminebrians)是禾本科芨芨草属多年生草本有毒植物[1],广泛分布在我国新疆、甘肃和内蒙古等北方地区。其可以感染一种寄生真菌,产生麦角类生物碱(麦角新碱和麦角酰胺),使其全草具毒[2]。动物采食多时可呈现蹒跚如醉、步履不整等中毒状态[3-4]。近年来,由于草地严重退化,醉马草逐渐成为畜牧业一大危害。【前人研究进展】目前,对于醉马草的研究主要集中在化学防除[5-6]、有毒成分[7]和内生真菌[8]等。【本研究切入点】对于醉马草化感物质和化感作用[9]的研究并不多见。醉马草蔓延日益严重,对其有效防控是生态上亟待解决的问题之一,其中在醉马草发生区补播优良牧草成为防控的常用方法。红豆草适口性较好,营养价值丰富,为各种家畜所喜食,颇耐旱、耐寒和耐牧,是补播草地的首选物种之一。又因补播优良牧草通常在返青期进行补播,因此,研究以醉马草为供体植物,红豆草为受体植物,采用野外取样和室内测定相结合的方法,探讨返青期醉马草对红豆草种子萌发的影响。【拟解决的关键问题】从草和土两个角度分析醉马草水浸液对红豆草种子的化感作用,阐明其化感作用机理,为该类毒草的替代防控提供了科学依据。
1 材料与方法
1.1材 料
1.1.1供体植物株体的采集
2014年于醉马草返青期,在醉马草爆发区新疆达坂城区阿克苏乡春秋草地(43.70° N,87.68°E)内选择相同坡度、相同海拔的区域,设置5个10 m×10 m典型样地,从各样地中挖取中等株型、生长健康的植株5株,共计25株,分根、叶2个部位进行混合备用。
1.1.2供体植物根际土壤的采集
同期在上述醉马草根际周围用铁锹去除表层土及枯枝落叶,用内径10 cm的土钻分别按0~5、5~10、10~15和15~20 cm土层各随机钻取土样,将同一土层土样混后装入新的保鲜塑料袋中,带回实验室备用。
1.1.3受体植物
红豆草种子购自新疆克劳沃草业有限责任公司。纯净度≥95%,发芽率85%。
1.2方 法
1.2.1株体水浸液制备
将挖取的醉马草植株冲洗干净,自然晾干,分为地上部分与地下部分,即根、叶2个部分后,分别将其剪为﹤2 cm的小段,放入锥形瓶,加入蒸馏水配成0.2、0.1、0.05和0.025 g/mL 4个浓度溶液[10,11],在室温(20~24℃)下放置48 h(每隔12 h摇动5 min),用双层纱布过滤,然后再用两层滤纸抽滤2次后,即得醉马草根部和叶部水浸液,置于4℃冰箱中保存备用。
1.2.2根际土壤水浸液的制备
将采取的土壤自然风干,剔除细根,然后磨碎,过40目筛。取1 000 g置于烧杯中,加入500 mL蒸馏水,在摇床上振荡24 h,暗光静置24 h,然后3 500 r / min离心20 min[12,13],过滤后即得原液。母液质量浓度为2 g / mL,加入蒸馏水配成2.0、1.0、0.2和0.1 g / mL 4个浓度溶液[14],置于4℃冰箱中保存备用。
1.2.3种子萌发实验
在直径为12 cm的培养皿中铺入2层滤纸,每皿放饱满的供试种子50粒,并分别向培养皿中加入质量浓度为0.2、0.1、0.05和0.025 g / mL醉马草株体水浸液和质量浓度为2.0、1.0、0.2和0.1 g / mL醉马草根际土壤水浸液,且保持滤纸湿润;对照(CK)加蒸馏水。每处理3个重复。放入人工气候箱,15~25℃变温(每天25℃持续8 h,15℃持续16 h),高温时进行光照,光强度约750~1 250 lx(冷白荧光灯)[15]。并等量补充少量水浸液(CK加蒸馏水)。每24 h记录受体种子萌发数(以胚根突破种皮为准[16])情况,参照国家标准[15]结束种子萌发实验(胚芽长度为种子长的1/2),并测量胚根长和胚芽长。
1.3数据统计
按公式[17]计算发芽率、发芽势、萌发指数GI、化感作用效应指数[18](RI)、综合化感效应指数[19](MR)。
实验数据均在Excel 2003中录入,运用SPSS13.0软件,采取单因素方差分析(One-way ANOVA)和最小显著性差异法(LSD)进行方差分析和显著性检验。
2结果与分析
2.1醉马草株体水浸液对红豆草种子萌发的影响
随着根和叶水浸液浓度的增加,受体植物种子萌发各项指标值大都呈下降趋势。根水浸液对红豆草各浓度间除0.2 g / mL的胚根长差异显著外(P﹤0.05),其余所有指标均无显著性差异(P﹥0.05);叶水浸液对0.2 g/mL红豆草的发芽率、萌发指数、发芽势和胚根重显著(P<0.05)低于对照CK,其他指标则无显著性差异。总体看来,醉马草株体水浸液对发芽率、萌发指数、发芽势、胚根长、胚根重具有一定的影响,对胚芽长和胚芽重无明显的影响。表1
2.2醉马草根际土壤水浸液对红豆草种子萌发的影响
研究表明,醉马草根际土壤不同土层和不同浓度各指标(除萌发指数外)大体上表现为促进作用,但具有一定波动性。在0~5 cm土层中,0.1 g / mL红豆草胚芽长显著(P<0.05)高于CK,表现为促进作用;5~10 cm时2 g / mL红豆草的发芽势显著(P<0.05)低于1 g / mL的发芽势,1 g / mL时红豆草胚根重显著(P<0.05)高于CK;10~15 cm时0.1、1和2 g / mL的发芽率显著(P<0.05)高于对照CK。在15~20 cm土层中,2 g / mL的红豆草胚根重显著(P<0.05)高于CK,表现为促进作用。表2
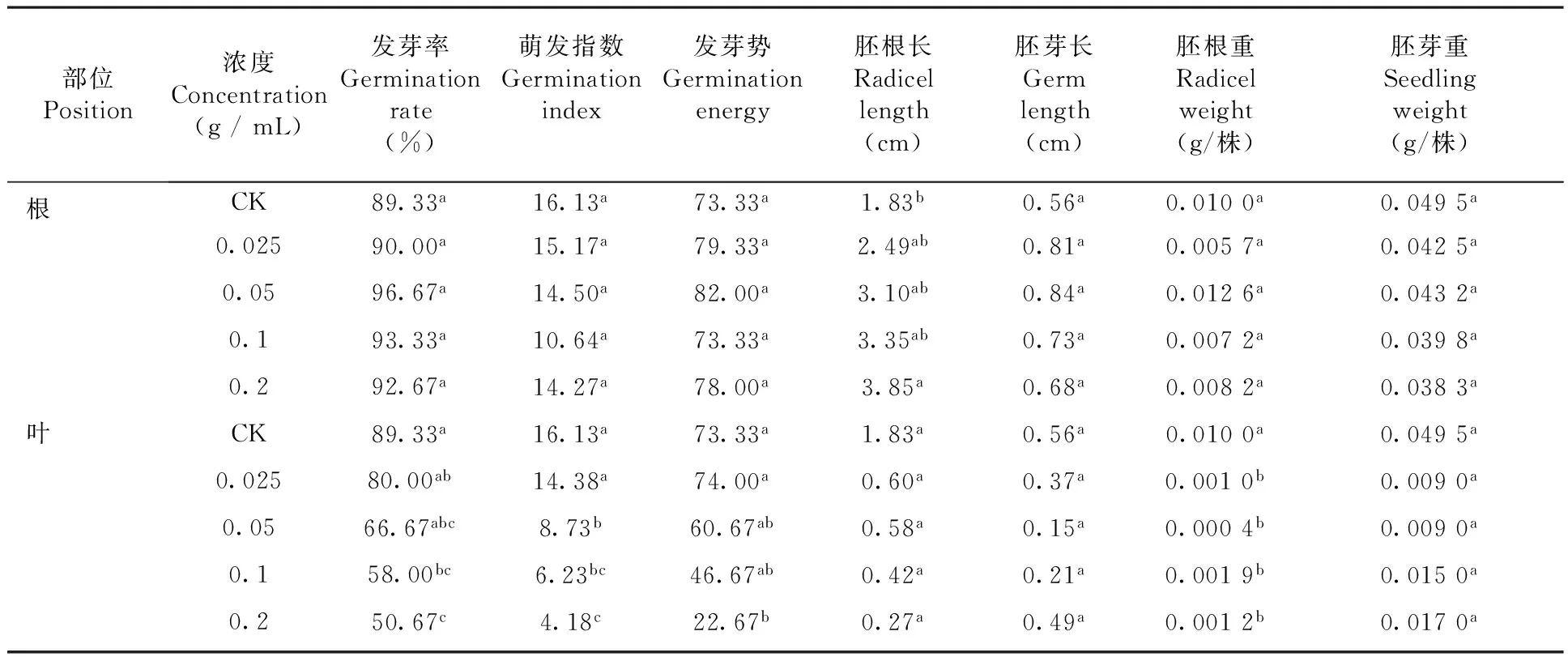
表1 醉马草株体不同浓度水浸液下红豆草种子萌发特性变化
注:表中不同小写字母代表同一指标不同处理在P<0.05水平上差异显著,下同
Nole:Different small letters in the table represent the same index of different treatments at differentP<0.05 levels, the same as below
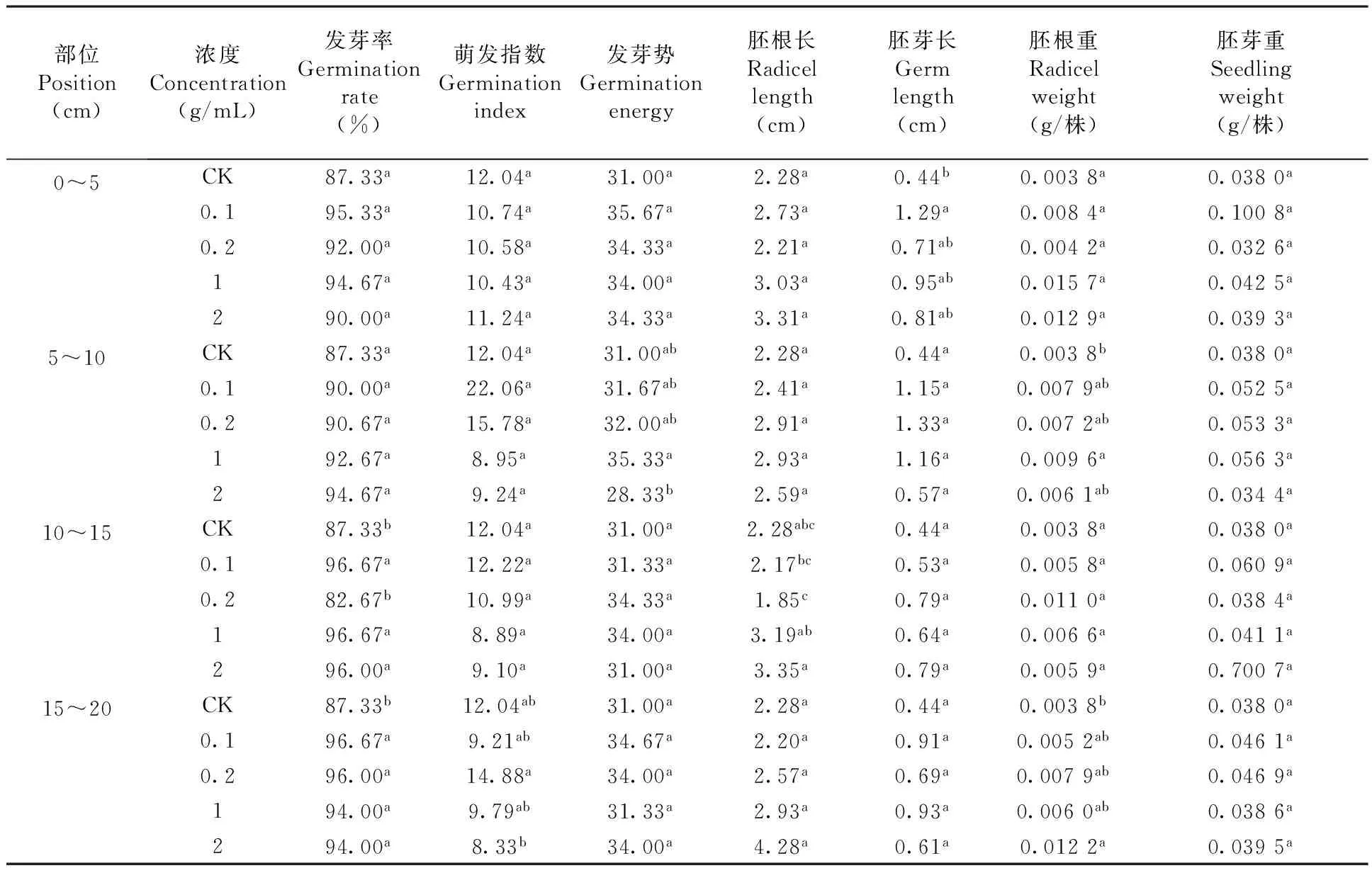
表2 醉马草根际土壤不同浓度水浸液下红豆草种子萌发特性变化
2.3醉马草对红豆草种子的综合化感效应
红豆草对醉马草水浸液化感作用敏感指数综合分析结果表明,发芽率、发芽势和萌发指数3个指标的RI值均为负值,对种子萌发产生了抑制作用,且敏感性由强到弱依次为萌发指数<发芽势>发芽率。图1

图1 红豆草对醉马草水浸液化感作用的平均敏感指数
进一步分析醉马草株体根、叶和根际土壤0~5、5~10、10~15和15~20 cm四个土层水浸液对红豆草种子的化感作用,根、叶不同部位均表现出抑制性,且其作用强度为叶﹥根;四个土层则为0~5、5~10和15~20 cm表现出促进作用,而10~15 cm表现出抑制性。图2
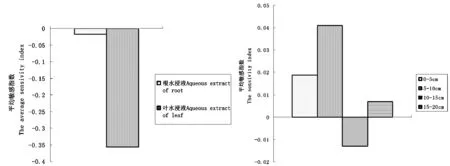
图 2 醉马草不同部位、不同土层水浸液对红豆草种子的综合化感效应比较
不同浓度的醉马草水浸液处理红豆草种子后,株体水浸液对红豆草种子的萌发均表现出抑制作用,根际土壤水浸液处理后表现为低促高抑作用;且均为浓度越大化感效应越显著。图3

图3 不同浓度醉马草水浸液对红豆草种子的综合化感效应比较
3讨 论
在自然界中,化感作用主要通过挥发、淋溶、分泌、分解等方式作为植物活体和残体释放化感物质的主要途径[20],其在杂草入侵过程中起着极其重要的作用。试验表明,醉马草水浸液对红豆草种子化感作用表现为抑制,且敏感性由强到弱依次为萌发指数>发芽势>发芽率。物种更新与种子萌发有着密不可分的关系,发芽率的降低会影响牧草在群落中的多度。而醉马草水浸液对其抑制作用主要表现为对萌发指数的影响大于对发芽率的影响,将严重影响牧草在返青期时对其他植物的竞争能力。
同一浓度不同器官的水浸液对红豆草种子的影响程度不同,这可能与器官中化感物质的含量有关。醉马草株体和根际土壤水浸液对红豆草种子的化感作用大体上表现为抑制作用。株体不同部位水浸液的化感作用表现为叶>根,说明返青醉马草地上部分的化感作用强于地下部分的化感作用,可能是由于叶部、叶鞘等部位具有比较稳定的化感物质;根际土壤水浸液对红豆草种子的化感作用表现为一定的波动性,仅10~15 cm表现出抑制性,其余土层则均表现为促进作用。这也许和醉马草株体凋落物、根系分布区和土壤中含有有机质等多聚体有关。可见,醉马草株体和土壤水浸液在一定程度上影响了红豆草种子萌发和胚生长,这可能是造成其从群落中退化的原因之一。
在化感作用的研究中,浓度及受体植物敏感性的不同,其表现为促进、抑制、促进/抑制双重作用和无显著性等多种形式[21]。研究得出,随着株体水浸液浓度的增加,抑制性越来越强;而根际土壤水浸液则表现为低浓度促进、高浓度抑制的作用。这可能是低浓度下,醉马草根际土壤中含有各种次生物质,它们的存在对植物生长有利,因而表现为促进作用。试验结果跟高丹[22]研究的巨桉主要器官水浸液对牧草化感研究的结果相似。
4结 论
醉马草水浸液对红豆草种子萌发产生抑制作用,敏感性由强到弱依次为萌发指数>发芽势>发芽率;醉马草株体不同部位水浸液的抑制作用表现为叶﹥根;根际土壤不同土层水浸液呈现出0~5、5~10和15~20 cm为促进作用,而10~15 cm表现为抑制作用;不同浓度的醉马草株体水浸液化感效应均表现出抑制作用,根际土壤水浸液则表现为低促高抑作用;且均为浓度越大化感效应越显著。
参考文献(References)
[1] 陈翼胜,郑硕.中国有毒植物[M].北京:科学出版社,1987:272-273.
CHEN Yi-sheng,ZHENG Shuo. (1987).ChinaPoisonousPlants[M]. Beijing:Science Press:272-273. (in Chinese)
[2] Christopher O. Miles,,Geoffrey A. Lane,,Margaret, E., di Menna,,Ian Garthwaite,,Edgar, L. Piper, et al. (1996). High Levels of Ergonovine and Lysergic Acid Amide in Toxic Achnatherum inebrians Accompany Infection by an Acremonium-like Endophytic Fungus.JournalofAgriculturalandFoodChemistry,44(5):1,285-1,290.
[3] 邓凯东,彭海宏,李文蓉.尿素氨化醉马草的麦角新碱含量及其营养价值[J].草业科学,1998,15(4):10-13.
DENG Kai-dong,PENG Hai-hong,LI Wen-rong. (1998). Urea Ammoniated Achnatherum inebrians Ergot New Alkali Content and Nutritional Value [J].PrataculturalScience,15(4):10-13. (in Chinese)
[4] 刘图雅,曹敏慧,李国忠.动物醉马草中毒的诊断和治疗[J].动物医学进展,2006,27(2):116-117.
LIU Tu-ya,CAO Min-hui,LI Guo-zhong. (2006). Diagnosis and Treatment of Animal PoisoningAchnatheruminebrians[J].ProgressinVeterinaryMedicine,27(2):116-117. (in Chinese)
[5] 达尔加,石定隧,马瑞昌,等.禾本科醉马草防除方法的研究[J].草地与饲料,1988,(3):13-19.
Da Er-jia,SHI Ding-sui,MA Rui-chang,et al. (1988). Research GrassyAchnatheruminebriansControlling Method [J].GrasslandandFeed,(3):13-19. (in Chinese)
[6] 付爱良,马来书.醉马芨芨草清除示范与推广[J].新疆畜牧业,1992,(6):35-37.
FU Ai-liang,MA Lai-shu. (1992).Achnatheruminebriansclear demonstration and promotion [J].XinjiangAnimalHusbandry,(6):35-37. (in Chinese)
[7] 张伟,李冠,李小飞.醉马草毒性成分的提取研究[J].生物科技,2006,16(6):60-62.
ZHANG Wei,LI Guan,LI Xiao-fei. (2006). Extraction of toxic componentsAchnatheruminebrians[J].BiologicalTechnology,16(6):60-62. (in Chinese)
[8] 金文进.醉马草内生真菌多样性的研究[D].兰州:兰州大学,2009.
JIN Wen-jing. (2009).ThestudyofendophyticfungiinAchnatheruminebrians[D]. Master Dissertation. Lanzhou Univeisity, Lanzhou. (in Chinese)
[9] 塞米拉克孜·台外库力,靳瑰丽,张勇娟,等.醉马草对几种牧草化感作用的研究[J].新疆农业科学,2015,52(9):1 715-1 722.
Saimilakezi·taiwaikuli,JIN Gui-li,ZHANG Yong-juan,et al. (2015). Study on allelopathic effect ofAchnatheruminebrianson several forage [J].XinjiangAgriculturalSciences,52(9):1,715-1,722. (in Chinese)
[10] 黄玺,李春杰,南志标. 醉马草内生真菌共生体对其伴生植物种子萌发的影响[J].草业科学,2010,27(7):84-87.
HUANG Xi,LI Chun-jie,NAN Zhi-biao. (2010). Effects ofAchnatheruminebrians/Neotyphodium endophyte symbionton seed germination ofStipacapillataandPoasphondylodes[J].PrataculturalScienc,27(7):84-87. (in Chinese)
[11] 马瑞君,王明理,赵坤,等.高寒草场优势杂草黄帚橐吾水浸液对牧草的化感作用[J].应用生态学报,2006,17(5):845-850.
MA Rui-jun,WANG Ming-li,ZHAO Kun,et al. (2006). A llelopathy of aqueous extract fromLigulariavirgaurea,a dominant weed in psychro-grassland on pasture plants [J].ChineseJournalofAppliedEcology,17(5):845-850. (in Chinese)
[12] 李建勇,杨小虎,奥岩松.香樟根际土壤化感作用的初步研究[J].生态环境,2008,17(2):763-765.
LI Jian-yong,YANG Xiao-hu,AO Yan-song. (2008). Allelopathy of rhizosphere soil ofCinnamomumcamphora(L.)Presl [J].EcologyandEnvironment,17(2):763-765. (in Chinese)
[13] 李小茹,刘婉华,关亚丽.银胶菊根际土壤化感作用的初步研究[J].中国农学通报,2012,28(7):176-180.
LI Xiao-ru,LIU Wan-hua,GUAN Ya-li. (2012). Allelopathic Effects of Water Extract from Rhizosphere Soil ofPartheniumhysterophorus[J].ChineseAgriculturalScienceBulletin,28(7):176-180. (in Chinese)
[14] 塞米拉克孜·台外库力,靳瑰丽,安沙舟,等. 醉马草根围土壤对牧草种子萌发的影响[J].草业科学,2014,31(11):2 105-2 112.
Saimilakezi Taiwaikuli,JIN Gui-li,AN Sha-zhou,et al. (2014). Effects of rhizosphere soil ofAchnatheruminebrianson forages seed germination [J].PrataculturalScience, 31(11):2,105-2,112. (in Chinese)
[15] 徐彩琴,安沙舟,陈翔,等.开花期纳里橐吾水浸液对4种禾木科牧草种子萌发的影响[J].新疆农业科学,2011,48(7):1 264-1 268.
XU Cai-qin,AN Sha-zhou,CHEN Xiang,et al. (2011). On Effects of Aqueous Extrace Extract from Allelopathy ofLigularianaryensisinFlower Period on Seed Germination of 4 Pasture Plants [J].XinjiangAgriculturalSciences,48(7):1,264-1,268. (in Chinese)
[16] 马瑞君,李刚,朱慧,等.箭叶橐吾水溶物对9种牧草种子化感作用研究[J].草业学报,2007,16(6):88-93.
MA Rui-jun,LI Gang,ZHU Hui,et al. (2007). Allelopathic effects of aqueous extracts fromLigulariasagittaonseed of nine pasture plants [J].ActaPrataculturaeSinica,16(6):88-93. (in Chinese)
[17] 慕小倩,何红花,董志刚.2种杂草水提液对小麦种子萌发及幼苗生长的影响[J].西北植物学报,2008,28(6):1 165-1 171.
MU Xiao-qian,HE Hong-hua,DONG Zhi-gang. (2008). Effects of water extract of two seed germination and seedling growth of different wheat varieties [J].ActaBotanicaBoreali-OccidentaliaSinica,28(6):1,165-1,171. (in Chinese)
[18] Williamson, G. B., & Richardson, D. (1988). Bioassays for allelopathy: measuring treatment responses with independent controls.JournalofChemicalEcology, 14(1):181-187.
[19] 马瑞君,王明理,赵坤,等.高寒草场优势杂草黄帚橐吾水浸液对牧草的化感作用[J].应用生态学报,2006,17(5):845-850.
MA Rui-jun, WANG Ming-li, ZHAO Kun,et al. (2006). llelopathy of aqueous extract fromLigulariavirgaurea, a dominant weed in psychro-grassland on pasture plants [J].ChineseJournalofAppliedEcology, 17(5):845-850.(in Chinese)
[20] Wu Y F,Cao K,Wei N S,Zhou G H. (1995). Screening and usage of bio-antiviral pesticide.WorldAgriculture,193:35-36.
[21] 吴会芹,董林林,王倩.玉米、小麦秸秆水浸提液对蔬菜种子的化感作用[J].华北学学报,2009,24(S):140-143.
WU Hui-qin,DONG Lin-lin,WANG Qian. (2009). Allelopathy of Corn and Wheat Straw Aqueous Extracts on Vegetable Seeds [J].ActcAgriculturaeBoreali-Sinica,24(S):140-143. (in Chinese)
[22] 高丹.巨桉主要器官浸提液对几种牧草的化感作用研究[D].成都:四川农业大学硕士论文,2008.
GAO Dan. (2008).AllelopathyPotentialsofWaterExtractsoftheMainOrgansofEucalyptusgrandisonPastures[D]. Master Dissertation. Sichuan Agricultural University,Chengdou. (in Chinese)
Fund project:Supported by special fund for scientific research of public welfare industry (Agriculture) "Study on the occurrence regularity and control techniques of main poisonous weeds in grassland" (201203062).
doi:10.6048/j.issn.1001-4330.2016.06.021
收稿日期(Received):2016-02-29
基金项目:公益性行业(农业)科研专项“草原主要毒害草发生规律及防控技术研究(201203062)”
作者简介:朱习雯(1993-),女,湖北郧县人,硕士研究生,研究方向为草地资源与生态,(E-mail)842534838@qq.com 通讯作者(Cotresponding author):靳瑰丽(1979-),女,河南兰考人,副教授,博士,研究方向为草地资源与生态,(E-mail)jguili@126.com
中图分类号:S541
文献标识码:A
文章编号:1001-4330(2016)06-1129-07
The Seed Germination Effect of Aqueous Extract fromAchnatheruminebriansat the Returning Green Stage on theOnobrychisviciaefolia
ZHU Xi-wen1, JIN Gui-li1, ZHANG Xian-hua1, HUANG Guo-qiang1,Saimilakezi Taiwaikuli1, MA Qing-cheng2
(1.CollegeofPrataculturalandEnvironmentalSciences,XinjiangAgriculturalUniversity;XinjiangKeyLaboratoryofGrasslandResourcesandEcology,Urumqi830052,China; 2.AnimalHealthSupervisionStationattheJilantaiTowninAlashanZuoqiofInnerMongolia,AlashanInnerMongolia750333,China)
Abstract:【Objective】 This project aims to explore the seed germination effect of different parts and different concentrations of aqueous extract from Achnatherum inebrians at the returning green stage on the Onobrychis viciaefolia【Method】The method of a growth chamber in pot culture was used to research the seed germination of O. viciaefolia. 【Result】 Aqueous extracts from A. inebrians on germination index from strong to weak was the germination index > germination potential > germination rate. Different parts of strains aqueous extracts from A. inebrians showed leaf > root. Rhizosphere of different soil aqueous extracts showed 0-5, 5-10 and 15-20 cm for the promotion of the role, and 10-15 cm showed inhibition. Flooding the body with different concentrations of liquefied flu strains have shown inhibitory effect, rhizospheric soil is promoting high performance low inhibitory effect.【Conclusion】 In a word, aqueous extracts from A. inebrians showed germination inhibition, leaf inhibition is far stronger than the root, and the greater the concentration, the more obvious inhibitory effect.
Key words:returning green stage; Achnatherum inebrians; Onobrychis viciaefolia; seed germination

