解淀粉芽孢杆菌B15产脂肽的分离鉴定及抑菌机理
朱弘元++康健++范昕


摘要:从葡萄表皮分离获得1株对霉菌具有明显抑制作用的解淀粉芽孢杆菌B15,对其发酵液经过酸沉、Sephadex LH-20层析柱,对抑菌脂肽的特性进行研究。结果发现,该菌株产脂肽对葡萄灰霉病菌有较好的抑制效果,60~100 ℃ 处理或pH 值为2~10的脂肽对灰霉病菌的抑菌活性几乎没有影响;脂肽有效最低抑菌浓度为0.017 mg/mL。经高效液相色谱法(HPLC)和质谱分析发现,解淀粉芽孢杆菌B15产脂肽主要活性成分为iturin A、fengycin。
关键词:脂肽;解淀粉芽孢杆菌;分离纯化;抑菌机理;鉴定
中图分类号: TS201.3文献标志码: A文章编号:1002-1302(2016)05-0186-04
1945年,Johnson等报道枯草芽孢杆菌产生抗菌物质[1]。1968年,Arima等首次发现枯草芽抱杆菌能够产生抗菌脂肽surfactin[2]。除枯草芽孢杆菌(Bacillus subtilis)外,解淀粉芽孢杆菌(B. amyloliquefaciens)、地衣芽孢杆菌(B. lichemformis)、环状芽孢杆菌(B. circulan)、蜡样芽胞杆菌(B. cereus)和短小芽孢杆菌(B. pumilus)等[3-9]都能产生抗菌脂肽。近年来,不断有新的脂肽被发现。
脂肽应用广泛。天然脂肽提取物可以直接用于提高原油采收率、治理环境如生物修复、生物降解、生物除污等[10-12],这是目前全球关注的热点;60%~80%纯度的脂肽能作为微型乳剂,用于日用和食品工业如洗衣液、奶粉等[13-16],更纯的脂肽可用于保健品和药品等[17-19]。目前,通过基因工程提高了生产菌种的性能,优化培养条件有效提高了脂肽的产量,但由于脂肽分子量比较接近(iturin分子量为1 043~1 112 u,surfactin分子量为994~1 064 u,fengycin分子量为1 435~1 580 u)、结构比较复杂、脂肽分子具有聚合现象[20]等,脂肽的分离纯化具有一定难度,有待进一步探索。细菌B15是中国食品发酵工业研究院酿酒部从葡萄表皮上分离得到1株对霉菌具有明显抑制作用的菌株,经鉴定为产脂肽的解淀粉芽孢杆菌。本试验对其产出的脂肽进行分离纯化鉴定,对其抑菌机理进行初步研究,为解淀粉芽孢杆菌B15产脂肽的开发利用奠定理论基础。
1材料与方法
1.1材料和设备
1.1.1菌株解淀粉芽孢杆菌B15、酿酒酵母(Saccharomyces cerevisiae),由中国食品发酵工业研究院酿酒部提供;葡萄灰霉病菌(Botrytis cinerea),由中国科学院植物保护所提供。
1.1.2培养基称取38 g PDA培养基,溶解到1 000 mL水中,121 ℃灭菌15 min。Landy培养基配制:葡萄糖30 g、L-谷氨酸钠14.0 g、MgSO4 0.5 g、KCl 0.5 g、KH2PO4 1.0 g、FeSO4 0.15 mg、MnSO4 5.0 mg、CuSO4 0.16 mg,溶解到1 000 mL水中,2 mol/L HCl调节pH值为7.2,115 ℃灭菌15 min。
1.1.3主要仪器和设备美国产Agilent 1260 Infinity型高效液相色谱仪、高效液相色谱串联质谱仪(Water Acquity UPLC-MS/MS);奥林巴斯荧光显微镜BX51;上海沪西产蛋白层析仪。制备型液相色谱,北京慧德易科技有限责任公司生产;冷冻干燥机,北京四环科学仪器厂生产;冷冻离心机,北京雷勃尔离心机有限公司生产;旋转蒸发仪,上海亚荣生化仪器厂生产;氮吹仪,天津恒奥科技发展有限公司生产。
1.2试验方法
1.2.1分离和纯化
1.2.1.1发酵液的粗分离将B15菌种从种子培养基按4%接种量接种到Landy培养基中,30 ℃ 180 r/min培养 48 h,得到含抑菌组分的发酵液;将发酵液 4 ℃ 10 000 r/min离心30 min,收集上清液;用 6 mol/L HCl 调节pH值至 2.0,边加 HCl 边轻微搅拌;4 ℃保藏8 h或过夜;4 ℃ 10 000 r/min离心30 min,弃去上清;用少量无菌水冲洗沉淀,用NaOH调节pH值至7.0,冷冻干燥。
1.2.1.2抑菌脂肽的纯化将冻干样品以1 ∶10溶解在甲醇中,30 ℃ 120 r/min摇床振摇30 min,过0.22 μm滤膜;吸取2 mL样品过Sephadex LH-20柱,使用甲醇作洗脱剂,流速为0.3 mL/min,吸光度为210 nm;收集洗脱峰,氮吹浓缩,备用。
1.2.2脂肽特性研究
1.2.2.1抑菌活性测定将PDA培养基灭菌,置于50~55 ℃ 水浴锅中保持;吸取100 μL浓度为100万CFU/mL的葡萄灰霉孢子加入PDA培养基,摇晃均匀;倒平板,待凝固时,将无菌的牛津杯放在培养基上轻轻挤压,使之无缝隙;在牛津杯中加入150 μL纯化脂肽,以甲醇作空白,25 ℃培养 7 d,测定其抑菌圈直径。
1.2.2.2最小抑菌浓度测定将有抑菌活性的洗脱峰溶解在甲醇中,稀释成不同浓度的溶液,以未处理样品作为对照,测定其抑菌活性。
1.2.2.3温度对抑菌活性的影响吸取1 mL脂肽溶液,分别于60、80、100 ℃水浴锅中水浴30 min、60 min、2 h;另吸取脂肽溶液1 mL,121 ℃处理20 min,冷却至室温;以未处理样品作为对照,分别测定其抑菌活性。
1.2.2.4pH值对抑菌活性的影响吸取1 mL脂肽溶液,分别用6 mol/L HCl、NaOH调节pH值为2~12,保持2 h,调回初始pH值6.0,以未处理脂肽溶液作为对照,测定其抑菌活性。
1.2.2.5脂肽对真菌菌丝体的影响取对数生长期葡萄灰霉孢子100万CFU/mL,接种到高压灭菌、盖有22 mm×22 mm 盖玻片的6孔培养板中培养24 h;加入终浓度为 0.3 mg/mL 的脂肽培养4 h,用PBS缓冲液漂洗3次;在待镜检菌丝中各加入1滴Calcofluor White、10%NaOH氢氧化钠染色1 min,置于荧光显微镜下观察。
1.2.3脂肽的鉴定选取有抑菌效果的洗脱峰样品进入制备型液相色谱分析,色谱柱为Maisch,规格为 C18、250 mm×10 mm、5 μm、180 A,使用乙腈和水进行梯度洗提,收集各组分,浓缩;进行抑菌试验,收集有抑菌效果的组分,用高效液相色谱串联质谱仪进行鉴定。
2结果与分析
2.1抑菌脂肽的分离纯化
经酸沉淀得到的粗提液呈黄褐色。由图1可见,粗提液经滤膜滤菌、过Sephadex LH-20层析柱,所得层析图中共有3个峰。经活性检测,peak 1具有抑制真菌活性(图2)。
2.2抑菌脂肽的特性研究
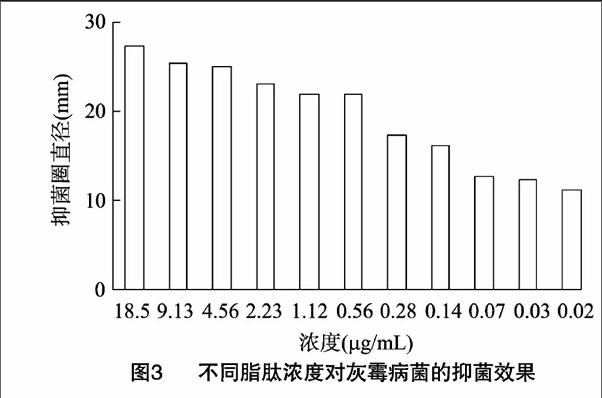
2.2.1不同脂肽浓度的抑菌效果试验结果表明,抗菌脂肽浓度不同,对葡萄灰霉病菌的抑菌效果有较大差异,脂肽浓度大于0.5 mg/mL时有较好的抑菌效果,抑菌圈直径大于20 mm(图3);浓度小于0.5 mg/mL时,随脂肽浓度的降低,抑菌效果下降很快,当脂肽浓度小于0.017 mg/mL时,脂肽没有抑菌作用。因此,解淀粉芽孢杆菌B15产脂肽最小的抑菌浓度(MIC)是0.017 mg/mL。
2.2.2不同温度和pH值处理的脂肽对灰霉病菌的抑菌效果由图4、图5可见,温度处理的脂肽对灰霉病菌的抑制作用相差不大,几乎没有影响;pH 值为2~10时处理的脂肽有较好的抑菌活性,pH值大于12时,脂肽的抑菌活性有较大损失。
2.2.3抑菌脂肽对灰菌病菌菌丝体的影响由图6可见,正常的葡萄灰霉病菌菌丝体均匀细长,而脂肽处理的葡萄灰霉病菌菌丝体膨胀,数量减少,并且顶端出现明显膨大。
2.3脂肽的鉴定
由图7、图8、表1可见,具有抑菌活性的脂肽peak1进入制备型液相色谱共收得6个组分,其中1-1、1-2、2组分的m/z分别是1 058、1 058、1 072,对灰霉病菌和酵母具有较好的抑菌效果,推测可能是iturin A,使用高效液相色谱法[21]对1-1、1-2、2组分与Sigma公司的标品进行对比,确定1-1、1-2、2组分分别是2种结构的C15 iturin A、C16 iturin A;3、4、5组分的m/z在1 400~1 600之间,为fengycin类物质,m/z为1 449、1 464可能是C15、C16 fengycin A或C13、C14 fengycin B,m/z为1 477、1 492可能是C17、C18 fengycin A或 C15、C16 fengycin B。
表1抑菌组分的鉴定和性质
组分保留时间
(min)峰分离度抑制菌株种类可能物质1-133.2760.93葡萄灰霉、酵母C15 iturin A1-233.4991.90葡萄灰霉、酵母C15 iturin A235.4781.25葡萄灰霉、酵母C16 iturin A339.0~45.5葡萄灰霉C15、C16 fengycin A;C13、C14 fengycin B446.2841.81葡萄灰霉C15-19 fengycin A;C13-17 fengycin B547.6781.17葡萄灰霉fengycin类物质
3结论
葡萄病害是影响我国葡萄生产的重要问题之一,每年都造成葡萄不同程度的损失。据统计,我国葡萄生产每年因葡萄病害造成的损失在30%以上[22]。脂肽分子量较小、结构稳定,有研究表明,脂肽具有良好的抑制细菌、真菌性能及表面活性,是一种不可多得的新型抗生素,在医药、食品、日用品等行业有很大的应用潜力。解淀粉芽孢杆菌是第1批通过美国食品和药物管理局(FDA)安全认证的菌种,在国内农业部发行的微生物肥料生物安全技术通用准则(NY 1009—2006)也是免检菌种。解淀粉芽孢杆菌B15产脂肽含有抑制真菌的组分,在显微镜下观察发现,该抑菌成分能减少葡萄灰霉孢子的产生并造成菌丝体胀大,脂肽有效抑菌最低浓度为 0.017 mg/mL。经液相色谱和质谱仪的鉴定发现,脂肽主要抑菌成分为iturin A和fengycin类物质,这2种成分均对葡萄灰霉病菌有抑制作用,iturin A还能有效抑制酵母的生长,在生物农药方面有广阔的应用前景。
参考文献:
[1]Maget-Dana R,Peypoux F I. A special class of pore-forming lipopeptides:biological and physicochemical properties[J]. Toxicology,1994,87(1):151-174.
[2]Arima K,Kakinuma A,Surfactin T G. A crystalline peptidelipid surfactant produced by bacillus subtilis:isolation,characterization and its inhibition of fibrin clot formation[J]. Biochemical and Biophysical Research Communications,1968,31(3):488-494.
[3]Hiradate S,Yoshida S,Sugie H,et al. Mulberry anthracnose antagonists (iturins) produced by Bacillus amyloliquefaciens RC-2[J]. Phytochemistry,2002,61(6):693-698.
[4]Koumoutsi A,Chen X H,Henne A,et al. Structural and functional characterization of gene clusters directing nonribosomal synthesis of bioactive cyclic lipopeptides in Bacillus amyloliquefaciens strain FZB42[J]. Journal of Bacteriology,2004,186(4):1084-1096.
[5]Caldeira A T,Santos A M,Coelho A V,et al. Combined use of LC-ESI-MS and antifungal tests for rapid identification of bioactive lipopeptides produced by Bacillus amyloliquefaciens CCMI 1051[J]. Process Biochemistry,2011,46(9):1738-1746.
[6]Hathout Y,Ho Y P,Ryzhov V,et al. Kurstakins:a new class of lipopeptides isolated from Bacillus thuringiensis[J]. Journal of Natural Products,2000,63(11):1492-1496.
[7]Perez C,Suarez C,Castro G R. Antimicrobial activity determined in strains of Bacillus circulans cluster[J]. Folia Microbiologica,1993,38(1):25-28.
[8]Nishikiori T,Naganawa H,Muraoka Y,et al. Plipastatins:new inhibitors of phospholipase A2,produced by Bacillus cereus BMG302-fF67. Ⅲ. structural elucidation of plipastatins[J]. The Journal of Antibiotics,1986,39(6):755-761.
[9]Morikawa M,Ito M,Imanaka T. Isolation of a new surfactin producer Bacillus-pumilus A-1,and cloning and nucleotide-sequence of the regulator gene,PSF-1[J]. Journal of Fermentation and Bioengineering,1992,74(5):255-261.
[10]Sen R. Biotechnology in petroleum recovery:the microbial EOR[J]. Progress in Energy and Combustion Science,2008,34(6):714-724.
[11]Das P,Mukherjee S,Sen R. Improved bioavailability and biodegradation of a model polyaromatic hydrocarbon by a biosurfactant producing bacterium of marine origin[J]. Chemosphere,2008,72(9):1229-1234.
[12]Das P,Mukherjee S,Sen R. Biosurfactant of Marine origin exhibiting heavy metal remediation properties[J]. Bioresource Technology,2009,100(20):4887-4890.
[13]Maity J P,Lin T J,Cheng H P H,et al. Synthesis of brushite particles in reverse microemulsions of the biosurfactant surfactin[J]. International Journal of Molecular Sciences,2011,12(6):3821-3830.
[14]Singh B R,Dwivedi S,Al-Khedhairy A A,et al. Synthesis of stable cadmium sulfide nanoparticles using surfactin produced by Bacillus amyloliquifaciens strain KSU-109[J]. Colloids and Surfaces B-Biointerfaces,2011,85(2):207-213.
[15]Mukherjee A K. Potential application of cyclic lipopeptide biosurfactants produced by Bacillus subtilis strains in laundry detergent formulations[J]. Letters in Applied Microbiology,2007,45(3):330-335.
[16]Nitschke M,Costa S . Biosurfactants in food industry[J]. Trends in Food Science & Technology,2007,18(5):252-259.
[17]Mukherjee S,Das P,Sivapathasekaran C,et al. Antimicrobial biosurfactants from marine Bacillus circulans:extracellular synthesis and purification[J]. Letters in Applied Microbiology,2009,48(3):281-288.
[18]Rodrigues L,Banat I M,Teixeira J,et al. Biosurfactants:potential applications in medicine[J]. Journal of Antimicrobial Chemotherapy,2006,57(4):609-618.
[19]Sivapathasekaran C,Das P,Mukherjee S A,et al. Marine bacterium derived lipopeptides:characterization and cytotoxic activity against cancer cell lines[J]. International Journal of Peptide Research and Therapeutics,2010,16(4):215-222.
[20]Rangarajan V,Dhanarajan G,Sen R. Improved performance of cross-flow ultrafiltration for the recovery and purification of Ca2+ conditioned lipopeptides in diafiltration mode of operation[J]. Journal of Membrane Science,2014,454(15):436-443.
[21]Hsieh F C,Lin T C,Meng M,et al. Comparing methods for identifying Bacillus strains capable of producing the antifungal lipopeptide iturin A[J]. Curr Microbiol,2008,56(1):1-5.
[22]刘三军,蒯传化. 我国葡萄病害发生趋势与防治工作中应注意的若干问题[J]. 果农之友,2007(2):4-5.

