泗礁沙滩碎波带仔稚鱼群落结构的时空变化
毛成责,钟俊生, 花卫华, 陈渊戈,葛成冈, 杨平海
1 江苏省海涂研究中心,南京 210036 2 江苏省海洋环境监测预报中心,南京 210036 3上海海洋大学, 水产与生命学院,上海 201306 4 中国水产科学院, 东海水产研究所,农业部海洋与河口渔业重点开放实验室,上海 200090 5 浙江省嵊泗县科技协会, 嵊泗 202450
泗礁沙滩碎波带仔稚鱼群落结构的时空变化
毛成责1,2,钟俊生3,*, 花卫华1,2, 陈渊戈4,葛成冈3, 杨平海5
1 江苏省海涂研究中心,南京210036 2 江苏省海洋环境监测预报中心,南京210036 3上海海洋大学, 水产与生命学院,上海201306 4 中国水产科学院, 东海水产研究所,农业部海洋与河口渔业重点开放实验室,上海200090 5 浙江省嵊泗县科技协会, 嵊泗202450
摘要:2010年8月—2011年8月每月大潮期间,在泗礁沙滩8个站位点水深0.5—1.5 m处,沿海岸平行拖曳小型拖网(1m×4m,网目1 mm)采集仔稚鱼样本。共采集仔稚鱼1718尾(隶属于28科46种)。仔稚鱼群落的季节变化显示,根据种类生活史及其对沙滩碎波带利用模式的差异,主要优势种鲻Mugil cephalus、中国花鲈Lateolabrax maculatus、鳀Engraulis japonicus、相模虾虎鱼Sagamia geneionema、细鳞鯻Terapon jarbua、鮻Liza haematocheila及中华侧带小公鱼Stolephorus chinensis分别在3月、5月、6月与8月进入碎波带,栖息时间在1—4个月不等;月份聚类和排序将8个月份(渔获物稀少甚至无渔获月份舍弃)分为2011年3—5月与2010年8—9月、2011年6—8月2个群组。群落的空间结构显示, St.5与St.7分别具有最多的种类数和个体数,说明仔稚鱼偏好栖息于内湾浅滩;但各主要优势种对内湾沙滩的选择有一定的种类特异性,其具体原因有待进一步完调查完善与分析;站点聚类和排序将8个站位分为4组:Sts.1—Sts.2与Sts.7—Sts.8聚为1组,St.5与St.6聚为1组,St.3、St.4分别为1组。各主要优势种对碎波带的利用时间、方式及对沙滩生境的选择均具有一定的种类特异性,其对沙滩生境选择的影响因子有待进一步研究。
关键词:沙滩;碎波带;仔稚鱼;群落结构;时空变化
研究不同水域碎波带仔稚鱼群落结构的时空变化规律,能更好的保护野生鱼类早期资源,为此,国内外许多学者进行了大量研究和报道。Layman等和Gibson等研究表明不同季节碎波带仔稚鱼群落种类组成有着明显差异[1- 2]。蒋日进等在长江口沿岸碎波带研究表明河口水域仔稚鱼群落种类的空间分布受盐度影响[3];此外,关于潮汐、风浪、浑浊度、溶氧、光照等对仔稚鱼群落空间结构影响的研究也有大量报道[4-9]。而Lasiak则认为碎波带仔稚鱼群落的时空变化无明显规律[5]。但更多的学者认为,仔稚鱼群落结构的时空变化受理化因子影响较小,产卵季节和洄游补充机制才是其重要的影响因素[10- 11]。
海岛沙滩地形多样,不同季节与生境的环境因子有较大的差异,适宜不同种类及发育阶段个体栖息,从而导致仔稚鱼群落结构的时空特异性[12-14]。国内外关于岛屿沙滩碎波带仔稚鱼群落结构的动态规律研究少有报道。本研究基于分析不同沙滩仔稚鱼群落个体数和种类的季节性变化,运用聚类和多维标定排序分析,探讨泗礁沙滩碎波带仔稚鱼群落结构的时空变化规律,以期为泗礁鱼类早期资源的保护提供生态学依据。
1研究方法
1.1调查时间、地点及方法
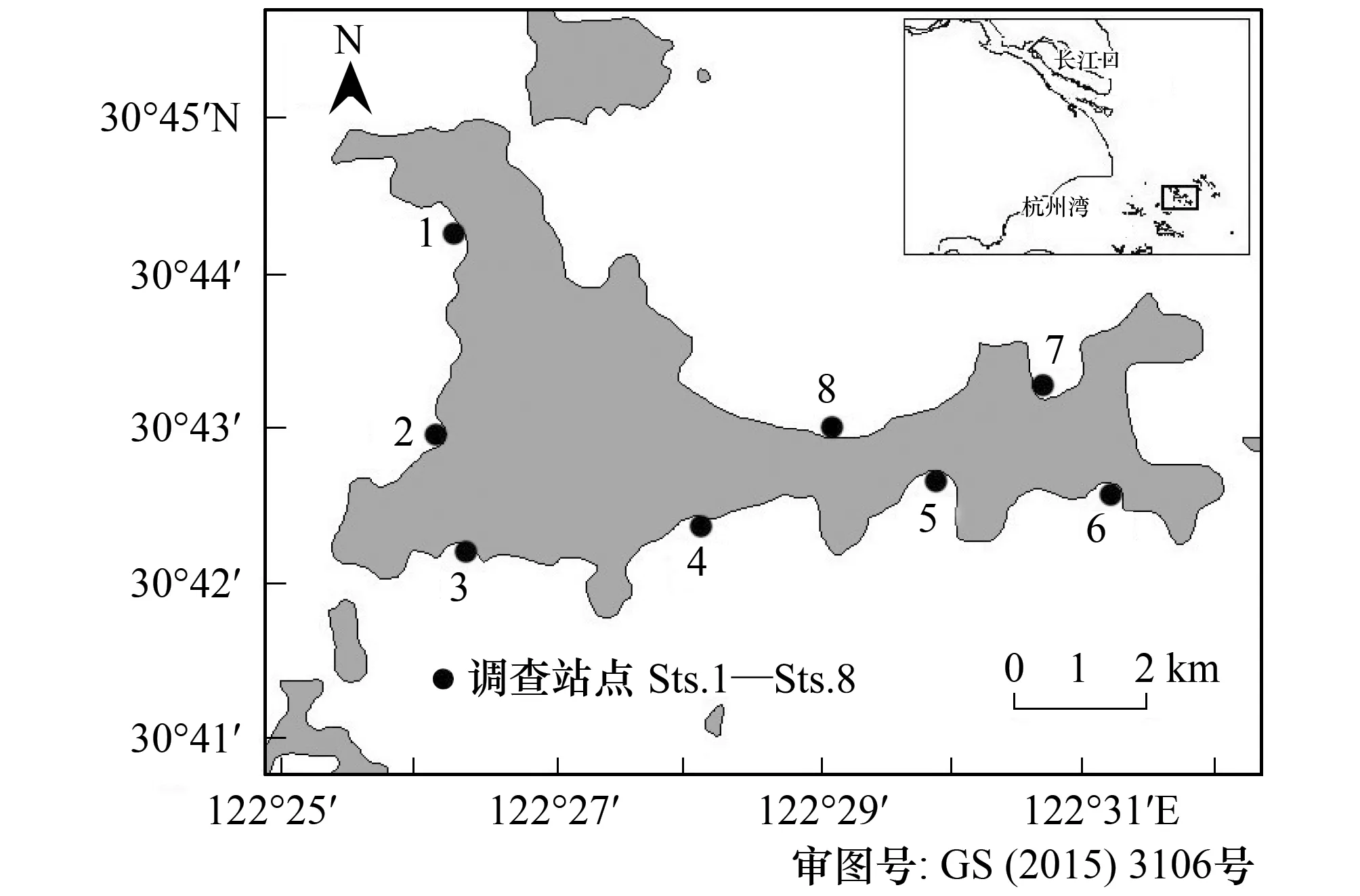
图1 泗礁沙滩碎波带仔稚鱼的调查站点 Fig.1 Survey stations for larval and juvenile fish in the surf zone of Si Jiao Island
除泗礁东部礁石悬崖的海岸之外,在沿岸沙滩设置8个站点(图1)。根据Knox的生态海岸分类系统[15],Sts.1—Sts.3,Sts.5—Sts.7为内湾型沙滩(Protected sandy beaches),St.4与St.8为开放沙滩(Open sandy beaches);St.4与St.6坡度较陡,而其余站点坡度平缓;St.2底质为砾石质, St.3为泥质,其余站点均为沙质(表1)。每月大潮期间2人沿平行海岸方向拖曳小型拖网(1 m×4 m,网目1 mm)。采样时间为2010年8月—2011年8月,每站点拖曳3网次,每次拖曳距离约50m,所得样本当场用5%福尔马林溶液固定,现场测定水温和盐度。2011年4月St.3由于港湾建设围堤封闭。
1.2仔稚鱼鉴定与分类
在Olympus SZX7解剖镜下按照仔稚鱼专著[16-19]将采集的标本鉴定到科、属、种,按Kendall等[20]的仔稚鱼发育分期标准划分各发育阶段并计数。用目测微尺和游标卡尺测取仔稚鱼的体长(SL)。学名按照伍汉霖等[21],同属种名按英文字母进行排序。

表1 泗礁沙滩碎波带各站点地形和底质情况
1.3数据处理
应用优势度(Y)[22]来确定仔稚鱼群落的优势种类,计算公式为:
Y=(ni/N)×fi
式中,ni为第i种仔稚鱼个体数,N为总个体数,fi为第i种仔稚鱼出现频率, 取优势度大于0.02 的为优势种[23]。
分别以站位点与月份为样本,仔稚鱼种类为变量,建立2个以仔稚鱼个体数量的原始矩阵,对数据进行平方根转换后计算(站点/月份)Bray-Curtis相似性指数,建立相似性三角矩阵。根据站点间的相似性指数用组平均连接法(group-average linkage)进行等级聚类(Cluster analysis)和MDS(non-Metric Multidimensional scaling)排序,并通过ANOSIM 来检验不同群落矩阵间差异显著性[24-27]。
聚类分析、排序分析和相似性分析均在PRIMER 6.0中完成。
2结果
2.1仔稚鱼群落种类组成
2010年8月—2011年8月,环岛采样共采集到仔稚鱼1718尾,隶属于28科46种;其中海洋性鱼类29种,占总渔获量的71.91%,河口性鱼类14种(21.17%),洄游性鱼类2种(6.92%),淡水性鱼类1种(1尾)(表2)。
按优势度高低,优势种依次为鳀(Engraulisjaponicus)(0.487),鲻(Mugilcephalus)(0.065),中国花鲈(Lateolabraxmaculatus)(0.065),中华侧带小公鱼(Stolephoruschinensis)(0.055),鮻(Lizahaematocheila)(0.051),相模虾虎鱼(Sagamiageneionema)(0.021),细鳞鯻(Teraponjarbua)(0.020)(表2)。
表22010年8月—2011年8月泗礁沙滩碎波带采集仔稚鱼种类组成
Table 2Species composition of larval and juvenile fishes collected in surf zone of sandy beach in Si Jiao Island from August 2010 to August 2011

种名Species种类代码Speciescode优势度Y发育阶段Developmentalstage生态类型Ecologicalpatterns出现月份Month海鲢科Elopidae 海鲢ElopssaurusEs+CMa8*大海鲢科Megalopidae 大海鲢MegalopscyprinoidesMcy+CMa8*—11鲱科Clupeidae 斑鰶KonosiruspunctatusKp+EMa7 钟氏小沙丁鱼SardinellazunasiSz+DMa8*鳀科Engraulidae凤鲚CoiliamystusCm+C-DMi8*鳀EngraulisjaponicusEj0.487B-EMa5—7中华侧带小公鱼StolephoruschinensisSc0.055B-EMa8*,10,8赤鼻棱鳀ThryssakammalensisTk+EMa8中颌棱鳀ThryssamystaxTm+DMa8* 鳀科sp.Engraulidaesp.Esp+CMa9银鱼科Osmeridae短吻间银鱼HemisalanxbrachyrostralisHb+A-CEs12有明银鱼SalanxacuticepsSa+EEs6狗母鱼科Synodontidae鳄蛇鲻SauridawaniesoSw+CMa8*鲤科Cyprinidae 银飘鱼PseudolaubucasinensisPs+EFr8*银汉鱼科Atherinidae 蓝美银汉鱼AtherinomoruslacunosusAl+DMa8*鱵科Hemiramphidae间下鱵HyporhamphusintermediusHi+EEs8犀鳕科Bregmacerotidae麦氏犀鳕BregmacerosmcclellandiBm+BMa8*海龙科Syngnathidae尖海龙SyngnathusacusSac+EMa10鲻科Mugilidae 鲻MugilcephalusMce0.065DEs3—5鮻LizahaematocheilaLh0.051C-EEs1,6—8马鲅科Polynemidae多鳞四指马鲅EleutheronemarhadinumEr+C-EEs8*—9,7鮨科Serranidae中国花鲈LateolabraxmaculatusLm0.065C-EMi3—6鱚科Sillaginidae少鳞鱚SillagojaponicaSj+CMa8*,7石首鱼科Sciaenidae 棘头梅童鱼CollichthyslucidusCl+EMa6—7小黄鱼LarimichthyspolyactisLp+A-BMa5黄姑鱼NibeaalbifloraNa+DMa7白姑鱼PennahiaargentataPa+DMa8*银鲈科Gerreidae短体银鲈GerresabbreviatusGa+DMa9鲷科Sparidae
8*:2010年8月;+:﹤0.02;发育阶段Developmental stage:A:前弯曲期仔鱼Preflexion larvae;B:弯曲期仔鱼Flexion larvae;C:后弯曲期仔鱼Postflexion larvae;D:稚鱼Juvenile;E:幼鱼Young fish; 生态类型Ecological patterns:Ma:海洋性Marine fish;Es:河口性Estuarine fish;Mi:洄游性Migration fish;Fr:淡水性Freshwater fish
2.2仔稚鱼群落结构的时空分布
2.2.1时间分布及聚类
2010年10月—2011年2月渔获稀少甚至无渔获,为避免稀有数据影响整体分析结果,故在月份聚类中舍弃之。群落数量的月份变化显示(图2),2010年8月种类数最多,为18种;2011年3—4月种类数最少,均为3种。2011年5月个体数最多,为1129尾;2010年9月个体数最少,为28尾。
各月份种类百分比组成显示(图2),各优势种在碎波带的栖息模式不尽相同。按月份顺序,鲻出现于2011年3—5月,3月达到峰值,占该月个体总数的96.61%;中国花鲈出现于2011年3—6月,4月达到峰值,占该月个体总数的84.68%;鯷出现于2011年5—7月,5月达到峰值,占该月个体总数的86.54%;模虾虎鱼仅于5月出现,占该月个体总数的5.23%;细鳞鯻出现于2010年8—9月、2011年6—8月,9月达到峰值,占该月个体总数的50.00%;鮻出现于2011年6—8月,7月达到峰值,占该月个体总数的42.00%;中华侧带小公鱼出现于2010年8月和10月、2011年8月,2011年8月达到峰值,占该月个体总数的84.16%。其余种类数量较少,主要随机出现于夏季。
由月份聚类分析树状图可看出(图2),以相似度15为界可将8个月份为2组:2011年3—5月聚为1组,2010年8—9月、2011年6—8月聚为1组。从各月主要优势种百分比可看出(图2),中国花鲈与鲻在2011年3—5月均有出现,且鲻、中国花鲈、鯷依次在3—5月达到峰值,组内相似度较高,聚为1组;细鳞鯻在2010年8—9月、2011年6—8月均有出现,组内群落具有一定的相似性,故聚为1组,2010年8月与2011年8月有共同优势种中华侧带小公鱼,2011年6—7月有共同优势种鮻、细鳞鯻,故2小组内相似度较高。
基于站点间Bray-Curtis相似性指数的8个月稚鱼群落MDS图的胁强系数为0.01(<0.05),能很好的解释月份间的聚类结果。非参数多元方法(ANOSIM)组间差异显著性分析,检验结果R=0.95(R<1),P(level%)=1.8%(P<0.05),说明2组间的差异显著(图3)。

图2 泗礁沙滩碎波带各月份仔稚鱼个体数百分比组成及聚类分析图Fig.2 Percentage composition of abundance and Cluster dendrogram of larval and juvenile fish community from 8 months图2中种类代码对照见表2
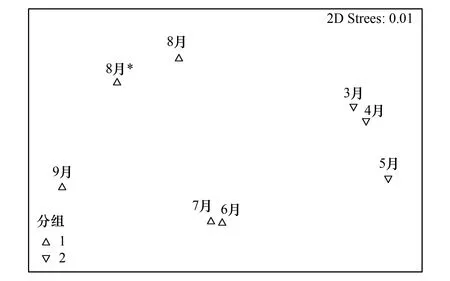
图3 泗礁沙滩碎波带各月仔稚鱼群落度排序分析图 Fig.3 MDS ordination of larval and juvenile fish community from 8sampling months

图4 泗礁沙滩碎波带各站点仔稚鱼个体数百分比组成及聚类分析图Fig.4 Percentage composition of abundance and Cluster dendrogram of larval and juvenile fish community among 8 sampling stations图4中种类代码对照见表2
2.2.2空间分布及聚类
群落数量的空间分布显示(图4),St.5种类最多,为26种;St.3与St.4种类最少,为11种。St.7个体数最多,为634尾,St.4个体数最少,为38尾。
各站点种类百分比组成显示(图4),各主要优势种在空间分布上亦存在一定的差异。鯷、中国花鲈、鲻和中华侧带小公鱼在各站点均有出现,鯷主要分布于泗礁西面的Sts.1—Sts.2和北面的Sts.7—Sts.8,分别占所在站点个体总数的56.45%、72.49%、84.23%和46.74%;中国花鲈主要分布于南面的Sts.5—Sts.6和北面的Sts.7—Sts.8,分别占所在站点个体总数的10.00%、29.37%、1.58%和16.30%;鲻主要分布于西面的Sts.1—Sts.3和南面的St.6,分别占所在站点个体总数的14.52%、13.75%、23.81%和13.49%;中华侧带小公鱼主要分布于南面的Sts.5—Sts.6,分别占所在站点个体总数的30.91%和23.02%,鮻主要分布于北面的Sts.7—Sts.8,分别占所在站点个体总数的2.05%和22.83%;相模虾虎鱼主要分布于西面的Sts.1—Sts.2和北面的St.7,分别占所在站点个体总数的11.29%、3.44%和4.57%,细鳞鯻主要分布于南面的St.5,占所在站点个体总数的9.55%。其余种类个体较少,分布相对随机,无明显规律。
由站点聚类分析树状图可看出(图4),以相似度40为界可将8个站点分为4组:Sts.1—Sts.2与Sts.7—Sts.8聚为1组,St.5与St.6聚为1组,St.3、St.4分别为1组。从各站点主要优势种百分比可看出(图4),鳀为Sts.1—Sts.2与Sts.7—Sts.8的共同优势种且个体百分比均较高,组内相似度较高,聚为1组;St.5与St.6的共同优势种较多,如中国花鲈、中华侧带小公鱼、鲻、鯷等,组内相似度高,聚为1组; St.3、St.4种类数和个体数均较低,种类优势不明显,故分别聚为1组。

图5 泗礁沙滩碎波带各站点仔稚鱼类群落排序分析图 Fig.5 MDS ordination of larval and juvenile fish community among 8 sampling stations
基于站点间Bray-Curtis相似性指数的8个站点稚鱼群落MDS图的胁强系数为0.07(0.05 3讨论 3.1仔稚鱼群落的时间格局 仔稚鱼群落的时间格局根据不同的尺度大致可以分为短时期和长期的两大类,其中短时间的包括昼夜,潮汐等因素影响下仔稚鱼群落的应激性变动,更多的还有洄游和不同发育阶段的大规模迁移,短时间内海况变化等物理因素导致仔稚鱼群落向其他水域移动,如Lasiak等的调查显示风浪是影响仔稚鱼群落多维尺度变动的重要因素,其对仔稚鱼群落结构的影响程度甚至大于季节的变化[5]。 长时间尺度的变化主要包括季节性和年际间的变化。泗礁沙滩碎波仔稚鱼群落的季节性变化与北半球其他碎波带水域的研究结果基本相近,受温度影响明显,种类数和个体数总体为春夏高而秋冬较低,种类数峰值出现在2011年8月;但个体数的峰值却出现在春季(2011年5月)(图2),这与优势种鳀在2011年5月大量进入碎波带栖息有关[28]。此外,主要优势种类在沙滩碎波带出现及栖息时间亦有着明显差异,由于产卵季节及个体发育迁移路线的不同,鲻、中国花鲈、鯷、相模虾虎鱼、细鳞鯻、鮻及中华侧带小公鱼分别在3月、5月、6月与8月进入碎波带,栖息时间在1—4个月不等,而不同种类在碎波带栖息的时间长短及是否连续则与其对碎波带的利用模式有关,具体利用模式可根据月份间体长、日龄等参数的变化推算而定[29-32]。 年际间群落变化则主要体现在相邻年间相同季节或月份间仔稚鱼群落的差异,2010年8月与2011年8月有共有种中华侧带小公鱼、细鳞鯻,但两者的种类数和发育阶段却有着交大的差异,这可能与短期各环境因子变化及偶见种进入碎波带的随机性有关(图2)[1, 5,28]。沙滩碎波带地形复杂,环境因子多变,故仔稚鱼群落年际变化规律需积累多年数据进行详细分析。 3.2仔稚鱼群落的空间结构 泗礁沙滩地形分为开放型和內湾型,底质主要有沙质、泥质与砾石质3种。开放型且坡度陡的沙滩常年风浪扰动剧烈,容易对游泳能力较弱的仔鱼造成物理损伤;水体稳定性及生产力较低,无法为仔稚鱼提供充足的饵料生物;內湾型浅滩风浪较小,且浑浊度高,饵料生物丰富,有利于游泳能力较弱的仔稚鱼躲避捕食者及摄取饵料生物,使之成为许多鱼类早期发育阶段的理想保育场[1- 2]。 內湾浅滩St.5与St.7分别具有最多的种类数和个体数,说明泗礁沙滩碎波带仔稚鱼群落的空间分布偏好与前人研究结果基本相同。但鯷、中国花鲈、鲻、中华侧带小公鱼、鮻等主要优势种在8个沙滩的分布却存在一定的差异,如鯷主要集中在泗礁西面与北面的沙滩,而中华侧带小公鱼则主要分布于南面的沙滩,说明地型与底质相同或相似的沙滩还存在着其他理化或生物因子的差异,从而影响一些特定种类的分布,如光照、流速、流向、饵料生物、捕食者等[16,33-34]。因此,为探明特定种类在相似沙滩生境上分布差异的原因,需在仔稚鱼群落调查的同时,补充所在站点浮游生物群落的调查和相应理化参数的测定。 综上所述,泗礁沙滩碎波带仔稚鱼群落结构季节性变化明显,各主要优势种分别于不同月份出现,在碎波带的滞留时间也不尽相同。在空间分布上,仔稚鱼主要偏好栖息于风浪扰动较小的內湾浅滩;一些游泳能力较强的种类也会选择开放型沙滩栖息,其渔获量稀少可能与采样的网具及采样方法有关[33]。且各优势种在相似內湾沙滩的选择上也存在着一定的差异。因此,泗礁沙滩碎波带仔稚鱼群落结构在显示出明显的季节性和生境偏好的同时,也存在着一定的种类特异性差异。 参考文献(References): [1]Layman C A. Fish assemblage structure of the shallow ocean surf-zone on the eastern shore of Virginia barrier islands. Estuarine, Coastal and Shelf Science, 2000, 51(2): 201- 213. [2]Gibson R N, Ansell A D, Robb L. Seasonal and annual variations in abundance and species composition of fish and macrocrustacean communities on a Scottish sandy beach. Marine Ecology Progress Series, 1993, 98: 89- 105. [3]蒋日进,钟俊生,张冬良,傅萃长.长江口沿岸碎波带仔稚鱼的种类组成及其多样性特征.动物学研究,2008, 29(3): 297- 304. [4]Ruple D L. Occurrence of larval fishes in the surf zone of a northern Gulf of Mexico barrier island. Estuarine, Coastal and Shelf Science, 1984, 18(2): 191- 208. [5]Lasiak T. Structural aspects of the surf-zone fish assemblage at King′s Beach, Algoa Bay, South Africa: short-term fluctuations. Estuarine, Coastal and Shelf Science, 1984, 18(3): 347- 360. [6]Beyst B, Hostens K, Mees J. Factors influencing the spatial variation in fish and macrocrustacean communities in the surf zone of sandy beaches in Belgium. Journal of the Marine Biological Association of the United Kingdom, 2002, 82(2): 181- 187. [7]Clark B M. Variation in surf-zone fish community structure across a wave-exposure gradient. Estuarine, Coastal and Shelf Science, 1997, 44(6): 659- 674. [8]汪振华,章守宇,王凯.三横山鱼礁生境鱼类和大型无脊椎动物群落特征.生态学报,2010,30(8): 2026- 2035. [9]汪振华,赵静,王凯,章守宇.马鞍列岛岩礁生境鱼类群落结构时空格局.生态学报, 2013,33(19): 6218- 6226. [10]Inoue T, Suda Y, Sano M. Surf zone fishes in an exposed sandy beach at Sanrimatsubara, Japan: does fish assemblage structure differ among microhabitats. Estuarine, Coastal and Shelf Science, 2008, 77(1): 1- 11. [11]Kawakami T, Tachihara K. Occurrence and body size changes of drifting land-locked Ryukyu-ayuPlecoglossusaltivelisryukyuensislarvae in the San-numata River, Okinawa-jima Island, Japan. Ichthyological Research, 2010, 57(2): 204- 208. [12]姚幸颖,孙翔,朱晓东.中国海岛生态系统保护与开发综合权衡方法初探.海洋环境科学,2012,31(1):114- 119. [13]魏娜,王中生,冷欣,郑建伟,安树青.海洋岛屿生物多样性保育研究进展.生态学杂志,2008,27(3):460- 468. [14]Adsersen H. Research on islands: classic, recent, and prospective approaches // Vitousek P M, Loope L L, Adsersen H, eds. Islands: Biological Diversity and Ecosystem Function. Berlin: Springer-Verlag,1995. [15]Knox G A. The Ecology of Sea-shores. Boca Raton: CRC Press, 2001. [16]张仁斋,陆穗芬,赵传絪,陈莲芳,臧增嘉,姜言伟.中国近海鱼卵与仔鱼.上海:上海科学技术出版社,1985. [17]Okiyama M. An Atlas of the Early Stage Fishes in Japan. Tokyo: Tokai University Press,1988. [18]Leis J M, Carson B M E. The Larvae of Indo-Pacific Coastal Fishes. Leiden: Brill Academic Publishers, 2000. [19]Kendall A W J. Identification of Eggs and Larvae of Marine Fishes. Tokyo: Tokai University Press, 2011. [20]Kendall A W J, Ahlstrom E H, Moser H G. Early life history stages of fishes and their characters // Moser HG, Richards WJ, Cohen DM, Fahay MP, Kendall AW, Richardson SL, eds. Ontogeny and Systematics of Fishes. American Society of Ichthyologists and Herpetologists, vol 1. Lawrence: Allen Press Inc., 1984. [21]伍汉霖,邵广昭,赖春福.拉汉世界鱼类名典.基隆:水产出版社,1999. [22]孙儒泳.动物生态学原理(第三版).北京:北京师范大学出版社,2001. [23]徐兆礼,陈亚瞿.东黄海秋季浮游动物优势种聚集强度与鲐鲹渔场的关系.生态学杂志,1989,8(4):13- 15,19. [24]周红,张志南.大型多元统计软件PRIMER的方法原理及其在底栖群落生态学中的应用.青岛海洋大学学报, 2003, 33(1): 58- 64. [25]吴荣军,李瑞香,朱明远,郑家声,郑有飞.应用PRIMER软件进行浮游植物群落结构的多元统计分析.海洋与湖沼, 2006, 37(4): 316- 321. [26]Clarke K R, Gorbey R N. PRIMER V5: User Manual/Tutorial. Plymouth: PRIMER-E-E Ltd, 2001. [27]C1arke K R, Warwick R M. Change in Marine Communities: An Approach to Statistical Analysis and Interpretation. 2nd ed. PRIMER-E: Plymouth, 2001. [28]McLachlan A, Brown A. The Ecology of Sandy Shores. 2nd ed. New York: Elsevier, Amsterdam, 2006. [29]Senta T, Kinoshita I. Larval and juvenile fishes occurring in surf zones of western Japan. Transactions of the American Fisheries Society, 1985, 114(4): 609- 618. [30]Félix F C, Spach H L, Moro P S, Schwarz R Jr, Santos C, Hackradt C W, Hostim-Silva M. Utilization patterns of surf zone inhabiting fish from beaches in Southern Brazil. Pan-American Journal of Aquatic Sciences, 2007, 2(1): 27- 39. [31]葛珂珂,钟俊生.长江口沿岸碎波带刀鲚仔稚鱼的日龄组成与生长.水生生物学报, 2010, 34(4): 716- 721. [32]毛成责,钟俊生,方永清,葛成冈,杨平海,陈渊戈,陈新军.东海区泗礁沙滩碎波带仔稚鱼种类组成及栖息地利用模式.中国水产科学, 2013, 20(1): 166- 176. [33]Clark B M, Bennett B A, Lamberth S J. Factors affecting spatial variability in seine net catches of fish in the surf zone of False Bay, South Africa. Marine Ecology Progress Series, 1996, 131: 17- 34. [34]Inoue T, Suda Y, Sano M. Food habits of fishes in the surf zone of a sandy beach at Sanrimatsubara, Fukuoka Prefecture, Japan. Ichthyological Research, 2005, 52(1): 9- 14. Tempo-spatial variation of larval and juvenile fish communities in a sandy surf zone on Si Jiao Island MAO Chengze1,2, ZHONG Junsheng3*, HUA Weihua1,2, CHEN Yuange4, GE Chenggang3, YANG Pinghai5 1TidalFlatResearchCenterofJiangsuProvince,Nanjing210036,China2JiangsuMarineEnvironmentMonitoringandForecastingCenter,Nanjing210036,China3CollegeofFisheriesandLifeScience,ShanghaiOceanUniversity,Shanghai201306,China4KeyandOpenLaboratoryofMarineandEstuaryFisheriesMinisterofAgricultureofChina,EastChinaSeaFisheriesResearchInstitute,ChineseAcademyofFisheriesSciences,Shanghai200090,China5ScienceandTechnologyAssociationofShengsiCounty,Shengsi202450,China Abstract:Our goals were to describe community structure for larval and juvenile fish, and its temporal and spatial variation in the surf zone of a sandy beach on Si Jiao Island. Fieldwork was conducted monthly at eight stations along the coast of Si Jiao Island from August 2010 to August 2011. Samples were collected using small trawls (1 m × 4 m, 1 mm mesh size) and sampling was repeated three times at each station. Water temperature and salinity were measured at the sampling times. Specimens were fixed in 5% formalin in a seawater solution. A total of 1718 larval and juvenile fish representing 46 species from 28 families was collected. The maximum annual fish catch (634 individuals) was collected at Station 7, whereas the maximum annual species richness occurred at Station 5, where 26 species were collected. However, there was no catch at most stations during winter. The larval and juvenile fish community exhibited significant temporal differences among monthly percentages of the seven most dominant species (dominance index ≥0.02).Mugil cephalus was collected from March to May, and was the predominant species in March when it accounted for 96.61% of the catch. Lateolabrax maculatus was collected from March to June, and was predominant in April, accounting for 84.68% of the catch. Engraulis japonicus was collected from May to July and was predominant in May, accounting for 86.54% of the catch. Sagamia geneionema was collected only in May and made up 5.23% of the catch.Terapon jarbua was collected in August and September 2010, and June to August 2011. This species was predominant in September, making up 50.00% of the catch. Liza haematocheila was collected from June to August 2011 and was predominant in July, being 42.00% of the catch. Stolephorus chinensis was collected in August 2010, October 2010, and August 2011, being predominant in August 2011 when it accounted for 84.16% of the catch. According to cluster and MDS analysis (based on fish species and abundance) the eight sampling months were best divided into 2 groups: March, April, and May of 2011 in group Ⅰ and the remaining months in group Ⅱ. Spatial variation of the larval and juvenile fish community suggested they preferred moderately protected sandy beaches. However, there were also differences in the distribution of the top seven dominant species.E. japonicus occurred mainly at Stations 1, 2, 7, and 8, and accounted for 56.45%, 72.49%, 84.23%, and 46.74% of the catch per station, respectively. L. maculatus occurred primarily at Stations 5, 6, 7, and 8, making up 10.00%, 29.37%, 1.58%, and 16.30% of the catch at each station, respectively. M. cephalus occurred primarily at Stations.1—3, and 6, and was 14.52%, 13.75%, 23.81%, and 13.49% of the catch at each station, respectively. S. chinensis occurred primarily at Stations 5 and 6, making up 30.91% and 23.02% of the catch, respectively. L. haematocheila occurred primarily at Stations 7 and 8, making up 2.05% and 22.83% of the catch per station, respectively. S. geneionema occurred primarily at Stations 1, 2, and 7, and made up 11.29%, 3.44%, and 4.57% of the catch, respectively. T. jarbua mainly occurred only at Station 5 and made up 9.55% of the catch at that station. According to cluster and MDS analysis (based on fish species and abundance), the eight sampling stations were best divided into 4 groups: group I consisted of Stations 1, 2, 7, and 8. Stations 5 and 6 were in group Ⅱ, and Station 3 and 4 constituted group Ⅲ and Ⅳ, respectively. The pattern of temporal use and preference for sandy beach sites by larval and juvenile fish inhabiting the surf zone of Si Jiao Island were species-specific. The factors influencing the preferences require further investigation. Key Words:sandy beach; surf zone; fish larvae and juveniles; community structure; temporal and spatial variation 基金项目:长江渔业资源管理委员会办公室项目(D-8006-14-0033);上海市重点学科水生生物学建设项目(S0701);海洋公益性行业科研专项(201205005) 收稿日期:2014- 11- 05; 修订日期:2015- 12- 15 *通讯作者 Corresponding author.E-mail: jszhong@shou.edu.cn DOI:10.5846/stxb201411052185 毛成责,钟俊生 花卫华, 陈渊戈,葛成冈, 杨平海.泗礁沙滩碎波带仔稚鱼群落结构的时空变化.生态学报,2016,36(8):2286- 2294. Mao C Z, Zhong J S, Hua W H, Chen Y G, Ge C G, Yang P H.Tempo-spatial variation of larval and juvenile fish communities in a sandy surf zone on Si Jiao Island.Acta Ecologica Sinica,2016,36(8):2286- 2294.

