不同林龄杉木人工林细根氮稳定同位素组成及其对氮循环的指示
郑璐嘉, 黄志群,*, 何宗明, 刘瑞强, 肖好燕 , 杜 婷
1 湿润亚热带山地生态国家重点实验室培育基地,福州 350007 2 福建师范大学地理研究所,福州 350007 3 湿润亚热带生态地理过程教育部重点实验室,福州 350007 4 福建农林大学林学院,福州 350002 5 福建南平峡阳林场,南平 353000
不同林龄杉木人工林细根氮稳定同位素组成及其对氮循环的指示
郑璐嘉1,2,3, 黄志群1,2,3,*, 何宗明4, 刘瑞强1,2,3, 肖好燕1,2,3, 杜婷5
1 湿润亚热带山地生态国家重点实验室培育基地,福州350007 2 福建师范大学地理研究所,福州350007 3 湿润亚热带生态地理过程教育部重点实验室,福州350007 4 福建农林大学林学院,福州350002 5 福建南平峡阳林场,南平353000
摘要:通过测定中国亚热带5个不同林龄(3、8、14、21、46a)杉木人工林不同序级细根氮稳定同位素(δ15N)组成,研究它们对土壤净氮矿化、硝化速率的指示并将其与叶片δ15N值对土壤氮循环速率的指示作用进行对比,从而探索研究植物同位素对土壤氮循环状况的指示作用。结果显示,不同林龄杉木人工林细根δ15N值间具有极显著差异,3年生幼林与46年生老林显著高于其他林分。不同序级细根δ15N值间的差异未达到显著水平,但具有随着序级增大δ15N值逐渐降低的趋势。细根δ15N值与土壤净氮矿化和净硝化速率间均具有极显著相关性,并有随着细根序级减小相关性逐渐增加的趋势,而叶片δ15N值与土壤氮循环速率间则不具有显著相关性。研究结果表明,相较叶片来说,细根氮稳定同位素组成能更好地指示土壤氮循环速率,且序级越小的细根指示作用越强;细根δ15N值反映出尽管中国亚热带地区氮沉降现象严重,氮素可能仍是处于速生期杉木人工林生长的限制因素。
关键词:年龄序列;杉木;细根;氮循环速率;稳定同位素
氮素是植物体生长所必不可少的大量元素之一,它还是植物体蛋白质、核酸、叶绿素等物质的主要组成部分。然而,人类活动如化肥农药的生产和使用及化石燃料的燃烧导致输入森林生态系统的氮素持续增加[1- 2],过量的氮输入将导致森林生态系统氮饱和,还将影响氮素淋失和气态损失的速率,从而造成地下水污染等环境问题[3- 4]。因此,了解森林生态系统的氮循环速率,有助于更好地判断林分氮素利用状况,从而为制定适当的施肥措施和减少由氮饱和引发的环境问题提供科学依据。
树木叶片的氮稳定同位素组成是研究森林生态系统氮循环速率的有利工具。由于氮循环的许多过程均具有同位素分馏现象,故人们认为叶片的δ15N值能较好地指示土壤氮循环速率及生态系统氮饱和程度[5- 7]。但由于氮素在植物体内传输与同化等过程也具有同位素分馏现象,细根中的氮素受到的植物体内氮同位素分馏较叶片少,因此细根δ15N值与叶片δ15N值相比可能能够更好地指示土壤氮循环问题。且前人在研究细根δ15N值对土壤氮循环指示能力时采用的研究对象多为不同树种[8],因此同一树种不同年龄的细根δ15N值的研究还有待开展。另外,前人针对细根δ15N值与土壤氮循环关系研究时一般没有考虑细根序级的影响。但近几年来人们对细根的研究开始将细根按不同序级分类,因为一些研究认为不同序级的细根具有不同的生态学功能[9],因此不同序级的细根δ15N值对土壤氮循环速率的指示作用是否有差异,这一问题也有待研究。
杉木(Cunninghamialanceolata)是中国亚热带地区常见且最重要的造林树种之一,第7次全国森林资源清查结果表明:截止2008年,全国杉木人工林面积达853.86万hm2,占全国人工乔木林总面积的21.35%。本文选取处于不同生长阶段不同序级杉木人工林的细根氮稳定同位素组成为研究对象,一方面通过对比不同序级细根、不同叶龄叶片δ15N值对土壤氮循环速率的指示能力来探索出研究杉木人工林氮循环相关问题的有利工具,另一方面利用细根δ15N值的指示作用来探讨不同生长阶段杉木人工林氮素利用状况的区别,从而为因地制宜地制定营林措施提供科学依据。
1研究区域
本研究样地设置在福建南平峡阳林场(26°48′N,117°59′E),位于武夷山脉东南侧,海拔高度为229—246 m。该区年均气温为20.0 ℃,年均降水量为1644mm,降水主要集中在每年春夏季之间。年平均相对湿度为83%,年平均蒸发量为1143mm。本研究以5个不同林龄(3、8、14、21、46a)的杉木人工林为研究对象,各林龄样地间最大距离不超过1km。在各林龄的杉木人工林中随机设立4个大小为20m×20m的小区,每个小区包括有16棵杉木,5个林龄共设20个小区。各林分土壤理化性质及基本情况见表1。

表1 不同林龄杉木人工林基本概况
同一行不同小写字母表示两个林龄之间差异显著(P<0.05)
2研究方法
2.1细根样品的采集
在2013年10月根据平均树高和胸径于每个小区选取4棵标准木,在其下取0—10cm深度的细根样品。并根据序级将采集的细根样品分为1级根,2级根,3级根和粗根4个部分,其中直径小于2mm的根系的最远端为1级根,1级根交汇处为2级根,以此类推,大于2mm的根系为粗根。然后将同一小区4棵树下采集的不同序细根样品混合均匀,带回实验室后放入60°C的烘箱中烘干至恒重,利用玛瑙研钵将样品磨碎至过0.154mm筛,制成待测样。
2.2杉叶样品的采集
于同一时间在每个小区采集杉木细根的标准木树冠中部,选取向阳一侧长势良好的活枝采集杉木叶,根据叶片年龄将采集的叶片分为当年生、1年生、2年生、3年生4个部分(林龄为3a的杉木林叶片只分为前3个叶龄)。然后将同一个小区4棵标准木的样品均匀混合,取混合样带回实验室。随后将叶片样品放入60°C的烘箱中烘干至恒重,利用自动球磨仪将样品磨碎至过0.154mm筛,制成待测样。
2.3土壤样品的采集
于同一时间在每个小区内,去除地表凋落物后,用内径为3.7 cm的土钻沿对角线等距离钻取5个点,采集0—10cm土层的土样,并将同一小区的土样均匀混合,取混合样。随后将土壤样品过2mm筛作为净氮矿化培养待测样。
2.4样品同位素比率的测定及计算
利用同位素质谱仪(Thermo Scientific MAT253)测定叶片、细根、土壤样品的氮稳定同位素比率,用δ15N表示,并按照下式计算得到:
δ15Ν(‰)=(Rsample-Rstandard)/Rstandard× 1000
式中,R为15N/14N的比值,Rsample为测定样品的R值,Rstandard为标准物质的R值。
2.5土壤净氮矿化测定
土壤净氮矿化速率=(培养后土壤样品矿质氮含量-培养前土壤样品矿质氮含量)/培养天数
土壤净硝化速率=(培养后土壤样品NO3-N含量-培养前土壤样品NO3-N含量)/培养天数
2.6数据分析
数据通过SPSS 17.0和Excel 2003进行分析,由origin 8.0软件作图。采用多重比较方差分析法对比不同林龄杉木叶片、细根及土壤氮稳定同位素间的差异,显著水平设为P=0.05。利用Pearson相关系数来检验变量之间的相关性。
3结果分析
3.1不同林龄杉木人工林细根氮稳定同位素差异
多重比较方差分析结果显示,不同林龄杉木人工林细根δ15N值达到了极显著差异(P=0.00),总体具有3年生(2.10‰)>46年生(-0.24‰)>8年生(-0.29‰)>21年生(-0.99‰)>14年生(-1.03‰)的趋势(图1)。其中,3年生幼林与46年生老林显著高于其他林分,14年生杉木林显著低于其他林分。而细根δ15N值在不同序级间总体没有显著差异(P>0.05),但不同林龄细根δ15N值整体均具有随着序级增大而减小的趋势(图1)。
3.2不同林龄杉木人工林土壤净氮矿化速率的差异
多重比较方差分析结果显示不同林龄杉木人工林土壤净氮矿化、硝化速率间不具有显著差异(P>0.05)。但具有3年生杉木人工林净氮矿化、硝化速率最高,46年生最低的趋势(图2)。

图1 不同林龄之间细根δ15N值的差异 Fig.1 Differences of fine root δ15N between different forest ages

图2 不同林龄之间土壤净氮矿化、硝化速率间的差异 Fig.2 Differences of soil net N mineralization, nitrification rates between different forest ages
3.3不同林龄杉木人工林土壤净氮矿、硝化化速率与不同组分氮稳定同位素间的关系
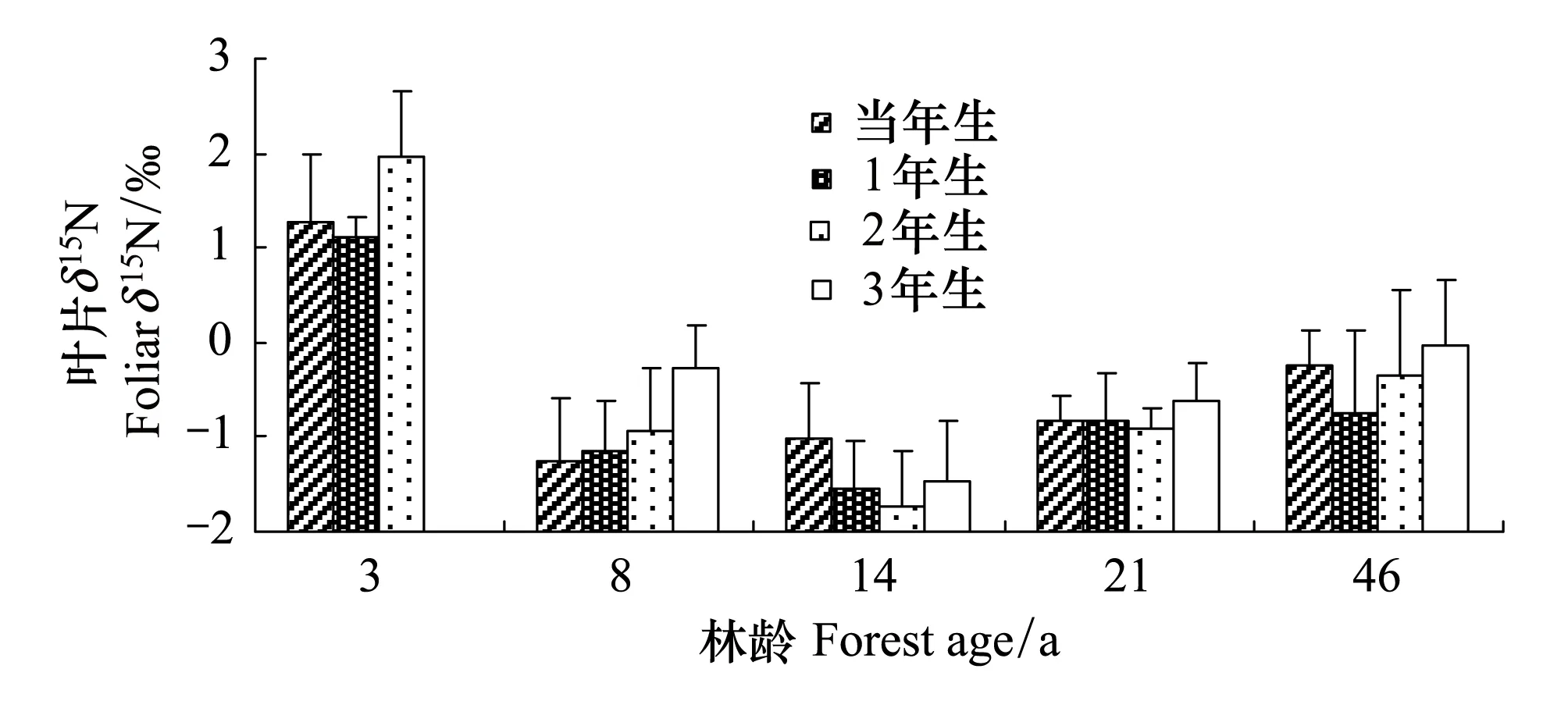
图3 不同林龄之间叶片δ15N值的差异 Fig.3 Differences of foliar δ15N between different forest ages
多重比较方差分析结果显示不同林龄杉木叶片δ15N值达到了极显著差异(P=0.00),总体具有3年生(1.44‰)>46年生(-0.40‰)>8年生(-0.80‰)>21年生(-0.90‰)>14年生(-1.44‰)的趋势(图3)。不同叶龄叶片δ15N值在各林龄间均未达到显著差异(P>0.05)。
不同林龄杉木人工林细根δ15N值与土壤净氮矿、硝化速率间均具有极显著相关性(P=0.00,P=0.00);不同序级细根δ15N值与土壤净氮矿、硝化速率间的相关性按相关系数从大到小排列为:一级根>二级根>三级根(图4)。而粗根以及叶片δ15N值与土壤净氮矿、硝化速率间均不具有显著相关性(P>0.05)(数据无显示)。

图4 不同序级细根 δ15N值与净氮矿化、硝化速率间的关系Fig.4 The correlation between different order of fine root δ15N and the rates of soil net N mineralization and nitrification
4分析与讨论4.1不同林龄杉木人工林细根氮稳定同位素组成差异
本研究中不同林龄杉木人工林细根氮稳定同位素组成具有极显著差异,其中幼林(3年生)和老林(46年生)的细根δ15N值显著高于处于速生期的林分。研究认为,影响林分植物δ15N值差异的原因主要有:①氮循环速率;②植物利用氮素的形式(铵态氮、硝态氮);③植物物候;④共生菌根的类型和数量[10- 11]。由于本研究的对象是同一树种,所以植物物候、对氮素的利用形式以及共生菌根的类型应该基本相同,因此造成不同林龄杉木人工林细根氮稳定同位素组成差异的原因可能是氮循环速率和菌根生物量的差异所致。
氮循环速率对植物δ15N值影响的原因主要是因为土壤氮矿化和硝化过程伴有较强烈的同位素分馏现象,而微生物在参与这些过程时更倾向于利用质量较轻的14N,从而使得土壤氮矿化、硝化过程的反应剩余物中15N富集,反应产物中14N富集。土壤氮循环速度较快的生态系统中土壤氮矿化特别是硝化作用的反应产物较易通过淋失等过程离开森林生态系统,这样植物可利用的氮素中15N所占的比例便会上升[12- 13],而植物吸收利用了这些15N含量较高的氮素后,便会导致细根、叶片等组分的δ15N值相应上升。前人的研究还认为共生菌根的类型和生物量同样能影响植物的δ15N值。原因是因为菌根在吸收、利用氮素时对氮稳定同位素具有强烈的分馏作用,倾向于使用质量较轻的14N[14],因此一个林分共生的菌根生物量较高时,其在吸收利用氮素时就会产生较强烈的15N分馏现象,从而降低植物的δ15N值。
本研究中,不同林龄杉木人工林净氮矿化、硝化速率间不具有显著差异,但有幼林较高的趋势,这一结果与幼林细根15N值高于其他林龄的趋势相符,说明幼林细根δ15N值显著较高的原因可能是由于其林分具有较高的氮循环速率。而本研究中老林(46年生)的细根δ15N值虽然显著高于除3年生以外的林分,但其净氮矿化、硝化速率间却有低于其他林分的趋势,这一方面可能由于净氮矿化、硝化速率还需考虑微生物固持量以及林下植被对氮素竞争利用的影响,本研究中老林的微生物及林下植被生物量都较高(数据未显示),所以可能46年生老林具有较高的总氮矿化速率同样具有氮转化速率较快的特点,但由于较高的微生物固持量等因素导致净氮矿化速率较低。另一方面,造成46年生林分细根δ15N值显著高于处于速生期林分的原因可能是因为其共生菌根的生物量较低,因此其受到菌根对δ15N的分馏作用较小,并导致其植物δ15N值较高。而前人的研究发现,一个林分氮素可利用性越低的时候,菌根在林分吸收利用氮素时所起的作用就越高,因此如果造成46年生林分细根δ15N值显著高于处于速生期林分的原因是菌根生物量较低的话,也可从侧面说明该林分的氮素可利用性较高,氮循环速率较快,我们还开展进一步的实验来验证菌根真菌生物量对细根δ15N值的影响。
另外,前人的研究发现植物δ15N值能用来指示林分的氮饱和程度[15- 18]。他们认为,这些组分的δ15N值越高则说明林分的氮饱和程度越高,原因是因为氮饱和程度较高的林分其氮循环较为开放,氮循环速率较高。因此本研究中不同林龄杉木人工林细根氮稳定同位素组成差异还指示出3年生和46年生杉木人工林氮饱和程度显著高于处于速生期林分。由于中国亚热带地区被认为是氮沉降严重地区,有研究甚至认为该地区林分已经由氮限制转化为磷限制。而本研究的结果却显示尽管同在中国亚热带地区,处于速生期的杉木人工林氮饱和程度显著低于幼林和老林,因此氮素可能仍是限制处于速生期杉木人工林生长的因素。
4.2不同林龄植物氮稳定同位素与土壤氮转化速率的关系
从研究结果可看出,杉木人工林细根δ15N值与土壤氮循环速率之间的相关性大于叶片,前人研究认为氮素在植物体内传输、同化时也会发生一定的氮同位素分馏现象[19-20]。本研究中不同细根序级间δ15N值的差异虽然并不显著,但存在随着细根序级增大,相应的δ15N值逐渐减小的趋势,这一现象可看作是氮素在植物体内传输过程的同位素分馏现象导致。前人专门开展研究发现植物体内的15N分馏现象导致细根与叶片δ15N值相差7‰[21-22],Handley[5]等人认为,植物体内的同位素分馏现象将导致不同组分间的氮稳定同位素比率差异最高达到12‰。由于细根中的氮素在植物体内传输的距离小于叶片等其他植物组分,因此其中的氮素受到的15N分馏比叶片少,所以细根δ15N值能比叶片δ15N值更好地反映土壤N循环的情况。
然而,前人在对比研究森林生态系统各组分δ15N值对土壤N循环速率的指示作用时的研究对象多为不同树种,而不同树种植物体内吸收、传输、同化氮素等过程的同位素分馏强度具有种间差异,这些差异加大了研究对象的细根与叶片在氮稳定同位素上的差异。而本文的研究对象是处于不同林龄的同一树种,同样也得到细根δ15N值的指示作用较强的结果。这可以说明在植物体内氮同位素分馏强度相同的情况下,细根δ15N值对土壤N循环速率的指示作用比叶片δ15N值强的特点仍能得到体现。这是对“细根δ15N值是土壤N循环速率更好的指示物”有力的支持。
另外,本研究将细根分为不同序级作为研究对象后仍发现了其δ15N值对土壤N循环速率间的显著相关性,且具有随着细根序级降低,两者的相关性越高的趋势,这说明了序级较低的细根δ15N值能更好地指示土壤氮循环速率。造成这一结果的原因一方面可能因为细根在吸收氮素时,不同序级间具有氮同位素分馏作用,因此序级较低的细根受到同位素分馏的影响较小。另一方面可能与不同序级细根的功能差异有关。前人的研究发现,细根按功能可以被分为吸收根和先锋根两类[23- 24],吸收根主要起到吸收养分和水分的功能,而先锋根的作用往往是起到构建根系结构的作用并不具有吸收功能。人们认为1、2级根一般为吸收根,因此本文的研究结果可能说明,以吸收养分为主要功能的1级根δ15N值能比其他序级的细根更好地反映土壤氮循环状况。
4.3结论
(1)3年生和46年生林分的δ15N值显著高于处于速生期的林分,原因可能是这2个林分的氮循环速率较高,菌根生物量较低。这一结果还指示出,虽然同处森林氮饱和现象严重的中国亚热带地区,幼林和老林的氮饱和程度显著高于处于速生期的林分。
(2)细根δ15N值对土壤氮循环速率的指示作用较强,其中又以一级根的指示作用最强。
致谢:野外实验得到福建省南平市峡阳国有林场的支持和帮助,特此致谢。
参考文献(References):
[1]Galloway J N, Schlesinger W H, Levy H, Michaels A, Schnoor J L. Nitrogen fixation: Anthropogenic enhancement-environmental response. Global Biogeochemical Cycles, 1995, 9(2): 235- 252.
[2]Galloway J N, Dentener F J, Capone D G, Boyer E W, Howarth R W, Seitzinger S P, Asner G P, Cleveland C, Green P, Holland E, Karl D M, Michaels A F, Porter J H, Townsend A R, Vörösmarty C J. Nitrogen cycles: past, present, and future. Biogeochemistry, 2004, 70(2): 153- 226.
[3]Stoddard J L. Long-term changes in watershed retention of nitrogen: Its causes and aquatic consequences // Baker L A, ed. Environmental Chemistry of Lakes and Reservoirs, Advances in Chemistry Series Volume 237. Washington, DC: American Chemical Society, 1994.
[4]Peterjohn W T, Adams M B, Gilliam F S. Symptoms of nitrogen saturation in two central Appalachian hardwood forest ecosystems. Biogeochemistry, 1996, 35(3): 507- 522.
[5]Handley L, Raven J A. The use of natural abundance of nitrogen isotopes in plant physiology and ecology. Plant, Cell & Environment, 1992, 15(9): 965- 985.
[6]Nadelhoffer K, Fry B. Nitrogen isotope studies in forest ecosystems // Michener R H, Lajtha K, eds. Stable Isotopes in Ecology and Environmental Science. Oxford: Blackwell, 1994: 22- 44.
[7]Sah S. Isotope ratios and concentration of N in needles, roots and soils of Norway spruce (Picea abies [L.] Karst.) stands as influenced by atmospheric deposition of N. Journal of Forest Science, 2005, 51(10): 468- 475.
[8]Templer P H, Arthur M A, Lovett G M, Weathers K C. Plant and soil natural abundance δ15N: indicators of relative rates of nitrogen cycling in temperate forest ecosystems. Oecologia, 2007, 153(2): 399- 406.
[9]杨秀云, 韩有志, 张芸香, 武小钢. 采伐干扰对华北落叶松细根生物量空间异质性的影响. 生态学报, 2012, 32(1): 64- 73.
[10]Högberg P. Tansley review No. 9515N natural abundance in soil-plant systems. New Phytologist, 1997, 137(2): 179- 203.
[11]Pardo L H, Templer P H, Goodale C L, Duke S, Groffman P M, Adams M B, Boeckx P, Boggs J, Campbell J, Colman B, omptonJ C, Emmett B, Gundersen P, Kjønaas J, Lovett G, Mack M, Magill A, Mbila M, Mitchell M J, McGee G, McNulty S, Nadelhoffer K, Ollinger S, Ross D, Rueth H, Rustad L, Schaberg P, Schiff S, Schleppi P, Spoelstra J, Wessel W. Regional assessment of N saturation using foliar and root δ15N. Biogeochemistry, 2006, 80(2): 143- 171.
[12]Pardo L H, Hemond H F, Montoya J P, Fahey T J, Siccama T G. Response of the natural abundance of15N in forest soils and foliage to high nitrate loss following clear-cutting. Canadian Journal of Forest Research, 2002, 32(7): 1126- 1136.
[13]Fang H J, Yu G R, Cheng S L, Zhu T H, Zheng J J, Mo J M, Yan J H, Luo Y Q. Nitrogen-15 signals of leaf-litter-soil continuum as a possible indicator of ecosystem nitrogen saturation by forest succession and N loads. Biogeochemistry, 2011, 102(1/3): 251- 263.
[14]Hobbie J E, Hobbie E A.15N in symbiotic fungi and plants estimates nitrogen and carbon flux rates in arctic tundra. Ecology, 2006, 87(4): 816- 822.
[15]Garten C T Jr, Van Miegroet H. Relationships between soil nitrogen dynamics and natural15N abundance in plant foliage from Great Smoky Mountains National Park. Canadian Journal of Forest Research, 1994, 24(8): 1636- 1645.
[16]Pardo L H, Hemond H F, Montoya J P, Siccama T G. Long-term patterns in forest-floor nitrogen-15 natural abundance at Hubbard Brook, NH. Soil Science Society of America Journal, 2001, 65(4): 1279- 1283.
[17]Xu Y Q, He J C, Cheng W X, Xing X R, Li L H. Natural15N abundance in soils and plants in relation to N cycling in a rangeland in Inner Mongolia. Journal of Plant Ecology, 2010, 3(3): 201- 207.
[18]姚凡云, 朱彪, 杜恩在.15N 自然丰度法在陆地生态系统氮循环研究中的应用. 植物生态学报, 2012, 36(4): 346- 352.
[19]Evans R D. Physiological mechanisms influencing plant nitrogen isotope composition. Trends in Plant Science, 2001, 6(3): 121- 126.
[20]Dawson T E, Mambelli S, Plamboeck A H, Templer P H, Tu K P. Stable isotopes in plant ecology. Annual Review of Ecology and Systematics, 2002, 33(1): 507- 559.
[21]Yoneyama T, Kaneko A. Variations in the natural abundance of15N in nitrogenous fractions of komatsuna plants supplied with nitrate. Plant and Cell Physiology, 1989, 30(7): 957- 962.
[22]Evans R, Bloom A, Sukrapanna S, Ehleringer J. Nitrogen isotope composition of tomato (Lycopersicon esculentum Mill. cv. T-5) grown under ammonium or nitrate nutrition. Plant, Cell & Environment, 1996, 19(11): 1317- 1323.
[23]Loades K, Bengough A, Bransby M, Hallett P. Planting density influence on fibrous root reinforcement of soils. Ecological Engineering, 2010, 36(3): 276- 284.
[24]Zadworny M, Eissenstat D M. Contrasting the morphology, anatomy and fungal colonization of new pioneer and fibrous roots. New Phytologist, 2011, 190(1): 213- 221.
δ15N in fine roots ofCunninghamialanceolataplantations of different ages and implications for soil nitrogen cycling rates
ZHENG Lujia1,2,3, HUANG Zhiqun1,2,3,*, HE Zongming4, LIU Ruiqiang1,2,3, XIAO Haoyan1,2,3, DU Ting5
1CultivationBaseofStateKeyLaboratoryofHumidSubtropicalMountainEcology,Fuzhou350007,China2InstituteofGeography,FujianNormalUniversity,Fuzhou350007,China3MinistryofEducationKeyLaboratoryofHumidSubtropicalEcoGeographicalProcess,Fuzhou350007,China4ForestryCollege,FujianAgricultureandForestryUniversity,Fuzhou350002,China5XiayangStateForestFarmofFujianProvince,Nanping,Fujian353000,China
Abstract:Nitrogen(N) is an essential nutrient to plants. However, increasing N deposition into forest ecosystems due to will result in N saturation. The aims of this study were to (1) measure the composition of stable nitrogen isotope (δ15N) in fine roots in Cunninghamia lanceolata plantations at different ages and of various root orders, (2) examine whether the stable isotopes (δ15N) of fine roots in different orders were representative of the relative rates of soil net nitrogen (N) mineralization/nitrification across stands at different ages, and (3) determine whether fine root δ15N could be used as a better indicator of the rate of soil N cycling than foliar δ15N. We analyzed the δ15N of fine roots and leaves in C. lanceolata plantations at 3, 8, 14, 21, and 46 years of age in subtropical China and carried out a 28-day laboratory incubation to analyze soil potential net N mineralization and nitrification rates. The results showed that there were significant differences in the δ15N values of fine roots between different forest ages, the δ15N was higher in 3- and 46-year-old plantations than those at other ages. While there were no significant differences between δ15N values of fine roots in different root orders, the δ15N values of fine roots tended to be lower with the increased orders of root. The δ15N values of fine roots at all ages were significantly correlated with the potential net N mineralization and net nitrification rates, and the correlation coefficients between these parameters seemed to decrease with increasing root orders; however, this correlation was not significant between foliar δ15N at different ages and the soil N cycling rates. In conclusion, the result imply that fine root δ15N could be a better indicator of the relative rate of N cycling than the δ15N value of leaves, and first order roots were the best indicator. Moreover, fine root δ15N values suggested that N may still be a factor limiting the growth of the C. lanceolata plantations at the rapid-growth stages, despite the observation that subtropical China has the highest rates of N deposition in China.
Key Words:Chrono sequence; Cunninghamia lanceolata; fine roots; N cycling rate; stable isotope
基金项目:国家973计划和重大科学研究计划项目(2014CB954002); 国家自然科学基金项目(41371269); 教育部新世纪优秀人才支持计划(DB-168)
收稿日期:2014- 10- 31; 网络出版日期:2015- 08- 18
*通讯作者
Corresponding author.E-mail: zhiqunhuang@hotmail.com
DOI:10.5846/stxb201410312134
郑璐嘉, 黄志群, 何宗明, 刘瑞强, 肖好燕, 杜婷.不同林龄杉木人工林细根氮稳定同位素组成及其对氮循环的指示.生态学报,2016,36(8):2185- 2191.
Zheng L J, Huang Z Q, He Z M, Liu R Q, Xiao H Y, Du T.δ15N in fine roots ofCunninghamialanceolataplantations of different ages and implications for soil nitrogen cycling rates.Acta Ecologica Sinica,2016,36(8):2185- 2191.

