干旱对虎耳草光合特性及有效成分含量的影响
贺安娜, 左浪柱, 李胜华, 梁 娟
(怀化学院 1.生物与食品工程学院; 2.民族药用植物资源研究与利用湖南省重点实验室;3.湘西药用植物与民族植物学湖南省高校重点实验室,湖南 怀化 418008)
干旱对虎耳草光合特性及有效成分含量的影响
贺安娜1,2,3,左浪柱1,李胜华1,2,3,梁娟1,2,3
(怀化学院 1.生物与食品工程学院;2.民族药用植物资源研究与利用湖南省重点实验室;3.湘西药用植物与民族植物学湖南省高校重点实验室,湖南 怀化418008)
摘要:为探讨虎耳草人工栽培的水分条件,利用LI-6400便携式光合仪研究了不同干旱条件下盆栽虎耳草的光合作用,同时采用LC-20AT高效液相色谱对虎耳草中没食子酸和岩白菜素含量进行了测定.结果表明:土壤体积含水量随处理天数的增加显著减少,处理42 d后,体积含水量仅5.8%.净光合速率随干旱加剧显著降低;蒸腾速率在干旱14 d时有所上升,达4.08 mmol·m-2·s-1,此时气孔导度也有所升高.叶绿素荧光参数值显示,光系统Ⅱ反应中心开放程度、光化学效率、电子传递速率等都随干旱加剧而降低,处理28 d时下降最显著.干旱能显著降低虎耳草的生物产量,处理42天时,虎耳草干重仅10.7 g·pot-1,但适度的干旱能提高有效成分含量,没食子酸和岩白菜素含量在干旱14 d时最高,分别为2.11 mg·g-1及4.13 mg·g-1.结论:虎耳草较耐旱,干旱处理14 d时仍能维持一定的光合作用,保证生物产量的积累,并显著提高有效成分含量,人工种植虎耳草时可适度地控制水分给予.
关键词:虎耳草;干旱;光合特性;有效成分
水分条件对植物的对光合作用有显著影响[1],干旱通常引起植物最大净光合速率、光饱和点的降低和光补偿点、叶片呼吸速率的增加[2],同时对植物叶片叶绿素荧光参数及光合机构都有非常显著的影响[3].对于种植药用植物而言,充足的水分供应,可维持较高的光合作用,保证药材高产,而适当的水分胁迫可增加体内次生代谢产物的含量[4],提高药材品质,因此探讨水分条件成为药用植物栽培的热点研究之一.
虎耳草是多年生草本植物,叶似虎耳形态优美,常作为盆景观赏植物.该草全草入药,用于抗炎止咳等[5],其主要活性成分为虎耳草素(岩白菜素)及有机酸类物质[6].虎耳草因生长的地域不同,活性成分含量有较大差异[7],不同种植环境条件下,虎耳草活性成分也有明显差异[8-10].目前关于虎耳草的研究主要集中在成分与药理方面[11-13],人工栽培方面的报道很少,更未见水分条件对虎耳草光合生理及有效成分的影响报道.本文通过盆栽控水的方法,研究了不同干旱条件对虎耳草光合作用及有效成分含量的影响,旨在为虎耳草的栽培提供依据.
1实验材料及种植
实验材料来源于怀化学院生物园栽培种,经鉴定为虎耳草(Saxifraga stolonifera Curt.).2014年3月进行盆栽实验,盆上口径22 cm,底直径15 cm,高20 cm,选用育苗基质土,晒干去杂,过40目筛后均匀放入盆内,选4-5叶健康的虎耳草盆栽,每盆3株.浇透清水后,置于怀化学院生物园玻璃房内,据前期实验结果拉一层荫网(透光率50%)[8],注意通风保持室内温湿度与室外一致.进行不同干旱天数的处理,每个处理重复5次.
2方法
2.1土壤体积含水量测定
干旱处理0 d、14 d、28 d及42 d后用TDR土壤水分速测仪测定每盆的土壤体积含水量.
2.2虎耳草气体交换值测定
用Li-6400-2B(美国LI-COR公司生产)于上午9:00至11:00进测定叶片净光合速率(Pn)、蒸腾速率(Tr)、胞间二氧化碳浓度(Ci)及气孔导度(Gs),仪器自带红蓝光源,光强设为800 μmol·m-2·s-1,每个处理选发育完全的健康叶10片.
2.3虎耳草叶片叶绿素荧光参数测定

2.4没食子酸及岩白菜素含量测定
收集不同干旱处理的虎耳草全草洗净,杀青、烘干至恒重,粉碎后过100目筛.称取虎耳草粉末1.0 g,置于50 mL锥形瓶中,加入甲醇,料液比为1∶25(g∶mL),超声波提取35 min,重复提取一次.合并两次超声提取液,过滤后用旋转蒸发仪浓缩,甲醇定容至25 mL,溶液经0.22 μm针孔滤膜过滤.用LC-20AT高效液相色谱仪(日本岛津)进行成分含量测定,色谱柱为Agilent Eclipse XDB-C18(150 mm×4.6 mm,5μm);流动相:甲醇-0.1%磷酸溶液(73∶29),流速:1.02 ml/min,检测波长:272 nm,柱温25 ℃,进样量:20 μL.通过峰面积积分值计算岩白菜素和没食子酸的含量.
3结果与分析
3.1土壤体积含水量
干旱处理0 d时,虎耳草的盆内浇透水,盆栽土壤最大体积含水量为32.2%(图1).随干旱时间的增加,体积含水量逐步减少,处理14 d的体积含水量为22.6%,占土壤最大持水量的70.2%,处理42 d时,盆内土壤的体积含水量仅5.8%,为土壤最大持水量的18.0%.
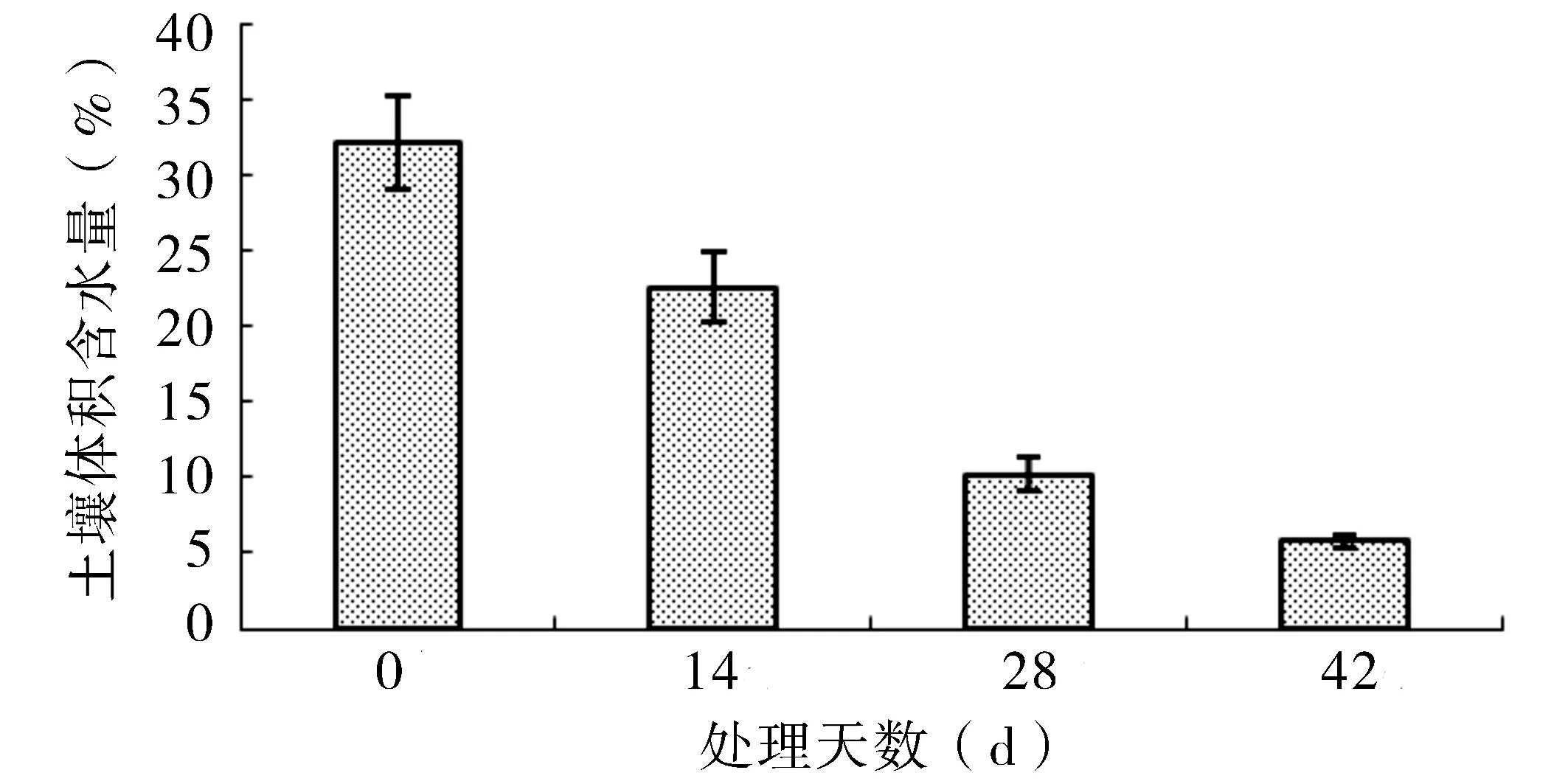
图1 不同干旱处理盆内土壤体积含水量变化
3.2气体交换参数
干旱可导致虎耳草叶片净光合速率的显著降低,其中处理14 d的降幅最大,净光合速率仅为处理前的30%,但此时气孔导度却有所上升,导致蒸腾速率也在此时最高,达4.08 mmol·m-2·s-1(图2).处理28 d时,虎耳草净光合速率、蒸腾速率及气孔导度持续下降,至处理42 d时,蒸腾速率及气孔导度值仅为处理前的10%,此时净光合速率已为负值.胞间二氧化碳浓度随干旱加剧而上升,说明干旱对虎耳草叶片的内部酶活系统造成不良影响.

图2 不同干旱处理虎耳草叶片气体交换特性变化
3.3叶绿素荧光参数变化
叶绿素荧光参数Fv/Fm为PSⅡ最大光化学效率,在非逆境生长条件下一般为0.75~0.85[14],从表1可知,干旱加剧导致虎耳草叶片Fv/Fm值持续下降,但处理28 d时仍未有显著差异,说明此时虎耳草PSⅡ反应中心原初光能转换效率仍保持较高水平.Fv/Fo随干旱加剧显著降低,表明干旱处理虎耳草可显著降低Cha/b蛋白复合体LHCP到PSⅡ的光能传递能力[15].qP和qN两个参数反映叶片对激发能的利用情况,qP越大表明PSⅡ的电子传递活性越大,qN代表用于非光化学反应如热耗散等的程度,与叶绿体光合膜质子梯度的建立及膜的高能态有关[16],干旱可显著降低虎耳草qP值及升高qN值.干旱同样导致PSⅡ的ΦPSⅡ及电子传递速率(ETR)的降低,但干旱14 d时降低未达显著水平.
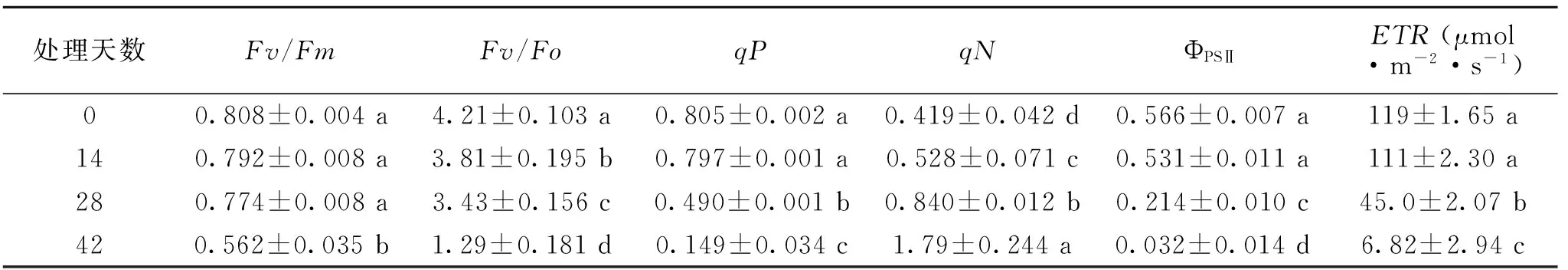
表1 不同干旱处理虎耳草叶绿素荧光参数比较(n=10)
注:同列小写字母表示0.05差异显著.
3.4有效成分含量比较
干旱可引起虎耳草生物产量的显著减少,干旱处理42 d后,干重仅10.7 g·pot-1,为未处理的55.7%(表2).虎耳草中的有效成分含量则在适当干旱时有所上升,其中处理14 d时,没食子酸含量显著最高,为2.11 mg·g-1,此时没食子酸的生物量也显著最高;岩白菜素含量则在干旱28 d时显著最高,但因虎耳草生物产量的减少显著,岩白菜素生物量在干旱处理14 d时最高.

表2 不同干旱处理虎耳草的没食子酸及岩白菜素含量比较(n=3)
注:同列小写字母表示0.05差异显著.
4讨论
干旱对植物光合速率的影响表现多样,有研究表明,轻度干旱下植物能调节光合结构功能[17],提高电子传递速率和光化学效率,使光合速率得以升高[18],重度干旱时光合系统受到不同程度破坏,光合速率下降显著[19,20].本文研究表明,干旱处理使虎耳草净光合速率持续下降,叶绿素荧光参数Fv/Fm、qP、ΦPSⅡ及ETR也不同程度的降低,这应该是实验处理的时间较长导致.虎耳草叶片蒸腾速率在干旱处理14 d时出现上升,同时伴随气孔导度的升高,说明此时蒸腾速率的升高由于气孔导度增大所致,与此同时净光合速率却在下降,胞间二氧化碳浓度的少许升高,表明该阶段虎耳草的光合酶系统已受到轻度影响;Fv/Fm、qP、ΦPSⅡ及ETR的降低未达显著水平,说明PSⅡ仍能通过自生的调节,维持较高的光化学效率.由此可知,虎耳草在遭受干旱逆境时,可通过主动调节气孔导度、光合系统功能以维持较高的光合作用.
次生代谢产物是植物长期进化过程中对生态环境适应的结果,植物在逆境情况下,会产生并积累大量次生代谢产物,以增强自身抵抗力[21].干旱是植物常要面对的逆境之一,植物体内次生化合物的浓度与干旱的程度及发生时间的长短息息相关,植物在适度干旱条件下,生长受到限制,此时大量光合产物积累在体内,植物可利用这些光合产物合成更多的含碳次生化合物[22].已有研究表明,干旱对药材品质甚至道地药材的形成有很大影响[23,24].虎耳草在干旱处理后,生物产量下降显著,但轻中度干旱可引起没食子酸及岩白菜素含量的显著升高.虎耳草是一种比较耐旱的常绿岩生植物,本文实验对虎耳草进行长达14 d干旱处理时仍能保持较高的光合作用,且此时没食子酸、岩白菜素生物量最高,因此,为保证药材的高产高效,人工种植虎耳草应适当控制水分供给.
参考文献:
[1]刘慧民,车艳双,车代弟,等.干旱胁迫对华北绣线菊和金山绣线菊光合能力的影响[J].应用生态学报,2010(8):2004-2009.
[2]Barathi P,Sundar D,Reddy AR.Changes in mulberry leaf metabolism in response to water stress[J].Biologia Plantarum,2001(44):83-87.
[3]赵丽丽,王普昶,陈超,等.干旱胁迫对百脉根叶绿素荧光特性的影响[J].中国草地学报,2014(1):18-23.
[4]梁娟,郭泽宇,叶漪.不同土壤水分条件对七叶一枝花光合特性及有效成分皂苷含量的影响[J].植物生理学报,2014(1):56-60.
[5]覃容贵,龙庆德,范菊娣,等.炮制对虎耳草中岩白菜素及其止咳抗炎作用的影响[J].中成药,2013(5):1027-1030.
[6]Chen Z,Liu Y M,Yang S.Studies on the chemical constituents and anticancer activity of Saxifraga stolonifera(L.)Meeb[J].Bioorganic &Medicinal Chemistry,2008(16):1337-1344.
[7]丁家欣,张秋海,张玲,等.HPLC法测定不同产地与采收期虎耳草中岩白菜素的含量[J].中国中药杂志,2002(10):792-793.
[8]贺安娜,林文强,姚奕.遮荫对虎耳草光合生理的影响[J].植物研究,2012(6):657-661.
[9]贺安娜,林文强,姚奕,等.不同温度处理对虎耳草叶片气体交换及叶肉结构的影响[J].植物研究,2012(4):410-414.
[10]贺安娜,欧立军,李胜华,等.虎耳草不同光温条件下光合特性及有效成分含量的相关性分析[J].植物研究,2013(5):587-592.
[11]周欣,陈华国,黄志金,等.虎耳草抗前列腺癌生物活性部位筛选研究[J].中国药理学通报,2013(6):867-870.
[12]周欣,陈华国,黄志金,等.响应面法优选虎耳草抗前列腺癌活性部位提取工艺[J].中草药,2013(13):1768-1773.
[13]周美,陈华国,先春,等.虎耳草乙酸乙酯部位高效液相色谱指纹图谱研究[J].中国中药杂志,2013(7):1026-1029.
[14]何炎红,郭连生,田有亮.白刺叶不同水分状况下光合速率及其叶绿素荧光特性的研究[J].西北植物学报,2005(11):2226-2233.
[15]苏行,胡迪琴,林植芳,等.广州市大气污染对两种绿化植物叶绿素荧光特性的影响[J].植物生态学报,2002(5):599-604.
[16]Bader M R,Ruuska S,Nakano H.Electron flow to oxygen in higher plants and algae:rates and control of direct photoreduction(Mehler reaction)and rubisco oxygenase[J].Biological Sciences,2000(2):1433-1445.
[17]Sofo A,Dichio B,Montanaro G,et al.Photosynthetic performance and light response two olive cultivars under different water and light regimes[J].Photosynthetica,2009(4):602-608.
[18]Montanaro G,Dichio B,Xiloyannis C.Shade mitigates photoinhibiton and enhance water use efficiency in kiwifruit under drought[J].Photosynthetica,2009(3):363-371.
[19]张香凝,孙向阳,王保平,等.土壤水分胁迫对拉瑞尔小枝水分参数影响的初步研究[J].生态学报,2014(8):1984-1993.
[20]罗海婧,张永清,石艳华,等.不同红小豆品种幼苗对干旱胁迫的生理响应[J].植物科学学报,2014(5):493-501.
[21]Zobayed SMA,Afreen F,Kozai T.Phytochenmical and physiololical changes in the leaves of St.John’s wortplants under a water stress condition[J].Environ.Exp.Bot.,2007(59):109-116.
[22]Lorio PL.Growth-differentiation balance:A basis for understanding southern pine beetle-tree interactions[J].For.Ecol.Anage.,1986(14):259-273.
[23]黄璐琦,郭兰萍.环境胁迫下次生代谢产物的积累及道地药材的形成[J].中国中药杂志,2007(4):277-280.
[24]李霞,王洋,阎秀峰.水分胁迫对黄檗幼苗三种生物碱含量的影响[J].生态学报,2007(1):58-64.
Effects of Drought Stress on Photosynthetic Characteristics and Contents of Active Ingredients of Saxifraga Stolonifera Curt.
HE An-na1,2,3,ZUO Lang-zhu1,LI Sheng-hua1,2,3,LINAG Juan1,2,3
(1.CollegeofBiologicalandFoodEngineering;2.KeyLaboratoryofResearchandUtilizationofEthnomedicinalPlantResourcesofHunanProvince;3.KeyLaboratoryofXiangxiMedicinalPlantandEthnobotanyofHunanHigherEducation,HuaihuaUniversity,Huaihua,Hunan418008)
Abstract:In order to explore the artificial cultivation of water conditions ofS.StoloniferaCurt.,in this paper,photosynthesis of pottedS.StoloniferaCurt.was measured by LI-6400 portable under different drought conditions,and gallic acid and bergenin contents were determined by using LC-20AT HPLC.The results showed that,content of volumetric soil water significantly decreased with the increase number of drought days,the content of volumetric water was only 5.8% after 42 days treatment.Net photosynthetic rate decreased significantly with drought increased.Transpiration rate increased in drought 14 days time,up to 4.08 mmol·m-2s-1,when the stomatal conductance also increased.Chlorophyll fluorescence parameters showed that,openness of Photosystem Ⅱ Reaction Center,photochemical efficiency,the electron transfer rate reduced with increased days of drought,and decreased the most significant for 28 days.Drought could significantly reduce the biological yield ofS.StoloniferaCurt..The dry weight was only 10.7 g·pot-1when treated for 42 d.While moderate drought could increase the active ingredient content,14d’s drought treatment had the highest contents of gallic acid and bergenin,which were 2.11 mg·g-1and 4.13 mg·g-1,respectively.Conclusion:S.StoloniferaCurt.was resistant to drought,photosynthesis maintained high level when drought 14 days to ensure biomass accumulation,and significantly increased the active ingredient content.So water given can be appropriately controlled when plantS.StoloniferaCurt.
Key words:Saxifragastoloniferacurt.;drought;photosynthetic characteristics;active ingredients
收稿日期:2016-01-08
基金项目:植物学湖南省重点建设学科.
作者简介:贺安娜,1981年生,女,湖南邵阳人,副教授,研究方向:药用植物发育生物学.
中图分类号:Q945
文献标识码:A
文章编号:1671-9743(2016)05-0006-04

