金属铜在含氯离子溶液中腐蚀—抗腐蚀性能比较
侯东辉


摘 要 采用极化曲线、循环伏安曲线和电化学阻抗谱电化学方法,对金属铜在含氯离子溶液的电化学腐蚀行为进行了研究。结果表明:随着氯离子浓度增大,金属铜腐蚀电位正向移动,腐蚀速率增大。当氯离子浓度到达一定程度,腐蚀电位向相反方向移动。
关键词 铜 氯离子浓度 腐蚀速率
中图分类号:TG174 文献标识码:A
0引言
铜在电子、通讯和电工行业是不可或缺的重要金属材料之一。根据美国等世界发达国家的统计,由于腐蚀而造成的损失,占国民收入GDP的2.5%到4%,我国在70年代后陆续对许多行业进行了统计调查,其中腐蚀造成的损失数字比例大致在3%到4%。应用实践表明在各种腐蚀介质中,使用缓蚀剂抑制铜及其合金的腐蚀是经济有效的方法。
1实验方法
实验材料:纯铜。
腐蚀介质:配置0.1M.L-2的NaNO3溶液。配置0.004 mol.L-1NaCl、0.008 mol.L-1NaCl、0.012 mol.L-1NaCl、0.016mol.L-1NaCl、0.020mol.L-1NaCl。
电极体系:参比电极为饱和甘汞电极,辅助电极为铂电极,工作电极为铜。
实验前试样工作面用水砂纸逐级打磨至平整,用金刚石研磨膏进行抛光。经丙酮除油,蒸馏水冲洗,冷风吹干。
测量铜在0.1M NaNO3溶液的阳极极化曲线、塔菲尔曲线、阻抗曲线。
恒电位法,电化学工作站(如图2)。
(1)将铜电极用砂纸磨至镜面光亮,用蒸馏水冲洗,在冷风下吹干。
(2)洗净电极池,注入待测溶液NaNO3溶液,然后将研究电极:铜,辅助电极:铂电极,参比电极:饱和甘汞电极,盐桥装入电池内,摇匀溶液,连接好电线,稳定15分钟。
(3)打开工作站,找到线性扫描曲线,调节恒电位仪,设定好参数,使初始电位在-0.4V,终止电位在-1.4V,控制电位扫描速度为0.5 mv.s-1。点击开始,将测得的数据保存,作图保存。
(4)按上述步骤重复操作,分别使用工作站作出塔菲尔曲线,交流阻抗图像。
2结果与讨论
2.1 极化曲线
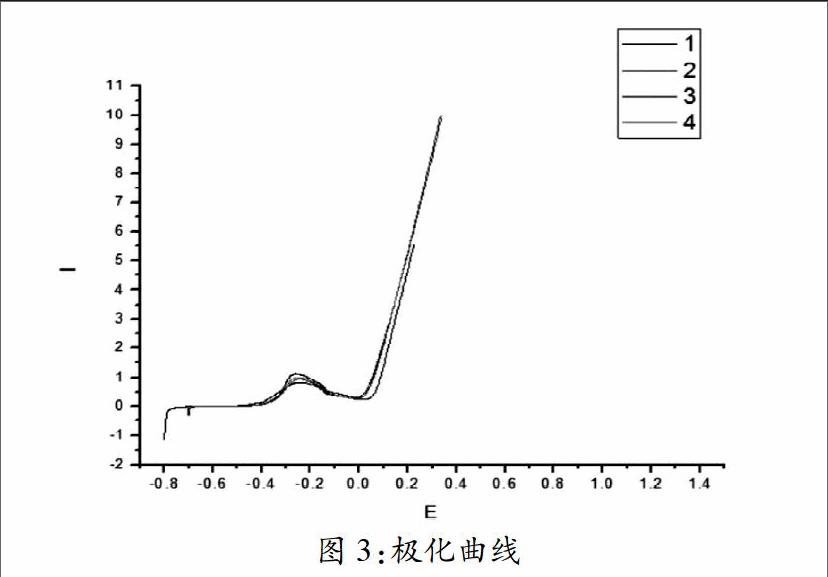
通过对比图3中1与其他三条曲线,可以明显看出NaCl溶液对金属铜的腐蚀产生影响。图3是铜在不同浓度的NaCl溶液的极化曲线,可以看出不同浓度的NaCl溶液对金属铜的腐蚀不同,随着浓度的增大,腐蚀电位正移,说明氯离子的存在对金属铜的腐蚀程度越强。由于溶液中氯离子浓度的升高引起金属铜的阳极溶解速度增加,从而使金属铜的腐蚀速度增大,当溶液中氯化钠含量大于0.08mol/L之后,由于金属铜最初腐蚀速度很大,很快出现了腐蚀产物增加了金属铜的阳极极化,再加上由于溶液中溶解氧的减少所引起的阴极去极化作用降低等原因,金属铜的腐蚀速度反而有所下降。
2.2金属铜在不同浓度的NaCl溶液中的塔菲尔曲线
根据图4可以看出NaCl溶液对金属铜的腐蚀产生影响,影响金属铜的自腐蚀电流与自腐蚀电位。随着NaCl溶液浓度的增大,自腐蚀电流逐渐增大,自腐蚀电位也在逐渐增大。NaCl溶液对金属铜的腐蚀逐渐增强。
(1)通过金属铜极化曲线的测定,证实了氯离子促进金属铜的阳极溶解过程。
(2)氯离子浓度对氧在金属铜上的阴极还原影响不大,但由于金属铜在氯化钠溶液中形成CuCl或 CuCl2- 等络合物,氯离子浓度改变影响铜离子的阴极还原。
(3)按照下式可解释金属铜在含氯离子溶液中腐蚀行为的变化规律。
3结论
采用恒电位实验方法研究铜在不同浓度NaCl溶液及在不同浓度的硝酸钠缓蚀剂溶液中的腐蚀行为,分别获得了铜在不同氯离子浓度和添加不同浓度硝酸钠缓蚀剂下的极化曲线。结果表明,随着Cl-浓度的增大,腐蚀电位先正移后负移,自腐蚀电流先增大后减小,可以得出铜的腐蚀速率随氯离子浓度增大先增大后减小。
参考文献
[1] 刘金义,张宝根.铜及其合金表面的腐蚀与保护[J].电子工艺术,2010(002):116-120.
[2] 杨敏,王振尧.铜的大气腐蚀研究[J].装备环境工程,2006,3(4):38-44.

