多重连接探针扩增技术对1个假肥大型中国汉族肌营养不良症家系的遗传学研究*
杨佳良,罗怀超,2,马 誓,郝 芳,朱世凯,周 玉△
(1.电子科技大学附属四川省人民医院检验科,成都 610072;2.泸州医学院临床检验系,四川泸州 646000;3.电子科技大学附属四川省人民医院器官移植中心,成都 610072)
·论著·
多重连接探针扩增技术对1个假肥大型中国汉族肌营养不良症家系的遗传学研究*
杨佳良1,罗怀超1,2,马誓1,郝芳1,朱世凯3,周玉1△
(1.电子科技大学附属四川省人民医院检验科,成都 610072;2.泸州医学院临床检验系,四川泸州 646000;3.电子科技大学附属四川省人民医院器官移植中心,成都 610072)
目的拟通过多重连接探针扩增技术(MLPA)对1个假肥大型进行性肌营养不良(DMD)家系进行检测以明确DMD的诊断,结合患者临床表现进行分析并对MLPA技术用于DMD临床诊断进行探讨。方法收集1个DMD患者家系,该家系共12人,男性患者2例。分离外周血并提取DNA,用MLPA的方法对其进行基因诊断。结果先证者符合DMD诊断。基因检测提示先证者和其弟弟携带抗肌萎缩蛋白基因缺失突变DMD(Exon3-11)。先证者母亲为致病基因携带者。结论通过MLPA检查技术明确了一个中国汉族DMD家系的致病基因,MLPA技术能够用于DMD疾病的诊断。
假肥大型肌营养不良;家系;基因分析;多重连接探针扩增技术;抗肌萎缩蛋白基因
假肥大型进行性肌营养不良(DMD)为X-连锁隐性遗传性疾病,男性多发,女性多为致病基因的携带者。阳性患者的特点为进行性对称性肌无力,Gower征阳性,腓肠肌假性肥大。一般5岁前发病,6岁后出现行走困难,13岁丧失行走能力而依靠轮椅生活,20岁左右因心力衰竭而死亡。根据目前的研究,DMD发病多与遗传因素有关。多重连接探针扩增技术(MLPA)于2002年由Schouten等首先报道,是近几年发展起来的一种针对DNA序列进行定性和半定量分析的新技术。该技术高效、特异,在一次反应中可以检测45个核苷酸序列拷贝数的改变,目前已经应用于多个领域、多种疾病的研究。近年来报道DMD是位于X染色体短臂Xp21的抗肌萎缩蛋白基因(又称dystrophin基因、DMD基因)突变所致。目前,在众多确定与肌营养不良发生有关的致病基因中,抗肌萎缩蛋白基因备受关注。它是目前已知的人类最长的基因,包括79个外显子。根据国外报道,其主要突变类型为基因部分缺失,占全部突变类型的60%~65%[1-3]。本研究对一个DMD家系采用多重连接基因探针扩增技术进行基因诊断和临床研究,现报道如下。
1资料与方法
1.1一般资料2015年四川省人民医院临床初诊为DMD的先证者和此家系其他成员,共3代12人。
1.2方法
1.2.1标本采集在征得先证者及家属知情同意后,采集5%乙二胺四乙酸(EDTA)抗凝静脉血,-80 ℃保存,用试剂盒提取DNA,-20 ℃保存待用。选择健康男性对照,健康女性对照,且对照均无心脏病、肌无力、肌萎缩和血清肌酶升高,无遗传病家族史。家庭成员需签署知情同意书。
1.2.2检测方法(1)对所有研究对象进行外周血DNA的提取。(2)MLPA的方法对先证者及家系成员进行基因突变的研究和分析。MLPA即探针与靶序列DNA杂交,之后通过连接,PCR扩增,产物通过毛细管电泳及数据收集进行分析最后得出结论。通过每个探针的相对峰值比(RPR)来判断标本DMD目的片段的拷贝数。正常:0.7
1.3治疗与随访对通过基因诊断确诊的患者进行适当的治疗和随访。
1.4统计学处理Coffalyser9.4软件进行数据处理及统计分析。
2结果
2.1患者及家系该家系来自四川省,家系图见图1,该家系中共有12人(不含先证者)。先证者的弟弟1993年2月出生,也出现双下肢无力,双侧腓肠肌代偿性肥大,于当地医院诊断为DMD。另外先证者的妹妹2004年出生,未出现DMD的临床表现。DMD的病因和发病机制复杂多变,结合该家系的特点,可归纳如下:(1)多在男性身上发病,且多在5岁前发病;(2)首发症状通常会表现为行走慢、足尖着地、登梯困难、不能正常跑步,容易跌倒;肌无力自躯干和四肢近端开始缓慢进展,下肢重于上肢;步态呈鸭步;攀登起立征(Gower征)阳性,为本病特征性表现;(3)随着病情的进一步发展,近端肌肉有所萎缩,腓肠肌代偿性肥大;(4)晚期患者的四肢、躯干、肩部肌肉均见明显萎缩,最后因呼吸肌萎缩而出现呼吸困难、咳嗽无力,心律失常等,多在25~30岁以前死于呼吸道感染、心力衰竭或消耗性疾病。(5)辅助检查:实验室检查较特征性的改变为显著升高的血清肌酸激酶(CK)水平,患儿出生后其CK水平即可显著升高,随年龄的增长而逐渐上升,最高可达正常上限的100倍以上,到疾病中后期,因大部分肌纤维已被破坏,CK水平则逐渐下降。
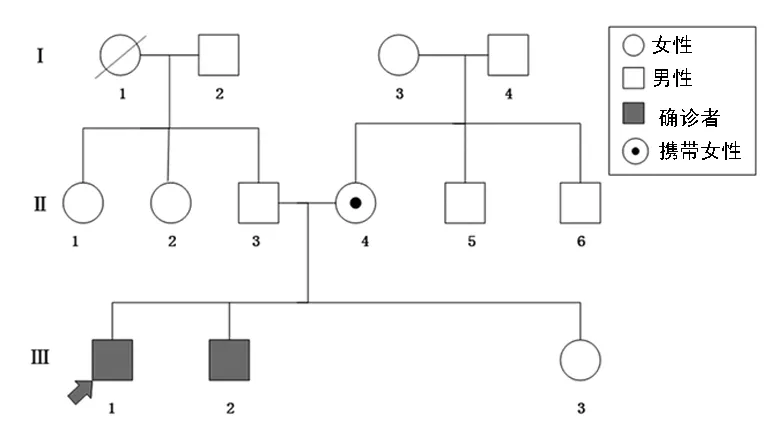
注:箭头所示为先证者。
图1家系图
2.2临床资料先证者,男,24岁,因“呼吸困难,双下肢乏力”入院,血压135/64 mm Hg,脉搏121次/分,呼吸18次/分,平车推入病房,呼叫睁眼,不发音,四肢迟缓。头颅五官无畸形,全身皮肤黏膜无黄染,浅表淋巴结无肿大,巩膜无黄染,双侧瞳孔等大等圆,对光反射灵敏。颈软,无抵抗,颈静脉无充盈怒张,已行气管切开术,人工气道通畅,甲状腺未扪及肿大,胸廓漏斗状,听诊双肺呼吸音清晰,未闻及湿啰音及哮鸣音。心界不大,心率121次/分,律齐,各瓣膜区听诊未闻及病理性杂音,全腹平软,无压痛,无肌紧张及反跳痛,肝脾肋下未触及,未触及包块,肝颈静脉回流征(-),移动性浊音(-),膀胱叩诊(-),肠鸣音无增强及减弱。已行导尿术,尿管在位、通畅,双下肢无水肿。四肢肌力0级,生理反射及病理反射均未引出。先证者经心肺复苏后,因缺血缺氧性脑病于2015年5月25日死亡,死亡年龄24岁。
2.3DNA序列分析先证者Ⅲ-1和家系成员Ⅲ-2、Ⅱ-4均携带抗肌萎缩蛋白基因缺失突变DMD(Exon3-11),见图2(见《国际检验医学杂志》网站主页“论文附件”)。从图中可以看出携带该基因缺失突变的男性外显子DMD(3-11)全部缺失,其母亲因为有两条X染色体而表现出约50%的缺失。每个探针的RPR见表3,所有患者在外显子3-11的RPR都为0,表明这些区域完全缺失并表现出DMD的典型临床症状。其母亲为携带者,RPR在0.5左右,并不表现出DMD的典型临床表现。其他成员及正常男性和女性RPR在0.7~1.3为正常,未检出携带此突变。
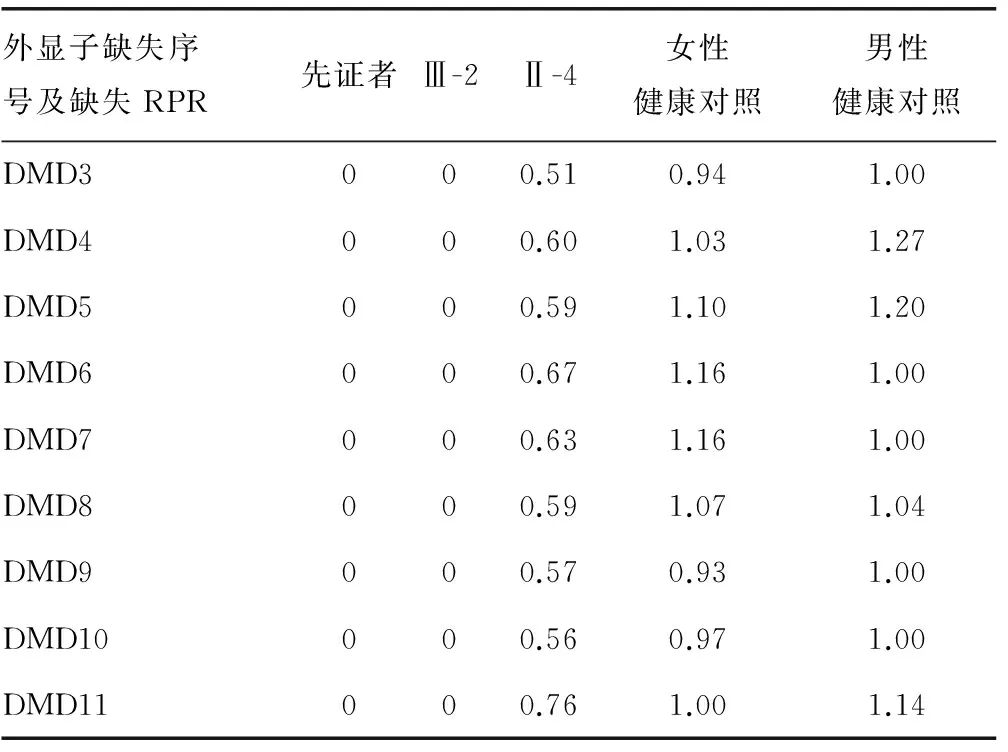
表3 MLPA探针的RPR
注:MLPA显示家系中先证者Ⅲ-1,以及家系成员Ⅲ-2、Ⅱ-4均携带抗肌萎缩蛋白基因缺失突变DMD外显子(3~11),其他家系成员及健康男女对照均未发现此突变。
3讨论
DMD是最常见的一类X连锁隐性遗传病,以进行性肌营养不良症为主要临床表现。主要是男性发病,女性为致病基因的携带者。本病的发生是由于编码抗肌萎缩蛋白基因的突变所引起,该基因位于X染色体p21上,是人体最大的基因,长达2.3 Mb,含79个外显子,79 个内含子,编码约14×103的RNA,翻译产物为抗肌萎缩蛋白,它于肌细胞膜脂质中,对稳定细胞膜、防止细胞坏死自溶起重要作用。定量分析表示,DMD患者肌细胞内抗肌萎缩蛋白近乎完全缺失,故该病通常5岁左右发病,肌进行性萎缩,预后差。没有切实有效的临床治疗方法。有约1/3病例为散发,没有家族史,是由基因新突变造成。
本研究通过MLPA的方法对1例DMD家系进行抗肌萎缩蛋白基因的全外显子检测,发现其母为DMD外显子3~11缺失突变携带者,其所生两个儿子也都为DMD外显子(3~11)基因缺失,并有典型的DMD临床表现,在本医院通过基因分析和一系列临床检查确诊为DMD患者。其女并未检出基因突变,也没有DMD的典型临床症状及实验检查结果。
张晓[4]提出本病无明显种族和地域的差异。但杜青[5]则通过单链构象多态性分析(SSCP)筛查确诊患者第48号外显子存在明显的异常,而提出中国人种DMD疾病的基因突变位点可能和外国人种存在着区别。而本研究通过MLPA的方法对DMD家系进行抗肌萎缩蛋白基因的全外显子研究,发现其母为DMD外显子3~11缺失突变携带者,其所生两个儿子也为DMD外显子(3~11)基因缺失,并有典型的DMD临床表现,在本医院通过基因分析和一系列临床检查确诊为DMD患者,且先证者因心肺复苏术后,缺血缺氧性脑病于2015年5月25日死亡,死亡年龄24岁。先证者妹妹并未检出基因突变,也没有DMD的典型临床及实验检查的表现,也没有发现48号外显子的突变。正如目前已知的抗肌萎缩蛋白基因突变类型中最为常见的为缺失,存在2个缺失热区。一个位于中央区域,多包括45~55号外显子,另一个缺失热区位于基因的5′端,多包括2~20号外显子[6-7]。而本研究显示3~11号外显子丢失,符合上诉者的5′端的缺失热点区。上述两个缺失热区中的外显子缺失约占全部缺失突变的98%。有研究显示于1~20号外显子,21~40号外显子,41~60号外显子,61~79号外显子上的点突变率分别为30.4%、30.4%、24.6%及14.5%[8]。所以,DMD发病的表现形式及基因突变的位置因人而异,在检测DMD时只检测热点区域,或只查其中的一种突变是不够的。
目前检测DMD的方法主要有Southern印迹杂交、DMD基因多重PCR、短串联重复序列PCR及反转录PCR。Chamberlain等[9]设计了9对引物(针对外显子4、8、12、17、19、44、45、48、51)的PCR;Beggs等[10]增设了另外9对引物(针对外显子3、6、13、43、47、50、52、60、49),这18对引物可检出大部分的DMD基因缺失患者。但这种方法不能检测DMD基因缺失型和重复型杂合子携带者。而MLPA技术可以全面地检测抗肌萎缩蛋白基因79个外显子的全部缺失和重复突变。该方法灵敏、特异,广泛用于DMD患者和携带者的检测[11-13]。但MLPA也有其自身的缺点,即邻近探针连接位点的微小突变或多态会影响探针杂交及连接,导致扩增失败;MLPA也无法检测出X染色体的平衡易位及抗肌萎缩蛋白基因内的微小突变[14]。因此对于单个外显子缺失的情况,要用PCR和测序对其进行验证。但对于DMD的诊断还应结合临床表现、病理肌电、实验室检查等综合地来诊断该病。由于该病尚无更好的治疗方法,所以切实有效的产前诊断和遗传咨询显得尤为必要。
该家系中其母亲为致病基因的携带者,而其所生两个儿子均患DMD,且临床表现非常典型:进行性对称性肌无力和腓肠肌代偿性肿大。肌电图、肌肉病理及实验室的检查都符合DMD的诊断,与MLPA所得结果是一致的。且先证者的妹妹用MLPA的方法没有检测到基因突变,其也没有DMD的临床表现,这更好地说明了MLPA是一种可以用于临床DMD诊断和产前筛查的简单、灵敏、特异的方法。正如上面所说MLPA也有其自身局限性。所以期待更多的家系报道,基因位点和突变类型的报导及基因相关功能的研究,更多的诊断及治疗方法被发现,为DMD的预防、诊断和治疗开拓新篇章。
[1]Muntoni F,Torelli S,Ferlini A.Dystrophin and mutations:one gene,several proteins,multiple phenotypes[J].Lancet Neurol,2003,2(12):731-740.
[2]Prior TW,Bridgeman SJ.Experience and strategy for the molecular testing of Duchenne muscular dystrophy[J].J Mol Diagn,2005,7(3):317-326.
[3]Hu XY,Ray PN,Murphy EG,et al.Duplicational mutation at the Duchenne muscular dystrophy locus:its frequency,distribution,origin,and henotypegenotype correlation[J].Am J Hum Genet,1990,46(4):682-695.
[4]张晓.假肥大型肌营养不良症7例临床特征分析[J].中国社区医师(医学专业),2011,13(278):133.
[5]杜青.一个中国家系假肥大型肌营养不良相关基因dystrophin的突变位点的检测[D].武汉:华中科技大学,2013.
[6]Lai PS,Takeshima Y,Adachi K,et al.Comparative study on deletions of the dystrophin gene in three Asian populations[J].J Hum Genet,2002,47(10):552-555.
[7]Danieli GA,Mioni F,Müller CR,et al.Patterns of deletions of the dystrophin gene in different European populations[J].Hum Genet,1993,91(4):342-346.
[8]Takeshima Y,Yagi M,Okizuka Y,et al.Mutation spectrum of the dystrophin gene in 442 Duchenne/Becker muscular dystrophy cases from one Japanese referral center[J].J Hum Genet,2010,55(6):379-388.
[9]Chamberlain JS,Gibbs RA,Ranier JE,et al.Deletion screening of the Duchenne muscular dystrophy locus via multiplex DNA amplification[J].Nucleic Acids Res,1988,16(1):11141-11156.
[10]Beggs AH,Koenig M,Boyce FM,et al.Detection of 98%of DMD/BMD gene deletions by polymerase chain reaction[J].Hum Genet,1990,86(1):45-48.
[11]Gatta V,Scarciolla O,Gaspari AR,et al.Identification of deletions and duplications of the DMD gene in affected males and carrier females by multiple ligation probe amplification(MI,PA)[J].Hum Genet,2005,117(1):92-98.
[12]Li H,Ding J,Wang W,et al.Combining approach with muhiplex PCR and MLPA to detect deletion and duplication in DMD patients,carriers,and prenatal diagnosis[J].Chin J Med Genet,2009,26(3):318-322.
[13]Marzese DM.Mampel A.Gomez IC,et al.Detection of deletions and duplications in the Duchenne muscular dystrophygene by the molecular method MLPA in the first Argentine affected families[J].Genet Mol Res,2008,84(3):223-233.
[14]Kozlowski P,Jasinjiyiska AJ,Kwiatkowski DJ.New applications and developments in the use of multiplex ligation-dependentprobe amplification[J].E1ectrophoresis,2008,29(23):4627-4636.
Genetic study of Duchenne Muscular Dystrophy in a Chinese family by Multiplex ligationdependent probe amplification technique*
YANGJialiang1,LUOHuaichao1,2,MAShi1,HAOFang1,ZHUShikai3,ZHOUYu1△
(1.DepartmentofClinicalLaboratory,SichuanProvincialPeople′sHospitalAffiliatedtoUniversityofElectronicScienceandTechnology,Chengdu,Sichuan610072,China;2.InspectionDepartment,LuzhouMedicalCollege,Luzhou,Sichuan646000,China;3.OrganTransplantCenter,SichuanProvincialPeople′sHospitalAffiliatedtoUniversityofElectronicScienceandTechnology,Chengdu,Sichuan610072,China)
ObjectiveTo diagnosis for Duchenne Muscular Dystrophy(DMD)in a pedigree by multiplex ligation dependent probe amplification(MLPA),and to analyze on the basis of clinical manifestations,to explore the application value of MLPA technology in diagnosis for DMD.MethodsA pedigree of DMD patients were recruited in this study,12 person in this pedigree including 2 DMD patients.All the person in this pedigree were isolated peripheral blood and extracted DNA,conducted genetic diagnosis using MLPA.ResultsThe propositus was confirmed as a DMD patients.Genetic testing prompted the propositus and his brother carrying dystrophin gene deletion mutation DMD (Exon3-11).Propositus′s mother was pathogenic gene carrier.ConclusionThe disease gene is confirmed in in a pedigree with DMD by MLPA,and MLPA technique could be used to diagnose DMD disease.
Duchenne Muscular Dystrophy;pedigree;gene analysis;multiplex ligation dependent probe amplification;dystrophin gene

国家自然科学基金资助项目(81400437)。
杨家良,女,硕士研究生,主要从事遗传学研究。△
,Email:zhouyu422@yahoo.com。
10.3969/j.issn.1673-4130.2016.12.012
A
1673-4130(2016)12-1624-03
2016-01-11修回日期:2016-03-18)

