GSTM1、GSTT1基因多态性与白血病易感性的分析*
李 娟,朱俊芳,张 炜,马海珍
(兰州大学第一医院:1.中心实验室;2.血液科 730000)
·论著·
GSTM1、GSTT1基因多态性与白血病易感性的分析*
李娟1,朱俊芳1,张炜1,马海珍2△
(兰州大学第一医院:1.中心实验室;2.血液科730000)
目的分析GSTM1缺失基因型与白血病遗传易感性的关系。方法131例白血病患者纳入病例组,200例体检健康者纳入对照组。采用巢式PCR检测GSTM1、GSTT1基因型。应用χ2检验和精确概率法比较各基因型频率在病例组与对照组之间的差异,用比值比(OR)及其95%的可信区间(CI)表示各基因型发生白血病的风险度。结果病例组GSTM1缺失基因型频率与对照组比较,差异有统计学意义(P=0.000 1,其OR值为2.152,95%CI为2.301~5.985);在病例组与对照组中均未检测到GSTT1缺失基因型;CML、AML与ALL组间进行GSTM1缺失基因型频率比较,差异无统计学意义(P>0.05)。结论GSTM1缺失基因型可能是白血病的重要危险因素。
白血病;GSTM1;GSTT1;谷胱甘肽S-转移酶
白血病是一类起源于造血干细胞的恶性克隆性疾病,国内外研究表明,遗传因素、环境因素交互作用与白血病的发生及疾病的进展有关。代谢酶遗传多态性在对环境致癌物致突变过程中起着关键作用,日益受到学者们的关注。人体的Ⅱ相代谢酶谷胱甘肽 S-转移酶超家族 (GSTs)可催化异生物素的Ⅰ相代谢产物与谷胱甘肽(GSH)结合,使其毒性降低,且易于排出体外,在细胞代谢解毒过程中起着重要作用[1]。研究证实GSTM1、GSTT1基因多态性与肺癌、消化道肿瘤的易感性存在着一定的关系[2-5]。本研究就GSTM1、GSTT1基因多态性与白血病易感性的关系进行了探讨。
1资料与方法
1.1一般资料收集2010 年6月至2012年5月兰州大学第一医院住院初诊的131例白血病患者纳入病例组,其中男73例,女58例,男女比例为1.26∶1.00。其中慢性髓细胞白血病(CML)组患者32例,男22例,女10例,年龄20~69岁,中位年龄45岁,男女比例为2.2∶1.0;急性髓细胞白血病(AML)组患者70例,男34例,女36例,男女比例为0.94∶1.00;急性淋巴细胞白血病(ALL)组患者29例,男16例,女13例,男女比例为1.23∶1.00。另选择同期本院体检中心体检健康者200例纳入对照组,其中男134例,女66例,年龄17~81岁,中位年龄40岁。病例组与对照组性别差异无统计学意义(χ2=3.544,P=0.06),具有可比性。
1.2检测方法
1.2.1白血病诊断及疗效判断标准白血病诊断及诱导治疗后第一疗程的完全缓解(CR1),以《血液病诊断及疗效准》作为诊断和疗效判断标准。
1.2.2基因组DNA提取采集白血病患者乙二胺四乙酸二钠(EDTA-Na2)抗凝骨髓2 mL,用常规酚氯仿法提取骨髓细胞基因组DNA并测定DNA的水平和纯度,低温保存。
1.2.3GSTM1及GSTT1多态基因型的确定采用巢式PCR检测GSTM1和GSTT1基因的纯合缺失。引物序列参照文献[6],由上海生工生物工程技术服务有限公司合成。GSTM1基因上、下游引物序列为:F5′-GAA CTC CCT GAA AAG CTA AAG C-3′;R5′-GTT GGG CTC AAA TAT ACG GTG G-3′。GSTT1基因上、下游引物序列为:F5′-TTC CTT ACT GGT CCT CAC ATC TC-3′;R5′-TCA CCG GAT CAT GGC CAG CA-3′。该反应以-globin为阳性内对照,其上、下游引物序列为:F5′-CAA CTT CAT CCA CGT TCA CC-3′;R5′-GAA GAG CCA AGG ACA GGT AC-3′。PCR反应条件,94 ℃预变性4 min后进入热循环,94 ℃ 1 min,55 ℃ 45 s,72 ℃ 1 min,72 ℃ 10 min,共35个循环。GSTM1和GSTT1基因型结果分析:GSTM1 PCR产物为219 bp;GSTT1 PCR产物为480 bp;-globin PCR产物为268 bp。2%琼脂糖凝胶电泳进行结果判读GSTM1缺失基因型为268、480 bp;GSTT1缺失基因型为268、219 bp;GSTM1及GSTM1联合缺失基因型为268 bp。
1.3统计学处理采用SPSS16.0软件进行数据处理及统计学分析,计数资料以例数及百分率表示,采用χ2检验和精确概率法比较各基因型频率在病例组与对照组之间的差异,用比值比(OR)及其95%的置信区间(CI)表示各基因型发生白血病的风险度。以P<0.05为差异有统计学意义。
2结果
2.1病例组与对照组基因型分布比较对照组中200例健康者中115例(57.5%)为GSTM1未缺失基因型,85例(42.5%)为GSTM1缺失基因型;病例组中131例白血病患者35例(26.7%)为GSTM1未缺失基因型,96例(73.3%)为GSTM1缺失基因型,两组基因型频率分布差异有统计学意义(χ2=30.27,P=0.000 1),两组GSTM1基因型的分布频率见表1。
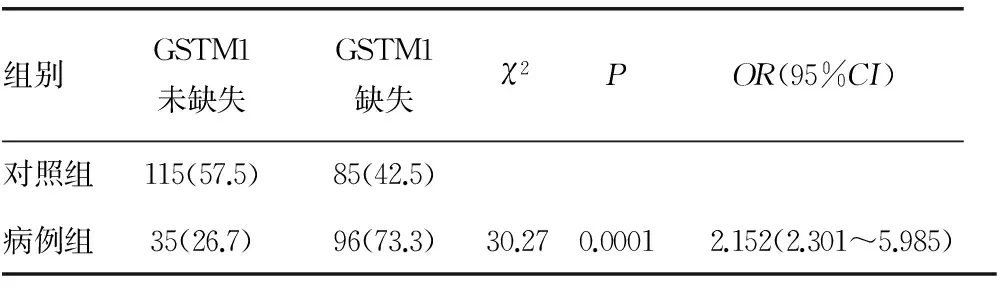
表1 病例组与对照组GSTM1位点基因型分布
2.2各组基因型分布比较70例AML患者20例(28.6%)为GSTM1未缺失基因型,50例(71.4%)为GSTM1缺失基因型,对照组与AML组基因型频率分布差异有统计学意义(χ2=20.962,P=0.000 1);29例ALL患者中6例(20.7%)为GSTM1未缺失基因型,23例(79.3%)为GSTM1缺失基因型,对照组与AML组基因型频率分布差异有统计学意义(χ2=13.771,P=0.000 2);32例CML患者中9例(28.1%)为GSTM1未缺失基因型,23例(71.9%)为GSTM1缺失基因型,对照组与AML组基因型频率差异有统计学意义(χ2=9.567,P=0.002 0)。CML、AML、ALL组与对照组中GSTM1基因型的分布频率见表2。
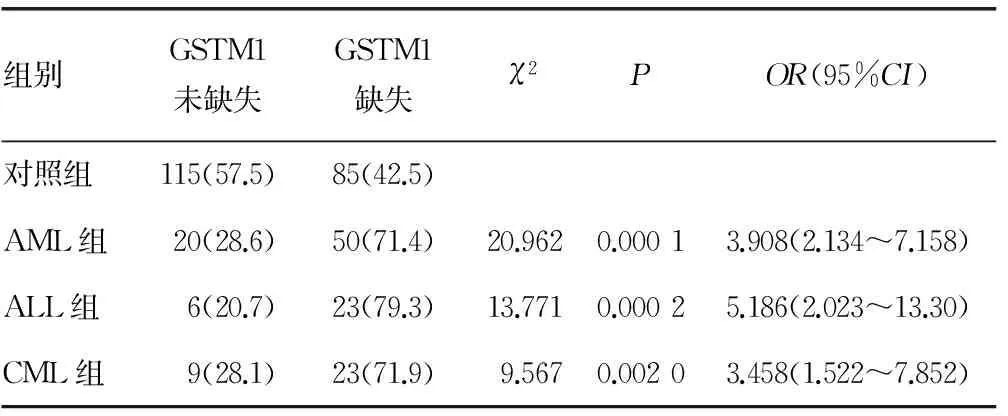
表2 各组GSTM位点多态基因型分布频率比较[n(%)]
2.33类白血病患者基因型分布比较CML组分别与AML、ALL组基因型频率分布比较,差异无统计学意义(χ2=0.002,P=0.963;χ2=0.454,P=0.500)。
3讨论
本研究结果显示,对照组中GSTM1缺失基因型频率为42.5%,与国内报道上海地区健康人群GSTM1的缺失率为49.1%相一致[7]。131例白血病病例中96例(73.3%)为GSTM1缺失基因型,病例组GSTM1缺失基因型明显高于对照组,差异有统计学意义(χ2=30.27,P=0.000 1,OR=2.152,95%CI:2.301~5.985),本研究结果也显示携带GSTM1缺失基因型的个体发生白血病的危险性比携带GSTM1未缺失基因型的个体增加2.152倍。对病例组进行了进一步的分层研究,结果显示AML、ALL、CML组分别与对照组比较差异均有统计学意义(P<0.05),OR值分别为3.908、5.186、3.458。表明GSTM1缺失基因型可能是白血病的重要危险因素。国内一项对苯引起的白血病研究结果发现,苯白血病患者中GSTM1缺失基因型的频率(73.53%)明显高于对照组(46.88%),且是苯白血病的易感因素之一(OR=3.15,95%CI:0.56~17.62)[8],与本研究结果相一致。本研究将CML组分别与AML、ALL组基因型频率分布比较,差异无统计学意义(P>0.05),表明GSTM1缺失基因型与白血病分型无相关性。本研究结果与袁慧等[9]报道的谷胱甘肽转硫酶基因与急性白血病易感性的Meta分析的结果相一致。
谷胱甘肽转硫酶是重要的Ⅱ相代谢酶,可结合各种亲电子化合物,包括环境致癌物及其中间产物,使其水溶性增加,起到解毒的作用。具有GSTM1缺失基因型的个体体内缺乏酶活性,对外来毒物的解毒功能降低,可能成为白血病的重要遗传学危险因素之一。由于本研究样本量较小,不能排除偏倚和混杂因素的影响,期望更多学者关注谷胱甘肽转硫酶基因与白血病发病风险的研究,通过大样本的验证,为白血病的防治提供科学依据。
[1]Zhang XM,Lin Je,Wu XF,et al.Association between GSTM1 copy number,promoter variants and susceptibility to urinary bladder cancer[J].Int J Mol Epidemiol Genet,2012,3(3):228-236.
[2]Yang HY,Yang SY,Liu J,et al.The association of GSTM1 deletion polymorphism with lung cancer risk in chinese population:evidence from an updated meta-analysis[J].Sci Rep,2015,5(1):9392.
[3]Wang YD,Yang HY,Wang HY.The association of GSTT1 deletion polymorphism with lung cancer risk among Chinese population:evidence based on a cumulative meta-analysis[J].Onco Targets Ther,2015,8(1):2875-2882.
[4]Bishehsari F,Mahdavinia M,Vacca M,et al.Epidemiological transition of colorectal cancer in developing countries:Environmental factors,molecular pathways,and opportunities for prevention[J].World J Gastroenterol,2014,20(20):6055-6072.
[5]沈靖,王润田,徐希平.代谢酶基因多态性与环境暴露交互作用的分析方法及其应用[J].中华流行病学杂志,2001,22(1):61-64.
[6]Mehmet T,Sena EA,Comez O,et al.CYP1A1,GST gene polymorphisms and risk of chronic myeloid leukaemia[J].Swiss Med Wkly,2008,138(1/2):12-17.
[7]林国芳,马晴雯,查永林,等.上海“本地人”正常人群GSTT1和GSTM 1基因型多态性研究[J].癌变·畸变·突变,2001,13(1):10-12.
[8]王文静,李昌吉,龙云芳,等.苯白血病患者GST-μ基因缺失情况分析[J].职业卫生与病伤,2000,15(4):193-195.
[9]袁慧,王金权.谷胱甘肽转硫酶基因与急性白血病易感性的Meta分析[J].现代预防医学,2004,31(3):322-323.
Analysis on the association between leukemia susceptibility and gene polymorphism of GSTM1,GSTT1*
LIJuan1,ZHUJunfang1,ZHANGWei1,MAHaizhen2△
(1.CentreforMolecularBiology;2.DepartmentofHematology,theFristHospitalofLanzhouUniversity,Lanzhou,Gansu730000,China)
ObjectiveTo investigate the relationship between leukemia susceptibility and gene polymorphism of GSTM1,GSTT1.MethodsA total of 131 leukemia patients were recruited into group of patients,and 200 healthy person were recruited into control group.GSTM1 and GSTT1 genotypes were determined by multiplex polymerase chain reaction.Chi-square test and Fisher′s exact test was used to compare the differences between the group of patients and control group.ResultsGSTM1 null genotype frequency in group of patients was slightly higher than that of the control group(P=0.000 1,OR=2.152,95%CI=2.301-5.985),There was no GSTT1 null genotype detected in group of patients and control group.Moreover,GSTM1 null genotype frequency showed a similar trend between CML,AML and ALL.ConclusionGSTM1 null genotype might be a risk factor of leukemia.
leukemia;GSTM1;GSTT1;glutathione S-transferase
2016-01-21修回日期:2016-03-14)
甘肃省兰州市科技局自然科学基金项目(2011-2-46)。
李娟,女,副主任检验师,主要从事罕见病及肿瘤遗传学的研究。△
,E-mail:mahaizhen-2008@163.com。
10.3969/j.issn.1673-4130.2016.12.007
A
1673-4130(2016)12-1610-02

