特发性心房颤动相关TBX5基因新突变的识别
郑洪珍 仇兴标 李若谷 袁 方 徐迎佳 杨奕清
特发性心房颤动相关TBX5基因新突变的识别
郑洪珍仇兴标李若谷袁方徐迎佳杨奕清
200030上海交通大学附属胸科医院心内科
【摘要】目的:识别特发性心房颤动(房颤)相关TBX5基因新突变。方法:入选特发性房颤患者116例及健康对照者200名,获取临床资料和外周静脉血标本,抽提全部研究对象的基因组DNA,扩增TBX5基因的全部编码外显子及其侧翼内含子,对扩增片段进行测序以寻找变异。检索PubMed和SNP数据库以明确所发现基因变异的新颖性。应用MUSCLE软件分析多物种TBX5蛋白,以显示被改变氨基酸在进化上的保守性,并应用在线程序MutationTaster和PolyPhen-2分析基因变异的致病性。结果:在1例家族史阴性的特发性房颤患者发现了1个TBX5基因变异,其TBX5基因编码核苷酸序列第314位的腺嘌呤变成了胸腺嘧啶(c.314A>T),所编码蛋白的氨基酸序列第105位的天冬氨酸变成了缬氨酸(p.D105V)。该突变不存在于200名对照者,也不存在于PubMed和SNP数据库中。多序列比对分析显示第105位的天冬氨酸在进化上完全保守。在线程序分析表明所识别的基因变异具有致病性。结论:发现了1个特发性房颤相关TBX5基因新突变,提示TBX5基因突变可能是特发性房颤的少见遗传病因。
【关键词】心律失常;心房颤动;遗传学;转录因子;TBX5
心房颤动(房颤) 是最常见的持续性心律失常,其在总体人群中的发病率约为1~2%,在老年人群中的发病率则高达10%以上。房颤可显著增加患者的病残率和病死率以及经济负担[1-2]。虽然房颤可继发于高血压、冠状动脉粥样硬化性心病等基础疾病,但特发性房颤主要是由遗传危险因素所致[1,3]。尽管如此,由于房颤具有显著的遗传异质性,大部分房颤患者的遗传缺陷仍有待识别。近年来的研究发现,位于TBX5基因内的单核苷酸多态与房颤的易感性增加有关[4-6],而且TBX5基因突变可导致包括房颤在内的Holt-Oram综合征即心手综合征[7]。这些研究结果提示TBX5基因突变有可能导致特发性房颤,因此本研究拟识别特发性房颤相关TBX5基因突变。
1对象与方法
1.1研究对象
选取2014年2月~2015年1月入本院治疗的116例无血缘关系的中国汉族特发性房颤患者(男65例,年龄32~60岁,平均53岁)和200名无血缘关系的中国汉族健康对照者(男110例,年龄35~64岁,平均54岁)。详细询问病史、全面体检、常规实验室检查、标准12导联心电图检查以及心脏超声检查。特发性房颤的诊断及其分类依据2014年发布的房颤处理指南[8]。简而言之,患者心电图表现为P波消失、R-R间隔不等但无结构性心脏病、高血压病、心肌病等基础性疾病即可诊断为特发性房颤。全部房颤患者均经心电图确诊,排除继发性或综合征型房颤。本研究符合医学伦理学规范,经研究对象知情同意后收集其血常规检验后原本丢弃的剩余血,使用基因组DNA纯化试剂盒(美国Promega公司),提取基因组DNA。
1.2方法
1.2.1TBX5基因扩增使用以前报道的扩增TBX5基因外显子及侧翼内含子的引物序列[9-10],由上海生工生物工程有限公司合成。以基因组DNA为模板,使用上述引物和HotStar Taq DNA聚合酶(德国Qiagen公司)等聚合酶链反应(polymerase chain reaction,PCR)试剂,用Veriti型PCR仪(美国Applied Biosystem公司)扩增TBX5基因片段。每一PCR反应的体积为25 μL,其中5Q溶液5 μL,10×缓冲液2.5 μL, dNTP(各2.5 mmol/L)2 μL,上、下游引物(20 μmol/L)各0.5 μL, 基因组DNA(200 ng/ μL)1 μL,HotStar Taq DNA聚合酶(5 U/μL)0.25 μL,双蒸水13.25 μL。PCR反应的条件是:首先95℃预变性15 min,然后进入35个循环,每个循环94℃变性30 s,62℃退火30 s,72℃延伸1 min,最后72℃延伸5 min。使用凝胶回收试剂盒(德国Qiagen公司)纯化所扩增的DNA片段。
1.2.2TBX5基因序列分析以纯化的DNA片段为模板,使用上述正向引物和BigDye®Terminator v3.1测序试剂盒(美国Applied Biosystem公司)在Veriti型PCR仪(美国Applied Biosystem公司)上进行测序反应。测序反应的总体积为10 μL,其中预混合液4 μL,上游引物(2 μmol/L)1 μL,纯化的DNA片段(20 ng/ μL)2 μL,双蒸水3 μL。测序反应的条件是:共30个循环反应,其中每个循环95℃变性20 s,50℃退火15 s,60℃延伸1 min。测序反应产物经纯化后在3130 XL 型DNA测序仪(美国Applied Biosystem公司)上进行电泳测序。使用 DNA序列分析软件(美国Applied Biosystem公司)分析测序结果并与核苷酸数据库中的已知TBX5基因序列(登陆号NG_007373.1)进行对比以识别TBX5基因变异。如发现TBX5基因变异,则对200名健康对照者的TBX5基因进行测序,同时检索PubMed和SNP数据库(http://www.ncbi.nlm.nih.gov)以明确所发现基因变异的新颖性。
1.2.3TBX5变异的保守性分析应用在线软件MUSCLE(http://www.ncbi.nlm.nih.gov),比对分析多物种TBX5蛋白的氨基酸序列,以评估被改变氨基酸在进化上的保守性。
1.2.4TBX5变异的致病性分析对于所发现的TBX5基因变异,应用在线软件MutationTaster(http://www.mutationtaster.org)和PolyPhen-2 (http://genetics.bwh.harvard.edu/pph2)分析其致病性。
1.3统计学分析
应用SPSS17.0统计软件包对数据进行分析。连续变量用均数±标准差表示。两组连续变量的比较使用Student’st检验,分类变量的比较则根据需要使用Pearson’sχ2检验或Fisher 精确概率计算。双侧统计值P<0.05表示有统计学差异。
2结果
2.1特发性房颤患者的基本临床特点
房颤组与对照组的年龄和性别相匹配,心功能相似,均无明确的心血管疾病病史,但房颤组的左心房较大,部分患者有房颤家族史,而对照组中均无房颤家族史。本研究对象的基本临床特点见表1。
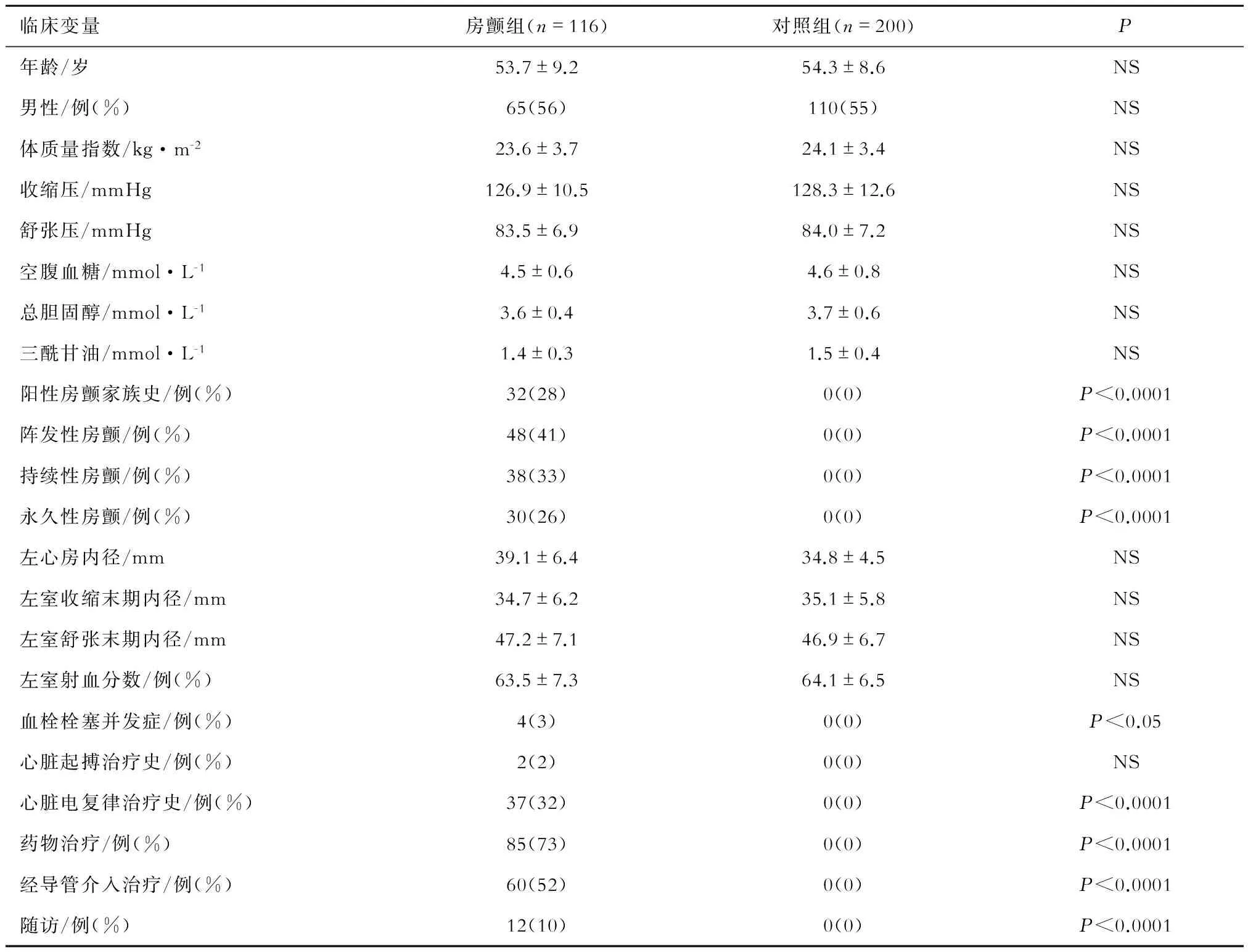
表1 本研究对象的基本临床特点
2.2发现TBX5基因新突变
通过对116例特发性房颤患者的TBX5基因进行测序分析,在其中1例58岁男性患者发现TBX5基因杂合错义突变,突变检出率约为0.86%。该患者TBX5基因编码核苷酸序列第314位的腺嘌呤变成了胸腺嘧啶(c.314A>T),相应地其编码核苷酸序列第105位的谷氨酸变成了缬氨酸(p.D105V)。该患者在52岁时无明显诱因突发心悸,经心电图确诊为阵发性房颤,否认房颤家族史。该突变不存在于200名健康对照者。经检索PubMed和SNP数据库均未发现该突变,表明所识别的突变为新突变。TBX5基因杂合突变及其正常对照序列分别见图1A和1B。该突变在TBX5蛋白上的位置见图1C。
2.3突变氨基酸在物种进化上高度保守
如图2所示,将人TBX5蛋白之氨基酸序列与大猩猩、猴子、狗、牛、小鼠、大鼠、家禽、斑马鱼和青蛙的进行比对分析显示,人TBX5蛋白之氨基酸序列第105位的谷氨酸在物种进化上完全保守。
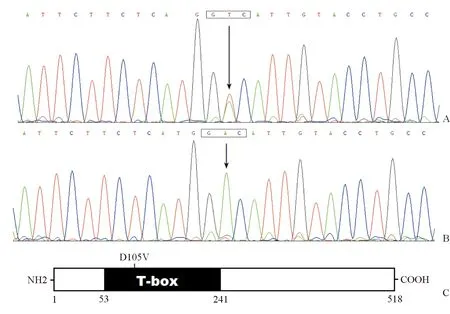
图1 TBX5基因杂合突变序列(A)、正常对照序列(B)及突变氨基酸位置(C)(图中箭头所指为突变位点及其对照)

图2 多物种TBX5蛋白之氨基酸序列比对分析结果(图中阴影标示突变氨基酸)
2.4TBX5新突变具有致病性
TBX5基因变异c.314A>T经MutationTaster预测为致病性突变,预测正确的概率值为1。另外,TBX5变异p.D105V 也被PolyPhen-2预测为致病性突变,预测正确的概率值为1(预测的敏感性为0,特异性为1.00)。
3讨论
本研究在1特发性房颤患者发现了1个TBX5基因新突变,该突变不存在于200名健康对照者,多物种TBX5蛋白之氨基酸序列比对分析显示被改变氨基酸在物种进化上完全保守,而且多个在线程序预测该基因变异具有致病性,因此该基因突变很可能是导致该患者房颤的分子病因。
T-box基因编码转录因子,其特点是均有1个被称为T-box的高度保守结构域。该结构域不仅能特异性地识别并结合靶基因启动子DNA元件,而且还能与其他转录因子相互作用,协同调节靶基因的表达[11]。目前在人和哺乳动物已经发现了至少17种TBX基因,其中在心脏高表达的TBX基因有6种,即TBX1、TBX2、TBX3、TBX5、TBX18和 TBX20,它们在心肌分化和心脏发育方面起着关键作用[11]。作为TBX家族的重要1员,TBX5基因定位于12q24.1,编码由518个氨基酸所组成的转录因子蛋白,调节动物心血管等的正常发育[11]。本研究所识别的TBX5基因突变位于T-box结构域,因此推测该突变可能通过影响TBX5与靶基因启动子DNA元件的特异性结合而影响靶基因的表达,也有可能影响转录因子的相互作用如协同作用而影响靶基因的表达,进而使心血管发育异常,导致房颤[11-13]。尽管如此,该基因突变导致房颤的确切机制仍有待于进一步深入研究。
以前的研究支持TBX5基因突变可能通过影响心血管发育而导致房颤。动物实验发现在胚胎发育期TBX5基因大量表达于心脏,在心血管发育尤其是心肌细胞增殖、分化、特化、迁移、定型及形态发生等方面发挥着关键作用[11]。在小鼠,TBX5基因广泛表达于心芽、线型心管、心房、心室、上下腔静脉以及房室结和室内束支等传导系统[11]。TBX5基因敲除纯合子小鼠由于心脏环化障碍、窦房和左心室发育不良而在胚胎期死亡;而TBX5基因敲除杂合子小鼠则表现为房间隔缺损、室间隔缺损、心内膜垫缺损、左心室发育不良及传导系统形态和功能异常,包括房室及束支传导阻滞[14]。在胚胎和成年人心脏,TBX5基因表达于全部四个心腔的心肌和心外膜以及左心室心内膜[15],已经发现许多TBX5突变可导致包括先天性心血管畸形、心脏传导系统缺陷和房颤在内的Holt-Oram综合征[7,16,17]。不仅如此,多项研究显示,心脏传导系统异常是房颤的独立危险因素[7],而且有多个关联研究显示TBX5基因变异与特发性房颤密切相关[4-6]。这些研究结果均支持TBX5基因异常促发房颤。
总之,本研究首先报道人类TBX5基因突变与特发性房颤有关,这有助于揭示房颤的新的分子机制。
参考文献
[1]Palatinus JA, Das S. Your father and grandfather's atrial fibrillation: a review of the genetics of the most common pathologic cardiac dysrhythmia[J]. Curr Genomics, 2015, 16(2): 75-81.
[2]谭红伟, 邱建平, 刘学波. 心房颤动导管消融围手术期抗凝治疗策略[J]. 国际心血管病杂志, 2015, 42(3): 147-150.
[3]王骏, 张代富. 心房颤动相关4q25基因座单核苷酸多态性的研究进展[J]. 国际心血管病杂志, 2014, 41(3): 143-145.
[4]Holm H, Gudbjartsson DF, Arnar DO, et al. Several common variants modulate heart rate, PR interval and QRS duration[J]. Nat Genet, 2010, 42(2): 117-122.
[5]Zang X, Zhang S, Xia Y, et al. SNP rs3825214 in TBX5 is associated with lone atrial fibrillation in Chinese Han population[J]. PLoS One, 2013, 8(5): e64966.
[6]Sinner MF, Tucker NR, Lunetta KL, et al. Integrating genetic, transcriptional, and functional analyses to identify 5 novel genes for atrial fibrillation[J]. Circulation, 2014, 130(15): 1225-1235.
[7]Postma AV, van de Meerakker JB, Mathijssen IB, et al. A gain-of-function TBX5 mutation is associated with atypical Holt-Oram syndrome and paroxysmal atrial fibrillation[J]. Circ Res, 2008, 102(11): 1433-1442.
[8]January CT, Wann LS, Alpert JS, et al. 2014 AHA/ACC/HRS guideline for the management of patients with atrial fibrillation: a report of the American College of Cardiology/American Heart Association Task Force on practice guidelines and the Heart Rhythm Society[J]. Circulation, 2014, 130(23): e199-e267.
[9]Zhang XL, Qiu XB, Yuan F, et al. TBX5 loss-of-function mutation contributes to familial dilated cardiomyopathy[J]. Biochem Biophys Res Commun, 2015, 459(1): 166-171.
[10]Zhou W, Zhao L, Jiang JQ, et al. A novel TBX5 loss-of-function mutation associated with sporadic dilated cardiomyopathy[J]. Int J Mol Med, 2015, 36(1): 282-288.
[11]Greulich F, Rudat C, Kispert A. Mechanisms of T-box gene function in the developing heart[J]. Cardiovasc Res, 2011, 91(2): 212-222.
[12]Mahida S. Transcription factors and atrial fibrillation[J]. Cardiovasc Res, 2014, 101(2): 194-202.
[13]Mommersteeg MT, Christoffels VM, Anderson RH, et al. Atrial fibrillation: a developmental point of view[J]. Heart Rhythm, 2009, 6(12): 1818-1824.
[14]Bruneau BG, Nemer G, Schmitt JP, et al. A murine model of Holt-Oram syndrome defines roles of the T-box transcription factor Tbx5 in cardiogenesis and disease[J]. Cell, 2001, 106(6): 709-721.
[15]Hatcher CJ, Goldstein MM, Mah CS, et al. Identification and localization of TBX5 transcription factor during human cardiac morphogenesis[J]. Dev Dyn, 2000, 219(1): 90-95.
[16]Al-Qattan MM, Abou Al-Shaar H. Molecular basis of the clinical features of Holt-Oram syndrome resulting from missense and extended protein mutations of the TBX5 gene as well as TBX5 intragenic duplications[J]. Gene, 2015, 560(2): 129-136.
[17]Baruteau AE, Probst V, Abriel H. Inherited progressive cardiac conduction disorders[J]. Curr Opin Cardiol, 2015, 30(1): 33-39.
(收稿:2015-12-20修回:2016-03-02 )
(本文编辑:丁媛媛)
基金项目:国家自然科学基金(81270162, 81470372, 81400244)
通信作者:杨奕清,Email: dryyq@tongji.edu.cn
doi:10.3969/j.issn.1673-6583.2016.03.011
Identification of a novel TBX5 mutation associated with idiopathic atrial fibrillationZHENGHongzhen,QIUXingbiao,LIRuogu,YUANFang,XUYingjia,YANGYiqing.DepartmentofCardiology,ShanghaiChestHospital,ShanghaiJiaoTongUniversity,Shanghai200030,China
【Abstract】Objective:To identify a novel TBX5 mutation associated with idiopathic atrial fibrillation (AF). Methods:A cohort of 116 unrelated patients with idiopathic AF and a total of 200 unrelated healthy individuals used as controls were enlisted. The clinical data and peripheral venous blood samples were obtained from all the study participants. The genomic DNA was isolated by DNA purification kit. The whole coding exons and flanking introns of the TBX5 gene was amplified by polymerase chain reaction, with the genomic DNA as a template. The amplified products were sequenced for variation with DNA sequencing kit on a DNA Analyzer. The PubMed and SNP databases were retrieved to confirm the novelty of an identified TBX5 variation. Multiple alignments of TBX5 proteins across species were performed by the MUSCLE software to show whether the altered amino acid was evolutionarily conserved. The disease-causing potential of the identified variation was evaluated by using the online programs MutationTaster and PolyPhen-2. Results:A substitution of thymine for adenine at coding nucleotide 314 (c.314A>T), predicting the transition of aspartic acid at amino acid position 105 to valine (p.D105V), was identified in TBX5 in a patient with idiopathic AF, who had a negative family history of AF. The mutation was absent in 400 control chromosomes and not found in the PubMed and SNP databases. Alignment of multiple TBX5 proteins among various species displayed that the aspartic acid at position 105 was completely conserved evolutionarily. Furthermore, the variation was predicted to be causative by MutationTaster and PolyPhen-2. Conclusion:Identification of a novel TBX5 mutation associated with idiopathic AF suggests that TBX5 mutation is likely to be a rare genetic cause of idiopathic AF.
【Key words】Cardiac arrhythmia; Atrial fibrillation; Genetics; Transcription factor; TBX5

