肝细胞生长因子对光老化成纤维细胞凋亡及周期的影响
杨清建, 毕 波, 朱宁文, 陈 亮, 贾传龙, 卢勇舟,
实验研究
肝细胞生长因子对光老化成纤维细胞凋亡及周期的影响
杨清建, 毕 波, 朱宁文, 陈 亮, 贾传龙, 卢勇舟,
周轶群, 杨 平, 郭 妤, 朱晶晶, 刘天一
目的 探讨肝细胞生长因子(HGF)对紫外线诱导皮肤成纤维细胞周期及凋亡的影响。方法 建立光老化模型,皮肤成纤维细胞(FBs)经HGF处理后行倒置显微镜观察、细胞计数并予以流式细胞周期检测;以HGF预处理皮肤FBs 2 h,中波紫外线(UVB)照射诱导体外FBs细胞发生细胞损伤,Tunel染色试剂盒检测细胞凋亡。结果 光老化模型建立后,UVB+HGF组细胞存活较UVB组增多(P<0.05);HGF减少光老化成纤维细胞P53的表达,改善光老化FBs细胞周期分布;HGF能够减少UVB导致的FBs凋亡(P<0.05)。结论HGF可调控光老化细胞周期分布及减少细胞凋亡,在光老化治疗中具有潜在应用前景。
肝细胞生长因子; 光老化; 成纤维细胞; 细胞周期; 凋亡
皮肤光老化是指皮肤长期受到日光照射所引起的损害,表现为皮肤粗糙、增厚、松弛,呈深而粗的皱纹[1],局部有过度的色素沉着或毛细血管扩张,甚至可能出现各种良恶性肿瘤[2-3]。紫外线作为日光中主要的高能射线,目前普遍认为是导致皮肤光老化的主要因素[4]。作为皮肤真皮层中含量最多的细胞成分,成纤维细胞在光老化中发生的一系列改变对光老化的发生和发展具有重要意义[5-7]。肝细胞生长因子(hepatocyte growth factor, HGF)是一种具有多种生物功能的细胞因子及重要的细胞生存调节因子[8-10],也是潜在的细胞生存因子[10]和抗细胞凋亡因子[11]。近期的研究表明,HGF通过包括MAPK/ERK依赖的P13K磷酸化信号转导途径保护心肌细胞对抗凋亡[12]。自2015年6月,复旦大学附属华东医院整形外科对HGF在光老化过程中成纤维细胞(fibroblasts, FBs)损伤的抗细胞凋亡作用进行了探讨。
1 材料与方法
1.1 小鼠皮肤FBs的获取及培养 取1~3 d 无特定病原体(specific pathogen free, SPF)级C57 BL/6小鼠,经乙醚麻醉处死后,浸泡于75%乙醇中10 min,用DMEM洗去残留乙醇,置于培养皿中,剪刀分离背部皮肤,剪下皮肤组织块约1 cm×1 cm,立即置于2%中性蛋白酶中,37℃恒温消化4 h;将皮肤取出,镊子分离表皮和真皮,将真皮剪碎后置于0.1%胶原酶中,37℃恒温摇床消化2 h,至组织块基本消失。1500 r/min离心5 min,收集沉淀;弃上清,细胞以DMEM+10% FBS制成细胞悬液,吹打均匀后以约2×105/cm2的密度接种于培养皿,于37℃,5% CO2,100%饱和湿度的条件下培养;接近80%融合时进行传代,比例约为1∶4。
1.2 药物处理及分组 选用P2代细胞,将细胞随机分成4组:正常组、HGF组(HGF处理)、中波紫外线(ultraviolet radiation b, UVB)模型组(UVB照射)、UVB+HGF组(HGF处理+UVB照射)。方法:移去培养液,覆盖薄层磷酸盐缓冲液(phosphate buffered solution, PBS),打开盖子,置于UVB灯管(飞利浦 TL 20 W/01 RS)正下方,进行首次照射,照射剂量(使用Lutron UV light meter测量)为120 mJ/cm2。照射完毕后,吸去PBS,加入10.0 ml DMEM+1% FBS继续培养,每隔12 h照射1次,120 s/次,共4次;末次照射完成后改为DMEM+10%FBS培养。
1.3 倒置显微镜观察光老化模型并进行细胞计数分析 末次照射4~6 h,分别将4组细胞置于倒置相差显微镜(日本尼康)下观察细胞形态、细胞密度并摄影。然后分别将4组细胞用0.25%胰酶消化后,PBS洗涤1次,用细胞计数板计数。
1.4 碘化丙锭检测细胞周期 末次照射12 h后,将培养液移去,PBS冲洗3次,胰酶消化成单细胞悬液, PBS洗涤2次,每次1000 r/min,离心5 min。尽可能完全去除上清,加入1 ml于-20℃ 70%乙醇中,边振荡边加,使细胞分散,固定完全,4℃过夜或将标本保存于-20℃,直至DNA染色。染色后取出标本,于250 r/min离心5 min,尽可能完全去除上清,然后再用PBS洗涤1、2次,250 r/min离心5 min。加入1.0 ml DNA染液,充分振荡,4℃避光孵育30 min。流式细胞仪检测。DNA染色液(10.0 ml,新鲜配制)组成:Triton X-100 10 μl+1 mg/ml碘化丙碇(PI)200 μl+DNase-free Rnase 2 mg+PBS 9.79 ml。
1.5 Western blot检测蛋白表达 细胞末次照射48 h后,移去培养液,预冷PBS洗涤3次,培养皿移至冰上,加入蛋白裂解液500 μl,用1.0 ml针头反复吹打,转移至1.5 ml EP管中,冰上静置15 min。12 000 r/min,4℃离心15 min,取上清,用BCA法测定蛋白浓度;取各个处理组蛋白提取液,调整蛋白浓度,与等体积2倍上样缓冲液混合,煮沸并离心;电泳分离蛋白并将蛋白质转移至PVDF膜上,孵育袋中加入TEST稀释的P53 (abcam 1∶500) 和 GAPDH (boster 1∶2000 ),4℃孵育过夜;采用辣根过氧化物酶(HRP)标记的羊抗兔二抗(Jack-son 1∶2000)室温孵育2 h,用ECL化学发光法显影和定影。
1.6 Tunel染色 选用P2代细胞,采用HGF浓度5 ng/ml的DMEM+10% FBS处理2 h。照射处理后约1 h,4组细胞用PBS洗涤1次,用4%多聚甲醛固定细胞30~60 min,PBS洗涤1次,加入含0.1%Triton X-100的PBS冰浴孵育2 min;配制TUNEL检测液(一步Tunel染色试剂盒,南京碧云天公司)每个样本含TdT酶2 μl、荧光标记液48 μl;在样品上加50 μl TUNEL检测液,37℃避光孵育60 min,PBS洗涤3次;用抗荧光淬灭封片液封片后,在荧光显微镜下观察。Cy3的激发波长为550 nm,发射波长为570 nm(红色荧光)。于高倍荧光显微镜下每组随机选取视野,计数细胞总数(每组不少于200个)。
2 结果
2.1 HGF可增加光老化FBs的存活数目 经过4次亚致死剂量UVB辐照后[13],UVB模型组细胞数目明显较正常组、HGF组细胞数目少;而UVB+HGF组的细胞数目明显较UVB组多;HGF对未经UVB辐照的细胞组,即HGF组的细胞数目无明显影响(图1)。经统计学分析,4组细胞中UVB模型组细胞数目较正常组差异有统计学意义(P<0.01);经HGF预处理后的FBs即UVB+HGF组较UVB模型组差异有统计学意义(P<0.05);正常组与HGF组差异无统计学意义(P>0.05)。
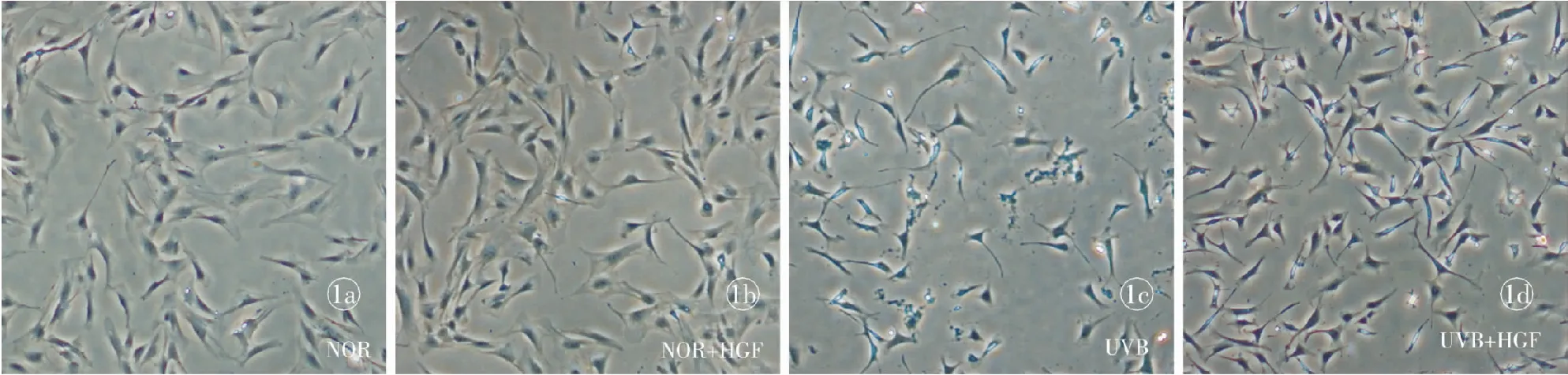
图1HGF对光老华成纤维细胞存活率的影响a. 正常组b.NOR+HGF组c.UVB模型组d.UVB+HGF组
Fig 1 The effect of HGF on photoaging fibroblasts survival. a. Normal group. b. NOR+HGF group. c. UVB model group.
d. UVB+HGF group.
2.2HGF改善光老化FBs细胞周期分布及HGF减少光老化细胞P53的表达 通过对细胞周期的分析,我们发现UVB可造成FBs细胞周期阻滞,所示照射组的G0/G1分布下降(从78.4%±2.21%降至44.3%±1.80%),而S期及G2/M期则有所增加(分别从9.18%±1.55%到33.7%±0.70%及从12.4%±1.25%到21.9%±1.10%);HGF可部分逆转这一改变。我们通过进一步WesternBlot检测细胞周期蛋白P53的含量,发现HGF能够减少UVB模型组P53细胞周期蛋白的表达(图2)。我们推测,HGF能够减少UVB照射后P53的表达,促使部分细胞重新进入细胞周期,从而部分缓解细胞周期阻滞。

图2Westernblot检测p53蛋白结果
Fig 2 Western blot detection results of p53 protein.
2.3 HGF减少UVB导致的FBs凋亡 大量的DNA双链断裂被认为是凋亡中最显著的特征。TUNEL法是识别DNA缺口处3′-OH 末端,由于DNA双链断裂发生在凋亡早期,故TUNEL可检测出早期凋亡细胞。经过Tunel染色后发现正常组及HGF组细胞仅极个别细胞能被荧光素标记,即发生早期凋亡;而经过UVB辐照后的FBs早期凋亡细胞数目显著增加,具有统计学意义(P<0.01);但经HGF预处理后的FBs发生早期凋亡的细胞数目较UVB模型组明显减少,具有统计学意义(P<0.05)。
3 讨论
皮肤成纤维细胞DNA在受到紫外线辐射后,造成DNA链上相邻的2个嘧啶碱基发生共价结合,生成嘧啶二聚体(cyclobutane pyrimidine dimers, CPDs)。当细胞中DNA损伤积累到一定量时,细胞就会进入细胞周期阻滞或凋亡[14]。阳光中紫外线含量最多的是UVA(约占阳光的5.6%),远超过UVB的含量(约占阳光中的0.15%)[13],但UVB的生物学作用却是远超UVA。有研究认为,UVB是造成光老化过程中DNA损伤的重要原因[3]。UVB被细胞的DNA吸收,可引起碱基对突变,产生CPDs和6-4光产物等物质。DNA的损伤会导致P53的激活,包括磷酸化、乙酰化、甲基化、泛素化等,同时p53的半衰期延长,在细胞内的浓度升高,激活的p53蛋白可结合到特定的靶基因序列,增加其转录,进而细胞有丝分裂受阻,导致细胞周期阻滞(L Rittié, 2002年)。
细胞凋亡包含了内源性途径(线粒体途径)和外源性途径(受体介导的细胞死亡途径)。当不同的信号进入细胞,细胞必须对多种信号进行平衡调节,最终作出一种适当的反应,如增殖、分化、生存或凋亡等。凋亡过程中,所有的信号分子连接成一个信号协同网络,当细胞对多种细胞毒性刺激产生反应时,大量的凋亡前和抗凋亡因子启动。若DNA严重损伤出现后,细胞超出了它的修复能力,细胞即出现凋亡[15]。大量的DNA双链断裂被认为是凋亡中最显著的特征(M Mildner, 2002年)。TUNEL技术实际上是分子生物学和形态学相结合的研究方法,细胞凋亡的一个标志是核酸内切酶首先切割染色体DNA,DNA双链断裂或单链出现缺口产生3′-OH末端,形成180~200 bp核小体DNA多聚体。TUNEL技术的原理即在脱氧核糖核苷酸酶(TdT)的作用下, 将荧光素标记的脱氧核糖核苷酸标记到3′-OH上,从而检测到早期的细胞凋亡。与文献报道一致,HGF不仅能够减少心肌[16]、肝细胞[17]等细胞的凋亡,同样能够减少UVB辐照导致的皮肤FBs的凋亡。
大量针对细胞周期改变及凋亡的研究证实,紫外线辐照能够激活NF-κB转录因子通路(M Yaar, 2007年),诱导促炎细胞因子如IL-1、IL-6、血管内皮生长因子VEGF和TNF-β表达,参与免疫调节和细胞周期。这其中的NF-κB通常被看做是生存因子[15],在细胞阻滞和凋亡过程中也起到重要作用。NF-κB)通过与其他核因子结合而发挥功能。其中NF-κB调节Noxa表达在P53介导的细胞凋亡中是关键分子。此外,NF-κB复合物在与p53、BCL-3作用过程中,转变并形成NF-κB-HDAC1复合物。这种复合物会抑制细胞周期素D1的表达,导致细胞周期阻滞和细胞凋亡[18]。
研究表明,HGF是一个具有促细胞存活的细胞因子,它可以减少多种细胞类型的凋亡。但HGF抗凋亡信号在细胞经何种途径传导还不十分清楚。有研究指出,抗凋亡信号是通过激活PI3K 和MAPK进行传导。我们通过本实验发现,HGF可降低UVB诱导的光老化FBs细胞周期蛋白P53的表达,使光老化细胞的细胞周期发生改变,部分改善细胞周期阻滞,减少光老化细胞的凋亡。HGF这种对光老化细胞凋亡的明显抑制作用,具有潜在的延缓皮肤FBs光老化进程作用,为皮肤光老化的治疗提出了一种新的可能。然而,由于体内外的环境大相径庭,加之动物与人类之间的种族差异因素等,故本研究仅为临床治疗提供初步的思路。
[1] 贾传龙, 陈 亮, 杨清建, 等. 脂肪来源干细胞对光老化皮肤细胞外基质的影响[J]. 中国美容整形外科杂志, 2015,26(12):744-746.
[2] Kohl E, Steinbauer J, Landthaler M, et al. Skin ageing[J]. J Eur Acad Dermatol Venereol, 2011,25(8):873-884.
[3] Gilchrest BA. Photoaging[J]. J Invest Dermatol, 2013,133(E1):E2-6.
[4] Pandel R, Poljsak B, Godic A, et al. Skin photoaging and the role of antioxidants in its prevention[J]. ISRN Dermatol, 2013:930164.
[5] 杨清建, 毕 波, 刘天一. 光老化过程中皮肤成纤维细胞的生物学改变[J]. 中国美容整形外科杂志, 2014,25(8):480-483.
[6] 卢勇舟, 陈 亮, 毕 波, 等. 胶原蛋白碎片对光老化真皮细胞外基质的影响[J]. 中国美容整形外科杂志, 2015,26(4):213-215.
[7] 陈 亮, 毕 波, 曾继平, 等. 罗格列酮对 UVB 诱导的小鼠光老化皮肤成纤维细胞MMPs表达和细胞外基质蛋白合成的影响[J]. 中国美容整形外科杂志, 2015,26(8):500-503.
[8] Li JF, Duan HF, Wu CT, et al. HGF accelerates wound healing by promoting the dedifferentiation of epidermal cells through beta1-integrin/ILK pathway[J]. Biomed Res Int, 2013:470418.
[9] Lu F, Zhao X, Wu J, et al. MSCs transfected with hepatocyte growth factor or vascular endothelial growth factor improve cardiac function in the infarcted porcine heart by increasing angiogenesis and reducing fibrosis[J]. Int J Cardiol, 2013,167(6):2524-2532. [10] Chandrasekher G, Pothula S, Maharaj G, et al. Differential effects of hepatocyte growth factor and keratinocyte growth factor on corneal epithelial cell cycle protein expression, cell survival, and grow-th[J]. Mol Vis, 2014,20:24-37.
[11] Jain SK, Baggerman EW, Mohankumar K, et al. Amniotic fluid-borne hepatocyte growth factor protects rat pups against experimental necrotizing enterocolitis[J]. Am J Physiol Gastrointest Liver Physiol, 2014,306(5):G361-369.
[12] Wang X, Wang Y, Rong S, et al. Hepatocyte growth factor improves right ventricular remodeling in pulmonary arterial hypertensive rats via decreasing neurohormonal activation and inhibiting apoptosis[J]. Chin Med J (Engl), 2014,127(10):1924-1930.
[13] Zeng JP, Bi B, Chen L, et al. Repeated exposure of mouse dermal fibroblasts at a sub-cytotoxic dose of UVB leads to premature senescence: a robust model of cellular photoaging[J]. J Dermatol Sci, 2014,73(1):49-56.
[14] Chen L, Bi B, Zeng J, et al. Rosiglitazone ameliorates senescence-like phenotypes in a cellular photoaging model[J]. J Dermatol Sci, 2015,77(3):173-181.
[15] Flusberg DA, Sorger PK. Surviving apoptosis: life-death signaling in single cells. Trends Cell Biol, 2015,25(8):446-458.
[16] Savi M, Bocchi L, Fiumana E, et al. Enhanced engraftment and repairing ability of human adipose-derived stem cells, conveyed by pharmacologically active microcarriers continuously releasing HGF and IGF-1, in healing myocardial infarction in rats[J]. J Biomed Mater Res A, 2015,103(9):3012-3025.
[17] Chi CH, Liu IL, Lo WY, et al. Hepatocyte growth factor gene therapy prevents radiation-induced liver damage[J]. World J Gastroenterol, 2005,11(10):1496-1502.
[18] Lee YK, Cha HJ, Hong M, et al. Role of NF-kappaB-p53 crosstalk in ultraviolet A-induced cell death and G1 arrest in human dermal fibroblasts[J]. Arch Dermatol Res, 2012,304(1):73-79.
Effect of hepatocyte growth factor on apoptosis and cell cycle of skin fibroblasts induced by UV
YANGQing-jian,BIBo,ZHUNing-wen,CHENLiang,JIAChuan-long,LUYong-zhou,ZHOUYi-qun,YANGPing,GUOYu,ZHUJing-jing,LIUTian-yi.
(DepartmentofPlasticSurgery,HuadongHospitalAffiliatedtoFudanUniversity,Shanghai200040,China)
LIUTian-yi,Email:tianyiliucn@163.com
Objective To investigate the influence of HGF on cell cycle and apoptosis in photoaging skin fibroblasts induced by UV. Methods A photoaging model was established, skin FBs were treated by HGF under inverted microscope, cell count and flow cytometry were detected. HGF pretreatment skin FBs for 2 hours, FBs in cells in vitro induced by UVB irradiation injury, Apoptosis was detected by Tunel staining kits. Results After photoaging model establishment, the UVB+HGF group had more surviving cells than that in the UVB group (P<0.05);HGFreducestheexpressionofP53inphotoagingfibroblasts,andimprovesthedistributionofphotoagingFBscellcycle.HGFcanalsodecreaseFBsapoptosiscausedbyUVBexposure(P<0.05). Conclusion HGF can regulate photoaging FBs cell cycle distribution and reduce cell apoptosis, which has a potential application prospect in photoaging treatment.
Hepatocyte growth factor; Photoaging; Fibroblast; Cell cycle; Apoptosis
国家自然科学基金(81272125,81301642);上海市卫生系统优秀学科带头人培养计划(XBR2011033);863项目(SS2014AA020705) 作者单位:200040 上海,复旦大学附属华东医院 整形外科(杨清建,毕 波,陈 亮,贾传龙,卢勇舟,周轶群,杨 平,郭 妤,朱晶晶,刘天一);复旦大学附属华山医院 皮肤科(朱宁文) 第一作者:杨清建(1987-),男,山东曹县人,硕士研究生. 通信作者:刘天一,200040,复旦大学附属华东医院 整形外科,电子信箱:tianyiliucn@163.com
10.3969/j.issn.1673-7040.2016.12.012
R
A
1673-7040(2016)12-0740-04
2016-06-07)

