小鼠脂肪来源间充质干细胞细胞因子蛋白质组学分析
杨清建,毕 波,陈 亮,曾继平,杨 平,周轶群,郭 妤,朱晶晶,朱宁文,刘天一
脂肪移植及研究
小鼠脂肪来源间充质干细胞细胞因子蛋白质组学分析
杨清建,毕 波,陈 亮,曾继平,杨 平,周轶群,郭 妤,朱晶晶,朱宁文,刘天一
目的 比较ADSCs和皮肤成纤维细胞(FBs)分泌细胞因子的差异。方法 体外培养小鼠ADSCs和皮肤FBs,提取ADSCs和FBs的胞浆蛋白,利用蛋白质组学方法测定细胞因子表达量,通过数据分析软件分析两者之间表达差异有统计学意义的主要细胞因子。结果 共有31种细胞因子仅ADSCs分泌,FBs不分泌;ADSCs分泌占优势的细胞因子共20种。VEGF、FGF-21等在ADSCs裂解液中含量明显多于在FBs裂解液中含量(P<0.05),HGF、PDGF-C等仅在ADSCs裂解液中检测到。结论 ADSCs与FB分泌的细胞因子之间有明显差异。与FBs相比,ADSCs能够分泌更多种类的细胞因子。
脂肪来源间充质干细胞; 成纤维细胞; 细胞因子; 蛋白质组学分析; 小鼠
笔者前期研究结果显示,ADSCs裂解液对光老化成纤维细胞具有延缓衰老、抗氧化等保护作用。为进一步阐明ADSCs中哪些细胞因子可能会对光老化成纤维细胞起到保护作用,自2014年4月至2014年7月,复旦大学附属华东医院整形外科比较了ADSCs和皮肤成纤维细胞(fibroblasts, FBs)中细胞因子的差异,以期为进一步研究提供理论支持及线索。
1 材料与方法
1.1 标本来源
SPF级1周龄C57 BL/6小鼠30只,雌雄不限,由复旦大学实验动物中心提供。
1.2 主要试剂与仪器
DMEM培养基(美国HYCLONE公司),胎牛血清、双抗(美国GIBCO公司),RIPA裂解液(武汉碧云天生物技术研究所),BCA试剂盒(美国PIERCE公司),AAM-BLG-1试剂盒(美国RAYBIOTECH公司)。
1.3 实验方法
1.3.1 ADSCs和FBs的分离、培养 采用文献报道的经典ADSCs获取和培养扩增方法[1-2],具体操作步骤如下:无菌条件下,取出小鼠腹股沟区脂肪团块,剪碎后置于0.1%Ⅰ型胶原酶消化液中,37 ℃下消化45 min,1500 r/min离心5 min, 弃去上清液,接种于低糖DMEM培养基(加入10%FBS、100 U/ml青霉素、100 μg/ml链霉素),置于37 ℃、5%CO2孵箱内培养,3 d后传代1次,取P1代细胞进行实验。分别取3个小鼠的ADSCs,分别编号为ADSCs-E1、ADSCs-E2、ADSCs-E3。
另于无菌条件下,用眼科剪剪取背部皮肤,置于含0.2%dispase酶的培养液中,在4 ℃环境下过夜。分离真皮层,弃去表皮,将真皮组织剪碎后置于0.1%Ⅰ型胶原酶的消化液中,37 ℃下消化60 min,1500 r/min离心5 min,弃去上清液,接种于DMEM培养基(加入10%FBS、100 U/ml青霉素、100 μg/ml链霉素),置于37 ℃、5%CO2孵箱内培养,2 d后传代1次,取P1代细胞进行实验。编号为FB-E。
1.3.2 获取细胞裂解液 待培养皿中细胞长满后,此时细胞数目约为4×106~5×106/皿,用PBS冲洗2遍,加入RIPA裂解液(强)500 μl(使用前数分钟内加入1 mmol/L PMSF)。冰浴5 min,收集裂解液至1.5 ml EP管,并轻轻吹打,使细胞充分裂解。于4 ℃,12 000 r/min离心15 min,吸取上清液,即为细胞裂解液,保存在-80 ℃冰箱内备用。
1.3.3 蛋白芯片检测细胞因子 细胞裂解液经透析后,应用BCA法(美国PIERCE公司,货号23227)测定裂解液蛋白浓度。而后对样本进行生物素标记。标记方案见表1。用激光扫描仪Axon GenePix 4000 B Microarray Scanner(美国MOLECULAR DEVICES)扫描信号,采用绿色通道扫描,扫描参数为PMT:650;Wavelength:532 nm;resolution:10 μm。并用仪器自带分析软件提取数据,采用AAM-BLG-1的分析软件进行数据预分析。
1.4 统计学处理
采用SPSS 17.0软件进行统计学分析,数据为测得的信号值,组间比较采用单样本t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 小鼠ADSCs和FBs的形态学特征
小鼠ADSCs培养 24 h后,Olympus倒置显微镜下可见大部分细胞已贴壁生长,呈成纤维细胞样,原代培养至3 d左右,细胞达80%~90%融合,此时进行传代培养。细胞传至P1代时,细胞形态呈长梭形或三极形,呈旋涡状生长(图1);
小鼠FBs培养24 h后,倒置显微镜下可见大部分细胞已贴壁,呈典型成纤维细胞样,原代培养至2 d左右,细胞达80%~90%融合,此时进行传代培养。细胞传至P1代时,细胞形态呈三极形,不呈旋涡状生长(图2)。
2.2 裂解液中的蛋白浓度
裂解液中蛋白浓度测定结果见表1。
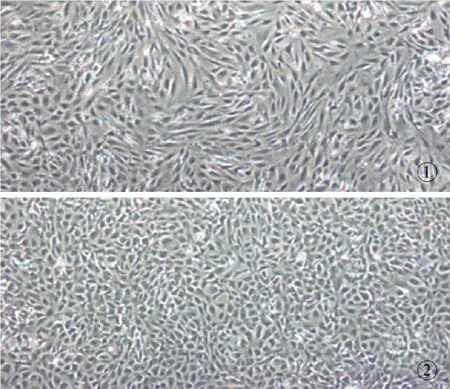
图1 ADSCs 形态(×40) 图2 FBs形态(×40)
Fig 1 Morphology of ADSCs of mice (×40). Fig 2 Morphology of FBs of mice (×40).
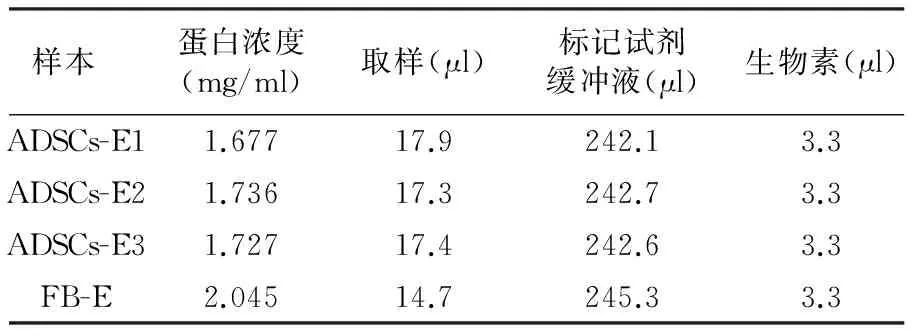
表1 生物素标记方案Tab 1 Biotin labeling scheme
2.3 仅ADSCs分泌的细胞因子/蛋白
FBs裂解液中信号值≤1的细胞因子共31种,包括HGF、P-Selectin、Growth Hormone R、Coagulation FactorⅢ/Tissue Factor、GDF-9、Frizzled-1、Eotaxin、Osteoporotegerin、IL-6 R、IL-3 R alpha、MMP-12、FGF R4、TGF-beta 2、MIP-3 alpha、Fit-3 Ligand、Osteopontin、IL-23、Activin RIB/ALK-4、IL-21 R、Frizzled-7、IL-13、TFPI、CXCR4、IGFBP-2、LEPTIN(OB)、PDGF C、TGF-beta RI/ALK-5、TRAIL R2/TNFRSF10B、VE-Cadherin、MIP-1 alpha、VCAM-1等细胞因子。
2.4 ADSCs分泌多于FBs的细胞因子
ADSCs分泌多于FBs的细胞因子共20种,包括MMP-24/MT5-MMP、TIMP-1、SLPI、Tie-2、IL-17F、B7-1/CD80、GDF-3、Endocan、S100A10、PF-4、CCL7/MCP-3/MARC、VEGF、Crossveinless-2、IL-21、LIGHT/TNFSF14、MMP-2、beta-Catenin、FGF-21、IL-4、SDF-1(P<0.05)。
3 讨论
ADSCs主要是通过分泌多种细胞因子发挥生物学效应,其可以分泌VEGF、IGF、HGF、TGF-β1等许多因子成分。这些细胞因子对加速创伤[3]和创面的再生、愈合等起到关键作用。具体机制包括加速成纤维细胞胶原合成、抗氧化、抗凋亡等生物学作用。许多学者证实ADSCs具有促进HDFs增殖、合成胶原蛋白、分泌多种细胞因子、协助血管再生、抗氧化等作用。笔者的前期实验也已经表明,ADSCs裂解液可以明显改变光老化的成纤维细胞的增殖能力及生物学功能的表达[4-6]。
但ADCSs中到底有哪些细胞因子成分参与了老化成纤维细胞的生物学作用调控,尤其是与成纤维细胞比较,两者分泌的细胞因子中,哪些成分是有明显的差异的。这些分泌水平有差异的蛋白因子即有可能是调控衰老成纤维细胞的最主要成分,基于这个推断,笔者对小鼠ADSCs裂解液进行了蛋白质组织学分析,通过确定差异蛋白,即有可能寻找出具有明显的生物学作用的蛋白因子成分。
蛋白芯片的检测结果显示,相比于FBs裂解液,ADSCs裂解液中含有更多的细胞因子,这与许多研究结果类似。其中,许多细胞因子仅在ADSCs裂解液中检测到,其中包括PDGF C、肝细胞生长因子(hepatocyte growth factor,HGF)等细胞因子。HGF是存在于急性肝损伤动物血浆中的蛋白因子,能刺激肝细胞DNA合成,且在肝再生过程中起重要作用。HGF不同于再生肝和胚胎肝细胞中的肝刺激物质,其对许多组织和细胞的生长、分化起重要调控作用[7];而PDGF-C 在成年小鼠中有3个转录子(大小分别为1.8、2.9和3.5 kb),是血小板源性生长因子家族中的一员,是成纤维细胞、平滑肌细胞以及其他间充质来源细胞的强有丝分裂原和化学驱动剂[10]。PDGF可促进皮下血管形成[8],修复皮下血液微循环系统;促进胶原蛋白的合成[9],延缓衰老;另外,其作为一种重要的有丝分裂原,可促进皮肤成纤维细胞的增殖,淡化皱纹。由此可以推测,这些ADCSs特异性的蛋白因子都有可能参与老化成纤维细胞的生物学作用。
而有一些细胞因子,如VEGF、FGF-21等在ADSCs裂解液中的含量显著高于FBs裂解液中含量。其中VEGF(即血管内皮生长因子)是最有效的促血管生长因子。而FGF-21(即成纤维细胞生长因子-21)是属于FGF基因家族中的一员,是一种重要的保护糖代谢稳态的细胞因子,具有胰岛素类似的作用[10];同时其也具有调节脂代谢,促进有丝分裂和导致组织增生的作用,但其是否对光老化成纤维细胞具有促进分裂的作用,尚需进一步研究证实。这些含量相对较高的因子对光老化FBs是否具有生物学作用,以及作用的途径和机制都有待于进一步明确。
总之,这些初步的实验结果证实了ADSCs裂解液中包含丰富的细胞因子,而且,某些特异性的因子对光老化成纤维细胞可能具有保护作用,今后的研究将聚焦于这些特异性因子,明确其作用机制和原理。
[1] Chae YB, Lee JS, Park HJ, et al. Advanced adipose-derived stem cell protein extracts with antioxidant activity modulates matrix metalloproteinases in human dermal fibroblasts[J]. Environ Toxicol Pharmacol, 2012,34(2):263-271.
[2] Park BS, Jang KA, Sung JH, et al. Adipose-derived stem cells and their secretory factors as a promising therapy for skin aging[J]. Dermatol Surg, 2008,34(10):1323-1326.
[3] Kim WS, Park BS, Sung JH, et al. Wound healing effect of adipose-derived stem cells: a critical role of secretory factors on human dermal fibroblasts[J]. J Dermatol Sci, 2007,48(1):15-24.
[4] 曾继平, 毕 波, 陈 亮, 等. 脂肪来源干细胞对光老化成纤维细胞的治疗作用[J]. 中国美容整形外科杂志, 2013,24(10):581-586.
[5] 杨清建, 刘天一, 毕 波. 光老化过程中皮肤成纤维细胞的生物学改变[J]. 中国美容整形外科杂志, 2014,25(8):480-483.
[6] 陈 亮, 刘天一, 毕 波, 等. 脂肪来源干细胞在光老化皮肤中的作用[J]. 中华整形外科杂志, 2014,30(4):317-320.
[7] Hui L, Hong Y, Jingjing Z, et al. HGF suppresses high glucose-mediated oxidative stress in mesangial cells by activation of PKG and inhibition of PKA[J]. Free Radic Biol Med, 2010,49(3):467-473.
[8] 林春霞, 惠汝太. PDGF家族新成员: PDGF-C和PDGF-D[J]. 中国分子心脏病学杂志, 2005,5(5):738-743.
[9] Lu J, Zhu Y, Feng W, et al. Platelet-derived growth factor mediates interleukin-13-induced collagen I production in mouse airway fibroblasts[J]. J Biosci, 2014,39(4):693-700.
[10] 尹彬彬, 王 蕾, 宋 莹, 等. FGF-21的研究进展[J]. 吉林医药学院学报, 2011,32(4):226-229.
Cytokines and proteomics analysis of mouse adipose-derived stem cells
YANGQing-jian,BIBo,CHENLiang,ZENGJi-ping,YANGPing,ZHOUYi-qun,GUOYu,ZHUJing-jing,ZHUNing-wen,LIUTian-yi.
(DepartmentofPlasticSurgery,HuadongHospitalAffiliatedtoFudanUniversity,Shanghai200040,China)
LIUTian-yi,Email:tianyiliucn@126.com
Objective To compare the difference of secretion cytokines between adipose-derived stem cells (ADSCs) and fibroblast cells (FBs). Methods ADSCs and FB cultured in vitro, then cytoplasm protein from ADSCs and FB were extracted. Expression level of cytokines was measured by protein chip. Differences between the two different cell extracts were analyzed by using software SPSS. Results Thirty-one kinds of cytokines secreted from ADSCs only, but none from FBs; 20 kinds of cytokines secreted from ADSCs were more than those from FBs. The contents of VEGF, FGF-21 in the ADSCs extracts were significantly more than those in the FBs extracts (P<0.05); HGF, PFGF-C were detected only in the ADSCs extracts. Conclusion The secretion of cytokines between the ADSCs and FBs were obviously different. Compared with FBs, the ADSCs were capable of secreting more kinds of cytokines.
Adipose-derived stem cells; Fibroblasts; Cytokines; Proteomics analysis; Mouse
国家自然科学基金(81272125;81301642);国家863计划(2014AA020705);上海市卫生系统优秀学科带头人培养计划(XBR2011033)
200040 上海,复旦大学附属华东医院 整形外科(杨清建,毕 波,陈 亮,曾继平,杨 平,周轶群,郭 妤,朱晶晶,刘天一);复旦大学附属华山医院 皮肤科(朱宁文)
杨清建(1987-),男,山东曹县人,硕士研究生.
刘天一,200040,复旦大学附属华东医院 整形外科,电子信箱:tianyiliucn@126.com
10.3969/j.issn.1673-7040.2016.02.005
R318
A
1673-7040(2016)02-0079-03
2015-11-24)

