PEG和NaCl胁迫对草木樨种子萌发和幼苗生长的影响
汪永平,骆凯,胡小文,马福成,田小飞,张宝林,塔拉腾,刘晓燕,张吉宇
(1.兰州大学草地农业科技学院,草地农业生态系统国家重点实验室,甘肃 兰州 730020;2.内蒙古阿拉善盟草原工作站,内蒙古 阿拉善 750306)
PEG和NaCl胁迫对草木樨种子萌发和幼苗生长的影响
汪永平1,骆凯1,胡小文1,马福成1,田小飞1,张宝林2,塔拉腾2,刘晓燕2,张吉宇1
(1.兰州大学草地农业科技学院,草地农业生态系统国家重点实验室,甘肃 兰州 730020;2.内蒙古阿拉善盟草原工作站,内蒙古 阿拉善 750306)
摘要:以筛选出的5份优异草木樨(Melilotus)种质PI595335、MO-LX04、PI595388、Ames19257和PI593234为材料,分别用不同渗透势的PEG(0、-0.3、-0.6、-0.9、-1.2、-1.5 MPa)及不同浓度的NaCl溶液(0、50、100、150、200、300 mmol·L-1)模拟干旱和盐碱胁迫条件,采用纸上发芽法进行种子萌发试验,测定发芽率、发芽势、胚根幼苗长、发芽指数、活力指数等指标,并综合比较不同种质的抗旱及耐盐能力。结果表明,1)高渗透势(≥-0.3 MPa)的条件能不同程度地促进5份种质的萌发,对PI595335、MO-LX04、PI595388胚根和幼苗的生长有一定抑制作用,对Ames19257、PI593234胚根和幼苗的生长有显著的(P<0.05)促进作用;而较低渗透势(≤-0.9 MPa)则显著抑制(P<0.05)所有种子的萌发与幼苗生长。2)不同浓度的NaCl溶液对5份种质草木樨幼苗的生长均有显著的(P<0.05)抑制作用,而低浓度的NaCl(≤100 mmol·L-1)溶液能促进草木樨种子的萌发。3)用模糊数学隶属法综合评价结果显示,5份草木樨种质在种子萌发期抗旱性强弱为Ames19257>PI593234>MO-LX04>PI595335>PI595388,耐盐性强弱为PI593234>Ames19257>PI595388>MO-LX04>PI595335。其中Ames19257和PI593234在抗旱性和耐盐模拟试验中的表现均明显优于其它3份草木樨种质,更适于为今后杂交创制新种质提供遗传材料或在西北干旱、盐碱地区种植。
关键词:草木樨;盐胁迫;水分胁迫;萌发;综合评价
中国西北干旱区系指35° N以北、106° E以西的内陆干旱区,包括新疆全境、甘肃河西走廊及内蒙古贺兰山以西的地区,土地面积约占中国总土地面积的24.5%,由于深居欧亚大陆腹地,平均降水量在160 mm以下,基本上不产生地表径流,是世界上最严酷的干旱区之一[1]。由于土地资源使用不当,每年都有大面积的耕地因人为活动而导致土壤次生盐渍化的发生,使中国可耕地面积进一步缩小,对中国农业增产保收造成严重障碍[2]。近年来,西北干旱区植被退化、物种濒危问题日趋严重,荒漠化治理、植被恢复以及植物保护已成为当地乃至国家生态建设的重要工作。种子萌发阶段和幼苗生长期是植物生长过程中最重要的两个阶段,决定着作物的生长以及产量[3]。在西北地区,种子的萌发常常受到降水、气候、土壤结构和理化性质[4]等环境因子的影响,导致牧草种子萌发困难、出苗不齐和幼苗抗性弱等一系列问题,使栽培草地难以成功建植。因此,研究植物种子萌发对环境因子特别是水分和盐碱等在西北地区常见限制因子的响应,对该地区的植被恢复、草业生产和引种驯化具有重要意义。
草木樨属(Melilotus)为豆科一年生或二年生草本植物[5],主要分布于欧洲、北非和中亚,在我国主要分布在西北、华北、东北,其中白花草木樨(M.alba)和黄花草木樨(M.officinalis)为该属最常见的栽培利用种。草木樨生命力强,具有抗旱、抗寒、耐贫瘠、耐盐碱、生长快等特点,其用途广泛,可当作防风固沙、保持水土、改善土壤肥力的生态草种植[6-7],也可用作绿肥和蜜源植物[8-9],草木樨的药用价值也越来越得到重视[10]。营养价值方面,草木樨干草含粗蛋白质12%~24%,无氮浸出物33%~42%,是一种优良的牧草[11]。
本研究从国内外引进草木樨种质资源101份评价的基础上,获得了5份适应性强、田间表现优良的草木樨种质为材料,以PEG和NaCl溶液模拟干旱、盐胁迫条件对草木樨种子萌发和幼苗生长的影响,比较不同种质的抗旱耐盐性,以期筛选更具有抗旱耐盐特性的草木樨种质,为后续进行杂交创制新种质提供遗传材料和理论依据,促进我国干旱半干旱地区和盐碱地饲草料的发展。
1材料与方法
1.1供试材料
试验材料为在甘肃榆中进行了引种适应性评价后筛选的5份农艺学性状表现优异的种质,分别为黄花草木樨种质PI595335、MO-LX04、PI595388,白花草木樨种质Ames19257、PI593234。
1.2试验方法
1.2.1种子的预处理选择成熟、饱满且大小适中、均匀一致、无病虫害健康的种子为试验材料。先用砂纸打磨种子以破除硬实,用0.1%的HgCl2溶液浸种10 min进行消毒,再用蒸馏水反复冲洗5~6次,滤纸吸干后保存于4 ℃冰箱备用。
1.2.2PEG处理采用纸上培养法[12],在培养皿种放入双层滤纸,每个培养皿里摆放50粒种子,3次重复。分别用水势为0(CK)、-0.3、-0.6、-0.9、-1.2、-1.5 MPa的PEG-6000溶液对草木樨种子进行处理,每个培养皿加6 mL相应水势的PEG-6000溶液,其中对照组用蒸馏水处理,并用封口膜封口。将培养皿置于20 ℃的培养箱中,设置光照16 h,黑暗8 h,每2 d按同样加液方法更换一次滤纸并添加新的处理液。
1.2.3NaCl处理分别用0(CK)、50、100、150、200、300 mmol·L-1的NaCl溶液对草木樨种子进行处理,每个培养皿加6 mL相应浓度的NaCl溶液,其中对照组用蒸馏水处理,并用封口膜封口。培养箱条件同PEG处理,每2 d按同样加液方法更换一次滤纸并添加新的处理液。
种子发芽期间,每日记录种子发芽数,根据国际种子检验规程[13],有明显的胚根“露白”即认定为发芽。持续记录14 d结束,并在试验结束时统计正常幼苗数、新鲜未发芽种子数、硬实种子数、死种子数。发芽试验结束时,每个培养皿随机选取10株幼苗植株,用直尺测定幼苗的根长和苗长。
1.3数据处理
相对发芽率=处理组发芽率/对照组发芽率×100%。
发芽势=n/N×100%,式中:n规定为4 d内的发芽种子总数,N为种子总数。
发芽指数(GI)=G1/N1+G2/N2+…+Gn/Nn,式中:G1、G2、…、Gn为第1、2、…、n天正常的幼苗数,N1、N2、…、Nn为相应的发芽天数。
活力指数(VI)=S×GI,式中:S为幼苗第14天的苗长。

试验结果均以平均值±标准误(SE)表示。使用SPSS 17.0统计软件,在95%水平上通过单因子方差(One-Way ANOVA)分析,对数据进行显著性检验。Duncan Post-hoc Test用于检验处理间多重比较的差异显著性(P<0.05)。
2结果与分析
2.1 PEG胁迫对草木樨种子萌发及幼苗生长的影响
2.1.1PEG胁迫对草木樨种子发芽能力的影响高渗透势(-0.3 MPa)对于Ames19257和PI593234这两份材料具有提高发芽势的效果,而对PI595335、MO-LX04和PI595388则产生了显著的抑制作用(P<0.05)(表1)。之后,随着胁迫的增加,5份材料种子的发芽势所受抑制作用均显著增大(P<0.05)。
5份种质在渗透势为-0.3 MPa时,发芽率相对对照均未表现出受抑制现象(表1)。在渗透势为-0.6 MPa的胁迫条件下,除Ames19257和PI593234外,种子萌发相比对照均受到抑制,发芽率显著(P<0.05)降低。之后随着胁迫的增加,发芽率急剧降低,当渗透势为-1.5 MPa时,所有材料皆未出现萌发现象。
对不同渗透势下种子发芽指数的分析可知,在不同渗透势的胁迫条件下,5份材料的种子发芽指数均受到了不同程度的抑制,且相对对照,抑制作用均显著(P<0.05)(表1)。随着胁迫的增加,抑制作用显著增强(P<0.05)。当渗透势为-1.5 MPa时,5份材料的种子发芽指数几乎都降低到0。
在渗透势为-0.3 MPa时,Ames19257和PI593234两份材料的种子活力指数相对对照显著增大(P<0.05),PI595335、MO-LX04和PI595388种子活力指数均相对对照显著降低(P<0.05)(表1)。当PEG溶液渗透势≤-0.6 MPa时,随着胁迫的增加,5份材料的种子活力指数均显著降低(P<0.05)。
2.1.2PEG胁迫对草木樨胚根与幼苗生长的影响相比对照,不同渗透势胁迫对PI595335、MO-LX04、PI595388种子胚根的生长起显著的抑制作用(P<0.05),且随着胁迫的增加抑制作用显著增大(P<0.05)(图1)。而Ames19257和PI593234在较高水平PEG胁迫下(渗透势-0.3、-0.6 MPa),胚根的生长相比对照反而被显著促进(P<0.05),之后随着胁迫的增大,胚根生长均受到显著抑制(P<0.05)。不同渗透势胁迫对PI595335、MO-LX04、PI595388的幼苗生长均有不同程度的抑制,在较高渗透势下(-0.3 MPa)PI595388幼苗生长受抑制作用最强,相比对照达到了显著水平(P<0.05),随着胁迫的增加,3份材料幼苗生长所受抑制均显著增强(P<0.05),当渗透势<-0.9 MPa,几乎无幼苗生长。而Ames19257和PI593234在较高水平胁迫下(渗透势≥-0.6 MPa),幼苗的生长相比对照被显著促进(P<0.05),之后随着胁迫的增加幼苗长显著降低(P<0.05)。
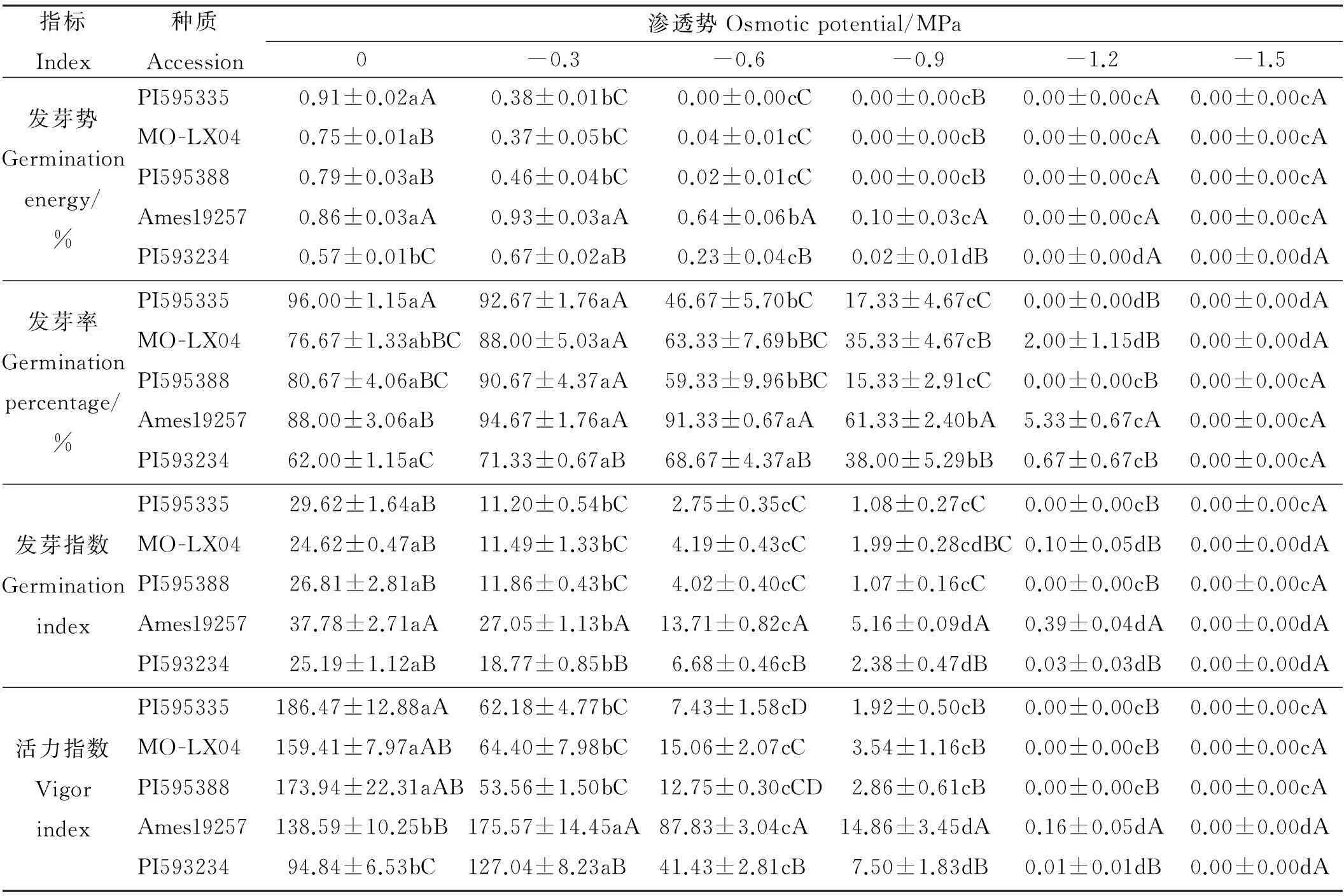
表1 不同渗透势下5种草木樨种质的发芽势、发芽率、发芽指数、活力指数
注:数据按平均值±标准误表示,同行不同小写字母表示处理间差异显著(P<0.05),同列不同大写字母表示种质间差异显著(P<0.05)。下同。
Note: Data are present as mean±SE, different lower case letters within the same row show significant difference among stress treatments at 0.05 level, and different capital letters within the same column show significant difference among different accessions at 0.05 level. The same below.

图1 不同渗透势下不同草木樨种质胚根及幼苗长的比较
注:同一指标不同小写字母表示不同种质在不同处理间差异显著(P<0.05)。下同。
Note: Different lower case letters for the same parameter mean significant difference among different species in different treatments at 0.05 level. The same below.
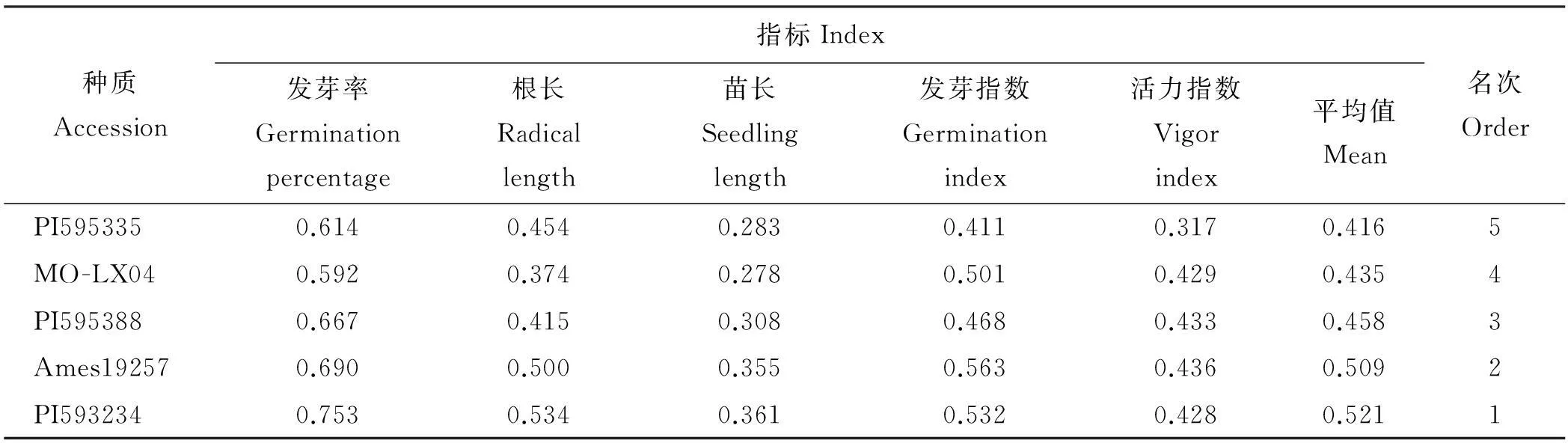
2.1.3不同草木樨种质耐水分胁迫综合评价用模糊函数隶属法对5个不同草木樨种质的发芽率、根长、苗长、发芽指数和活力指数进行了综合评价,得到5个不同种质草木樨的隶属值函数平均值,可知,耐水分胁迫能力大小为Ames19257>PI593234>MO-LX04>PI595335>PI595388(表2)。
2.2NaCl胁迫对草木樨种子萌发及幼苗生长的影响
2.2.1NaCl胁迫对草木樨种子发芽能力的影响对不同浓度NaCl胁迫下种子发芽势的分析可知(表3),在NaCl浓度≥200 mmol·L-1时,5份材料的发芽势均较对照显著降低(P<0.05),表现出明显的胁迫效应。在NaCl浓度50~150mmol·L-1时,Ames19257和PI593234发芽势所受影响不大,表现出较强的抗盐能力。而PI595335和MO-LX04在低浓度NaCl(50 mmol·L-1)时其发芽势就较对照显著降低(P<0.05),受盐胁迫影响最大。
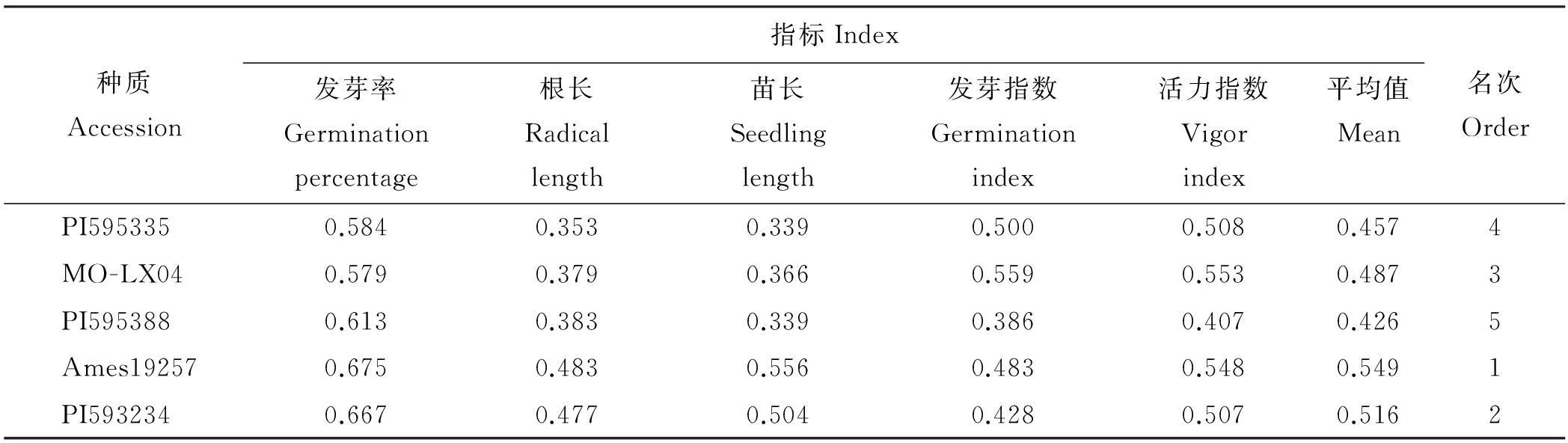
表2 不同草木樨种质耐水分胁迫指标隶属值及其综合评价
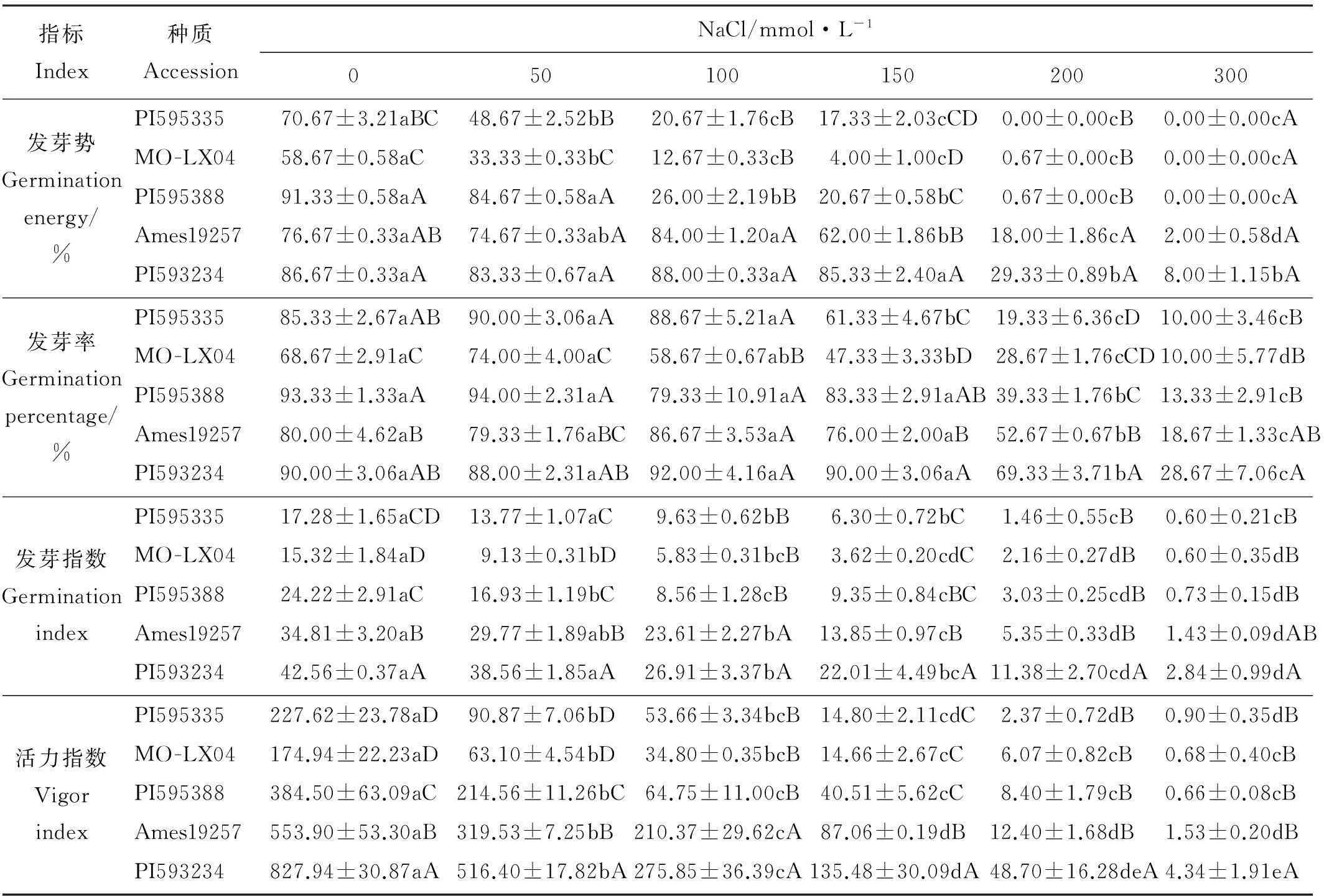
表3 不同浓度NaCl下5种草木樨种质的发芽率、发芽势、发芽指数、活力指数
对不同浓度NaCl胁迫对种子发芽率影响的分析可知(表3),较低浓度NaCl溶液(50和100 mmol·L-1)对5份材料种子的发芽率无显著影响(P>0.05)。当NaCl溶液浓度为150 mmol·L-1时,PI595335和MO-LX04种子发芽率较对照显著降低(P<0.05)。当NaCl浓度≥200 mmol·L-1时,随着胁迫的增加,5份材料种子发芽率均显著低于对照(P<0.05)。
对不同浓度NaCl胁迫下种子发芽指数的分析可知(表3),在NaCl溶液浓度为50 mmol·L-1时,MO-LX04和PI595388种子发芽指数较对照显著降低(P<0.05)。随着盐胁迫的增加,5份种质种子发芽指数进一步降低。
对不同浓度NaCl胁迫下种子活力指数的分析可知(表3),在不同浓度NaCl胁迫下,5份材料的种子活力指数均受到显著的抑制作用(P<0.05),随着NaCl胁迫的增加抑制作用增强。当NaCl浓度增大到300 mmol·L-1后,5份材料种子的活力指数均趋于0。
2.2.2NaCl胁迫对草木樨胚根与幼苗生长的影响对不同浓度NaCl胁迫对草木樨胚根生长影响的分析可知(图2),不同浓度NaCl胁迫对5份材料种子的胚根的生长均起到了不同程度的抑制作用,且相对对照均影响显著(P<0.05)。随着NaCl胁迫的增加,抑制作用增强。5份种质中,NaCl胁迫对PI595388、Ames19257和PI593234种质影响最大。
分析不同浓度NaCl胁迫对草木樨幼苗生长的影响可知(图2),不同浓度NaCl胁迫对5份材料幼苗生长的影响与对胚根生长的影响相同,相比对照其幼苗生长所受抑制影响均达到显著水平(P<0.05)。并且随着NaCl胁迫的增加,幼苗生长所受抑制作用逐渐增强。其中PI595388、Ames19257和PI593234的幼苗生长随胁迫程度逐渐增加表现最为敏感,相比较低浓度受到显著抑制作用(P<0.05)。
2.2.3不同种质草木樨耐盐胁迫综合评价用模糊函数隶属法对5个不同种质草木樨的发芽率、根长、苗长、发芽指数和活力指数进行了综合评价,得到5个不同种质草木樨的隶属值函数平均值(表4),可知,耐盐胁迫能力大小为PI593234>Ames19257>PI595388>MO-LX04>PI595335。
3讨论
已有研究表明,将植物种子在一定渗透势的PEG-6000溶液中浸泡一段时间后其种子发芽率、发芽势可提高[17],这与本研究中发现的结果基本相一致,在高渗透势条件下(-0.3 MPa左右),相对发芽率除PI595335无明显变化外,其它4份种质相对发芽率均明显提高。水分胁迫继续增大时,对草木樨种子的萌发具有明显的抑制作用,表现在降低种子的萌发率和发芽势等,这与已报道的许多研究结果一致,可能是因为不同渗透势的PEG-6000在种子萌发过程中已经通过种子组织控制了吸水率[14],使植物组织和细胞处于类似干旱的水分胁迫中[18-20],因此,影响了种子的发芽过程,最终影响了种子的发芽率。史锋厚等[21]在PEG引发白羊草(Bothriochloaischaemum)种子发芽的研究中认为,PEG处理的根本效果在影响种子萌发方面,对幼苗生长的影响是在影响种子萌发的基础上实现的。
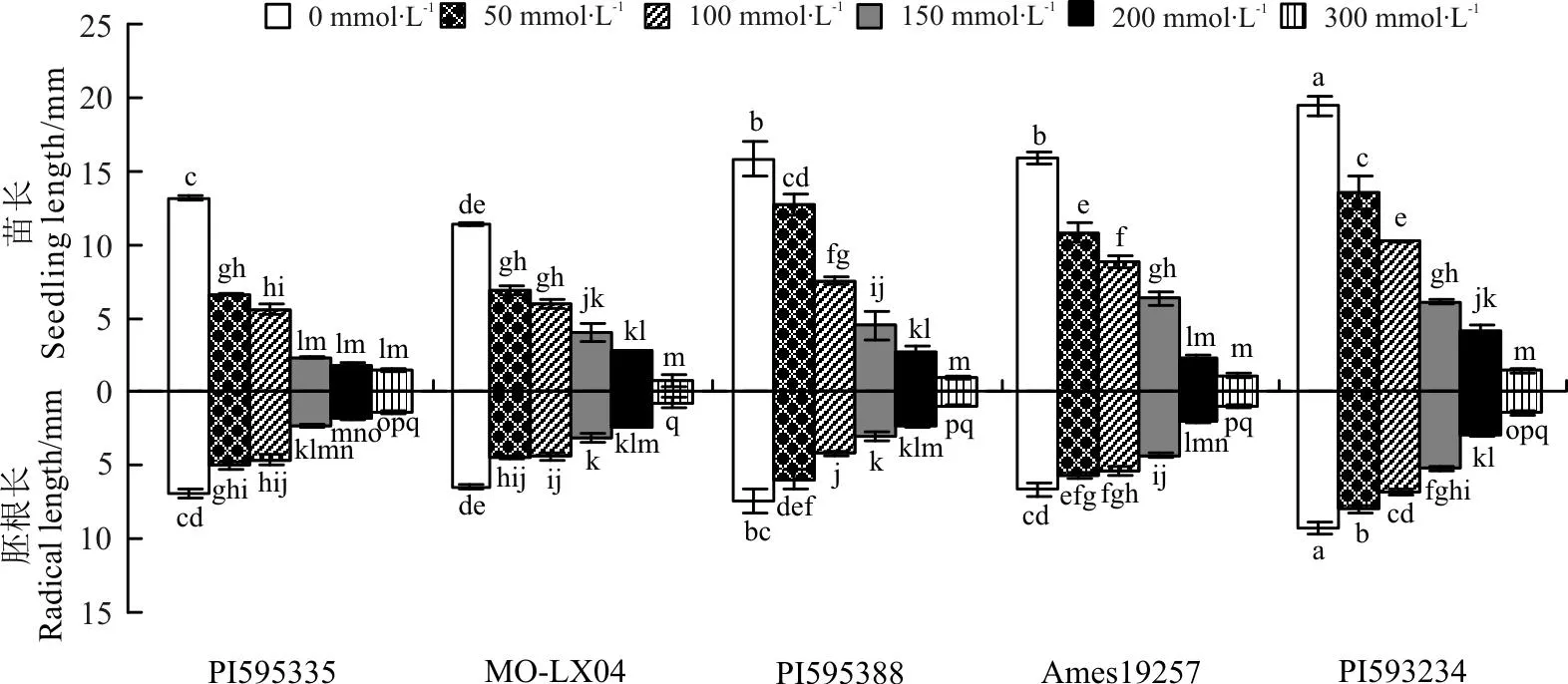
图2 不同NaCl浓度下不同种质胚根及幼苗长的比较
种质Accession指标Index发芽率Germinationpercentage根长Radicallength苗长Seedlinglength发芽指数Germinationindex活力指数Vigorindex平均值Mean名次OrderPI5953350.6140.4540.2830.4110.3170.4165MO-LX040.5920.3740.2780.5010.4290.4354PI5953880.6670.4150.3080.4680.4330.4583Ames192570.6900.5000.3550.5630.4360.5092PI5932340.7530.5340.3610.5320.4280.5211
盐胁迫与干旱胁迫既相似又存在差异,盐胁迫主要影响细胞内的离子平衡[22]和水分平衡。一般情况下,盐生植物其发芽率和发芽势在无盐和较低盐分条件下较高,高盐分条件下种子的萌发会受到抑制[23-25]。本研究发现,随着NaCl浓度的增加,5份材料的种子发芽率、发芽势、发芽指数、活力指数、胚根长及幼苗长均不同程度地受到抑制,这与在钠盐胁迫对白花草木樨[26]种子发芽的研究结果相一致。高盐抑制种子萌发是由于渗透效应和毒性效应[27],同时高浓度的NaCl破坏了材料种子细胞膜的结构与功能也可能是影响种子萌发的原因之一。
种子萌发受种子自身因素影响很大,单一指标不能充分说明种子耐盐性的综合情况,本研究采用发芽率、发芽势、发芽指数、活力指数、胚根长、幼苗长等多个指标进行分析并通过各抗旱及耐盐指标的隶属值进行综合评价,目的就是排除种子自身因素的干扰,准确评价出种子抗旱及耐盐能力大小[18,28-29]。抗旱及耐盐性是受多种因素影响的复杂数量性状,在萌发期鉴定出的具有较强抗性的种质是否在苗期乃至整个生育期也具有较强的抗性,其相关程度还有待进行苗期和全生育期的进一步研究[30-31]。
对供试草木樨种质用PEG和NaCl处理的综合结果显示,草木樨属植物确实具有一定的抗旱和耐盐能力。5份种质草木樨在种子萌发期抗旱性强弱为Ames19257>PI593234>MO-LX04>PI595335>PI595388,耐盐性强弱为PI593234>Ames19257>PI595388>MO-LX04>PI595335,其中Ames19257和PI593234在抗旱性和耐盐模拟研究中的表现均明显优于其它3份草木樨种质,更适于为今后杂交创制新种质提供遗传材料或在西北干旱、盐碱地区种植。
参考文献References:
[1]王根绪,程国栋,徐中民.中国西北干旱区水资源利用及其生态环境问题.自然资源学报,1999,14(2):109-116.
Wang G X,Cheng G D,Xu Z M.The utilization of water resource and its influence on eco-environment in the northwest arid area of China.Journal of Natural Resources,1999,14(2):109-116.(in Chinese)
[2]顾文婷,金文全,杨陶丽薇,刘瑞媛,李文建,董喜存.中国西北干旱地区盐渍化土壤盐分和养分的分布特征.中国农学通报,2015,31(9):212-215.
Gu W T,Jin W Q,Yang-Tao L W,Liu R Y,Li W J,Dong X C.Distribution characteristics of soil nutrients and salt content of northwest arid region in China.Chinese Agricultural Science Bulletin,2015,31(9):212-215.(in Chinese)
[3]Xu X Y,Fan R,Zheng R,Li C M,Yu D Y.Proteomic analysis of seed germination under salt stress in soybeans.Journal of Zhejiang University-Science B:Biomedicine & Biotechnology,2011,12(7):507-517.
[4]黄文达,王彦荣,胡小文.三种荒漠植物种子萌发的水热响应.草业学报,2009,18(3):171-177.
Huang W D,Wang Y R,Hu X W.Germination response of three desert plants to temperature and water potential.Acta Prataculturae Sinica,2009,18(3):171-177.(in Chinese)
[5]刘家宜.天津植物志.天津:天津科技出版社,2004:53.
[6]张保烈,文荣威.草木樨.北京:农业出版社,1989:1-7.
[7]狄红艳,骆凯,张吉宇,段珍,霍雅馨,王彦荣.基于ITS和trnL-trnF序列的草木樨种群遗传多样性研究.西北植物学报,2014,34(2):01-06.
Di H Y,Luo K,Zhang J Y,Duan Z,Huo Y X,Wang Y R.Genetic diversity analysis ofMelilotuspopulations based on ITS and trnL-trnF sequences.Acta Botanica Boreali-Occidentalia Sinica,2014,34(2):01-06.(in Chinese)
[8]Di H Y,Duan Z,Luo K,Zhang D Y,Wu F,Zhang J Y,Liu W X,Wang Y R.Interspecific phylogenic relationships within genusMelilotusbased on nuclear and chloroplast DNA.Plos One,2015,DOL:10.1371/journal.pone.0132596.
[9]丛建民,陈凤清,孙春玲.草木樨综合开发研究.安徽农业科学,2012,40(5):2962-2963.
Cong J M,Chen F Q,Sun C L.Study on comprehensive development ofMelilotussuaverolensL.Journal of Anhui Agricultural Sciences,2012,40(5):2962-2963.(in Chinese)
[10]Martino E,Ramaiola I,Urbano M,Bracco F,Collina S.Microwave-assisted extraction of coumarin and related compounds fromMelilotusofficinalis(L.) Pallas as an alternative to Soxhlet and ultrasound-assisted extraction.Journal of Chromatography A,2006,1125:147-151.
[11]马丽.浅谈草木樨的综合利用.新疆畜牧业,2005(4):56-57.
[12]王彦荣.GB/T 2930.1-2001 牧草种子检验规程.北京:中国标准出版社,2001.
Wang Y R.GB/T 2930.1-2001 Rules for Forage Seed Testing.Beijing:China Agriculture Press,2001.(in Chinese)
[13]国际种子检验协会.国际种子检验规程.北京:中国农业出版社,1996.
International Seed Testing Association.Rules for International Seed Testing.Beijing:China Agriculture Press,1996.(in Chinese)
[14]何学青,呼天明,许岳飞,冯雪,方燕利,龙明秀.PEG-6000模拟水分胁迫对柳枝稷种子萌发及幼苗生长的影响.草地学报,2014,22(3):556-563.
He X Q,Hu T M,Xu Y F,Feng X,Fang Y L,Long M X.Effect of water stress induced by polyethlenegly-6000 the seed germination and seedling growth of switchgrass.Acta Agrestia Sinica,2014,22(3):556-563.(in Chinese)
[15]孙景宽,张文辉,张洁明,刘宝玉,刘新成.种子萌发期4种植物对干旱胁迫的响应及其抗旱性评价研究.西北植物学报,2006,26(9):1811-1818.
Sun J K,Zhang W H,Zhang J M,Liu B Y,Liu X C.Response to droughty stresses and drought-resistances evaluation of four species during seed germination.Acta Botanica Boreali-Occidentalia Sinica,2006,26(9):1811-1818.(in Chinese)
[16]穆怀彬,伏兵哲,德英.PEG-6000胁迫下10个苜蓿品种幼苗期抗旱性比较.草业科学,2011,28(10):1809-1814.
Mu H B,Fu B Z,De Y.Drought tolerance of alfalfa seedling of 10 varieties under PEG-6000 stress.Pratacultural Science,2011,28(10):1809-1814.(in Chinese)
[17]史威威,董宽虎,侯志斌.PEG-6000引发对白羊草种子发芽的影响.草原与草坪,2007(6):26-28.
Shi W W,Dong K H,Hou Z B.Effect of PEG-6000 solution priming on germination ofBothriochloaischaemumseeds.Grassland and Turf,2007(6):26-28.(in Chinese)
[18]李自超,刘文欣,赵笃乐.PEG胁迫下水、陆稻幼苗生长势比较研究.中国农业大学学报,2001,6(3):16-20.
Li Z C,Liu W X,Zhao D L.Comparison of growing tendency during young seedling between paddy rice and upland rice under PEG water-stress.Journal of China Agricultural University,2001,6(3):16-20.(in Chinese)
[19]于军,焦培培.聚乙二醇(PEG-6000)模拟干旱胁迫抑制矮沙冬青种子的萌发.基因组学与生物应用学,2010,29(2):355-360.
Yu J,Jiao P P.Inhibition of seed germination ofAmmmopiptanthusnanus(M.Pop) Cheng f. under simulated drought stress with polyethylene glycol (PEG-6000).Genomics and Applied Biology,2010,29(2):355-360.(in Chinese)
[20]张立军,樊金娟,阮燕晔,关义新.聚乙二醇在植物渗透胁迫生理研究中的应用.植物生理学通讯,2004,40(3):361-364.
Zhang L J,Fan J J,Ruan Y Y,Guan Y X.Application of polyethylene glycol in the study of plant osmotic stress physiology.Plant Physiology Communications,2004,40(3):361-364.(in Chinese)
[21]史锋厚,朱灿灿,沈永宝,施季森.PEG-6000渗透处理对油松种子发芽的影响.浙江林学院学报,2008,25(3):289-292.
Shi F H,Zhu C C,Shen Y B,Shi J S.Germination ofPinustabulaeformisseeds with PEG-6000 osmotic treatments.Journal of Zhejiang A & F University,2008,25(3):289-292.(in Chinese)
[22]Munns R,Tester M.Mechanisms of salinity tolerance.Annual Review of Plant Biology,2008,59:651-681.
[23]王志才,牙库甫江·阿西木,王艳,张富春.水盐胁迫对花花柴种子萌发的影响.中国沙漠,2012,32(3):750-755.
Wang Z C,Yakupujiang·Aximu,Wang Y,Zhang F C.Effects of salt and water stress on seed germination ofKariliniacaspica.Journal of Desert Research,2012,32(3):750-755.(in Chinese)
[24]鱼小军,王彦荣,曾彦军,苏德.温度和水分对无芒隐子草和条叶车前种子萌发的影响.生态学报,2004,24(5):883-887.
Yu X J,Wang Y R,Zeng Y J,Su D.Effects of temperature and osmotic potential on seed germination ofCleistogenessongoricaandPlantagolessingii.Acta Ecologica Sinica,2004,24(5):883-887.(in Chinese)
[25]Keiffer C W,Ungar I A.Germination responses of halophyte seeds exposed to prolonged hypersaline conditions.In:Khan M A,Ungar I A.(eds).Biology of Salt Tolerant Plants.Karachi,Pakistan:Department of Botany,University of Karachi,1995:43-50.
[26]张颖超,贾玉山,任永霞.钠盐胁迫对白花草木樨种子发芽的影响.草业科学,2013,30(12):2006-2010.
Zhang Y C,Jia Y S,Ren Y X.Effects of different sodium salt stress on seed germination of sweet clover.Pratacultural Science,2013,30(12):2006-2010.(in Chinese)
[27]卢艳敏.不同盐胁迫对高羊茅种子萌发的影响.草业科学,2012,29(7):1088-1093.
Lu Y M.Effect of different saline stress on seed germination of tall fescue.Pratacultural Science,2012,29(7):1088-1093.(in Chinese)
[28]刘贵河,郭郁频,任永霞,曹春梅.PEG胁迫下5种牧草饲料作物种子萌发期的抗旱性研究.种子,2013,32(11):15-19.
Liu G H,Guo Y P,Ren Y X,Cao C M.Study on drought resistance of five kinds forage and crops during seed germination period under PEG stress.Seed,2013,32(11):15-19.(in Chinese)
[29]张一弓,王玉,刘梦,杨淑君,张荟荟.碱胁迫下硅促进冰草种子萌发.草业科学,2015,32(7):1093-1098.
Zhang Y G,Wang Y,Liu M,Yang S J,Zhang H H.Effect of silicon onAgropyroncristatumseed germination under alkaline stress.Pratacultural Science,2015,32(7):1093-1098.(in Chinese)
[30]马彦军,曹致中,李毅.八种胡枝子属植物种子萌发期抗旱性的比较.甘肃农业大学学报,2009,44(5):124-128.
Ma Y J,Cao Z Z,Li Y.Comparative study on the drought resistance 8 species ofLespedezain seed germination period.Journal of Gansu Agricultural University,2009,44(5):124-128.(in Chinese)
[31]周璐璐,伏兵哲,许冬梅,陈莉萍,吴小娟,高雪芹.盐胁迫对沙芦草萌发特性影响及耐盐性评价.草业科学,2015,32(8):1252-1259.
Zhou L L,Fu B Z,Xu D M,Chen L P,Wu X J,Gao X Q.Effects of salt stress on germination characteristics ofAgropyronmongolicumand salt-tolerance evaluation.Pratacultural Science,2015,32(8):1252-1259.(in Chinese)
(责任编辑武艳培)
Effects of PEG and NaCl stress on seed germination,seedling growth ofMelilotusaccession
Wang Yong-ping1, Luo Kai1, Hu Xiao-wen1, Ma Fu-cheng1, Tian Xiao-fei1,Zhang Bao-lin2, Talateng2, Liu Xiao-yan2, Zhang Ji-yu1
(College of Pastoral Agriculture Science and Technology, Lanzhou University; State Key Laboratory of Grassland Agro-ecosystems, Lanzhou 730020, China; 2.The Grassland Research Station of Alashan, Alashan 750306, China)
Abstract:In this study, five high performing Melilotus accessions were evaluated seed germination and seedling growth under different PEG and NaCl treatment, by determination germination percentage, germination energy, the radicle and seedling length, germination index, vigor index. The analysis of Fuzzy Mathematics Based Comprehensive Evaluation method is used to investigate drought and salt tolerance differences among accessions. The results shows that: 1) High osmotic potential (≥-0.3 MPa) significantly(P<0.05)increased seed germination in all accessions compared to the control. In addition, the radicle and seedling growth of PI595335, MO-LX04, PI595388 was significantly reduced but significantly(P<0.05) increased for Ames19257 and PI593234 at high osmotic potential (≥- 0.3 MPa). At low osmotic potential(≤-0.9 MPa), all seeds germination and seedling growth were significantly(P<0.05)reduced. 2) Seedling growth was significantly influenced under different levels of NaCl treatment on all accessions. Seed germination was significantly(P<0.05)increased at low concertation of NaCl(≤100 mmol·L-1). 3) The analysis using Fuzzy Mathematics Based Comprehensive Evaluation showed that: the drought tolerance of five Melilotus accessions in seed germination period as follows: Ames19257>PI593234>MO-LX04>PI595335>PI595388, salt resistance is PI593234>Ames19257>PI595388>MO-LX04>PI595335. The performance of Ames19257 and PI593234 were significantly better than the other three Melilotus accessions in the drought and salt tolerance test, and therefore they are good genetic materials for the future breedingprograms in the northwest of China.
Key words:Melilotus; salt tolerance; drought tolerance; germination; comprehensive evaluation
DOI:10.11829/j.issn.1001-0629.2015-0534
*收稿日期:2015-09-28 接受日期:2016-03-11
基金项目:科技部“973”课题(2014CB138704);公益性行业科研专项(20120304205);国家自然科学基金(31572453)
通信作者:张吉宇(1977-),男,甘肃民乐人,副教授,博士,主要从事牧草育种与分子生物学研究。E-mail:zhangjy@lzu.edu.cn
中图分类号:S541+.903.4;Q945.78
文献标志码:A
文章编号:1001-0629(2016)6-1174-09*
Corresponding author::Zhang Ji-yu E-mail:zhangjy@lzu.edu.cn
汪永平,骆凯,胡小文,马福成,田小飞,张宝林,塔拉腾,刘晓燕,张吉宇.PEG和NaCl胁迫对草木樨种子萌发和幼苗生长的影响.草业科学,2016,33(6):1174-1182.
Wang Y P,Luo K,Hu X W,Ma F C,Tian X F,Zhang B L,Talateng,Liu X Y,Zhang J Y.Effects of PEG and NaCl stress on seed germination,seedling growth ofMelilotusaccession.Pratacultural Science,2016,33(6):1174-1182.
第一作者:汪永平(1994-),男,甘肃通渭人,在读本科生。E-mail:ypwang12@lzu.edu.cn

