均相自发泡法制备抗菌多孔复合骨修复支架*
李 根,李丽梅,蒋佳兴,李炯炯,左 奕,李玉宝,邹 琴,张 利,李吉东
(四川大学 分析测试中心,成都 610064)
均相自发泡法制备抗菌多孔复合骨修复支架*
李根,李丽梅,蒋佳兴,李炯炯,左奕,李玉宝,邹琴,张利,李吉东
(四川大学 分析测试中心,成都 610064)
摘要:与植入骨修复材料相关的感染仍是临床面临的难题,能控释或缓释抗菌剂的骨修复材料在易感染骨缺损修复领域越来越受到青睐。在具有良好生物相容性和成骨作用的纳米羟基磷灰石/聚氨酯(nHA/PU)复合材料中添加磷酸银作为抗菌剂,复合磷酸氢钙结晶水合物(DCPD)作为发泡剂水的来源,通过释放DCPD中结晶水与PU中异氰酸根反应产生CO2气体实现了复合材料均相发泡成型。实验结果显示,85 ℃条件下自发泡制备的载磷酸银羟基磷灰石/磷酸氢钙/聚氨酯(Ag3PO4-nHA/DCPD/PU)复合支架的孔隙率高达80%,抗压强度可达2.83MPa;制备的抗菌支架能有效抑制细菌在材料表面黏附,与细菌接触24h后抑菌率可达95.45%。该方法简便易行,制备的孔隙分布均匀、贯通性好、孔隙率高和力学性能佳的抗菌复合支架在骨修复领域有较大的应用潜力。
关键词:抗菌;聚氨酯;纳米羟基磷灰石;磷酸银;自发泡
0引言
临床发现骨修复材料植入机体后,细菌易在植入材料表面定植,常会导致与植入材料相关的细菌感染,影响材料周围细胞和组织与材料间的良性交互作用,甚至造成骨质流失,导致骨修复失败。一旦感染发生,患者即使口服或注射大剂量抗生素也难以起到有效治疗作用,而且抗生素的滥用正在不断增长细菌耐药性。因此,研制自身具有抗菌、抗感染性能的骨修复材料已成为生物材料领域研究热点之一[1-3]。
研究人员尝试在骨修复材料中加入抗菌成分,如银及其化合物、二氧化钛、壳聚糖、季铵盐、抗生素等[4-9],赋予材料抗菌性能。二氧化钛(TiO2)是光催化型抗菌剂,在植入材料领域难以发会作用;季铵盐存在化学稳定性差、易产生抗药性、有溶血作用、对革兰氏阴性菌(如:大肠杆菌)抑制作用弱等缺点;壳聚糖耐热性差、加工困难、药效持久性差。载抗生素类骨修复材料植入体内虽在局部能发挥较好的抗菌作用,但随着抗生素逐渐释放,后期残留在材料中的抗生素无法达到有效杀菌浓度,进而易诱导细菌产生耐药性;同时载抗生素类材料存在药物突释,以及不同生理环境下药效变低等缺点。银系抗菌剂具有抗菌谱广、不易产生耐药性等优势,已在抗菌骨修复材料领域引起广泛关注[4,10-11]。硝酸银中银离子释放过快,作为抗菌剂难以满足持续、长效抗菌需求;磷酸银微溶于水,在有水存在的环境中可缓慢释放出高抗菌活性的银离子,起到抗菌作用。课题组前期在可注射聚氨酯中添加磷酸银制备了抗菌根管充填材料,研究表明,当复合材料中的磷酸银添加量为3%(质量分数)时,制备的根管充填材料兼具强抗菌性能和良好的生物相容性[12]。
聚氨酯由软硬段构成的嵌段聚合物,可根据需求选择不同软硬段或调整软硬段比例即可获得不同理化性能和降解性能,因其良好的生物相容性、力学性能和性能可调控等优点已在骨组织工程领域广泛研究[13-15]。纳米羟基磷灰石/聚氨酯(nHA/PU)多孔骨修复支架材料已显示出优良的生物相容性和成骨作用[16-17]。因合成聚氨酯原料中存在的异氰酸根可与水反应生成CO2,制备聚氨酯类多孔支架常用水作为发泡剂[17-18]。尽管水安全无毒,但随着反应进行,复合材料体系粘度逐渐增大,后期加入的发泡剂水很难均匀分散其中,从而影响支架孔隙结构均匀性和孔隙连通性。在复合材料合成过程中将发泡剂水以磷酸钙盐结晶水的形式均匀复合在聚氨酯复合材料中,在高于结晶水释放温度条件下,释放结晶水与PU中的异氰酸根反应生成CO2,可实现复合材料均相发泡,制得孔隙均匀、贯通性好、力学性能佳的磷酸钙盐/聚氨酯复合多孔骨修复支架。
基于临床需求和前期的研究基础,本研究在nHA/PU材料中复合磷酸银作为抗菌剂,复合磷酸氢钙结晶水合物(DCPD)作为发泡剂,在一定条件下使DCPD释放结晶水,实现聚氨酯基复合材料均相发泡,制备孔隙率高、孔隙均匀、贯通性好的抗菌复合骨修复支架,并对支架的理化性能和抗菌性能进行表征。
1实验部分
1.1试剂与原料
蓖麻油(CO)、1,4-丁二醇(BDO)、辛酸亚锡购自成都市科龙化工试剂厂,异佛尔酮二异氰酸酯(IPDI)、甘油(GL)购自上海晶纯生化科技股份有限公司,DCPD购自天津市光复精细化工研究所,均为分析纯,Ag3PO4购自百灵威科技有限公司,nHA按文献方法由本实验室自制[18]。
1.2多孔支架的制备
首先参考文献方法[18]制备nHA/DCPD/PU复合材料,然后在大于75 ℃温度条件下使DCPD释放结晶水与聚氨酯预聚体中的异氰酸根反应生成CO2,实现复合材料均相自发泡成型,其中无机填料约占30%(质量分数)。即在氮气保护下,取15g甘油改性的蓖麻油(GCO)加入三颈瓶中,70 ℃油浴加热并保持一定强度的机械搅拌0.5h,加入6.5gDCPD固体粉末(过300目筛)、6.5gnHA粉末,使其与改性的蓖麻油充分混合。逐渐滴加15gIPDI(蓖麻油与IPDI的摩尔比为1∶1.5),反应得到nHA/DCPD/PU复合材料预聚物。然后加入0.05mL催化剂辛酸亚锡,反应约0.5h,再加入0.5mLBDO作为扩链剂,继续反应约2h,在90 ℃熟化发泡24h,洗涤、烘干得到nHA/DCPD/PU复合多孔支架。Ag3PO4-nHA/DCPD/PU的制备方法同上,无机填料占30%(质量分数),包括5.85gnHA、5.85gDCPD和1.3gAg3PO4粉末;发泡温度为85 ℃。所制备的复合支架的编号及成分如表1所示。
表1复合支架的编号及成分
Table1Theabbreviationandcompositionoffabricatedcompositescaffolds
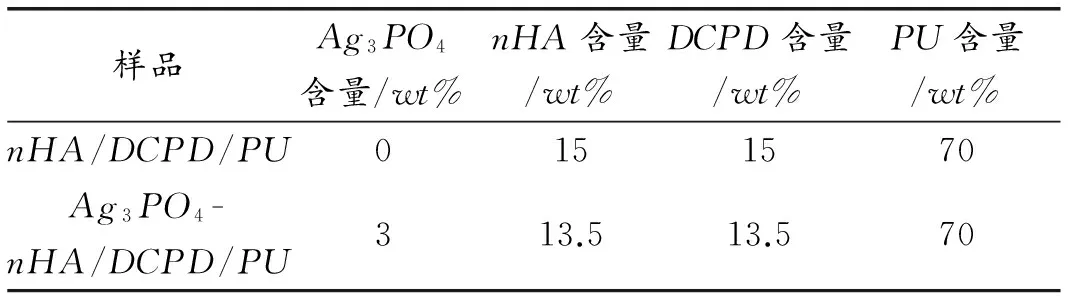
样品Ag3PO4含量/wt%nHA含量/wt%DCPD含量/wt%PU含量/wt%nHA/DCPD/PU0151570Ag3PO4-nHA/DCPD/PU313.513.570
1.3表征方法
采用扫描电子显微镜(SEM,JSM-6500LV,Jeol,Japan)观察多孔支架的形貌结构;使用能谱仪(EDS)分析Ag3PO4-nHA/DCPD/PU支架表面钙、磷和银元素分布,扫描时间为60s;利用X射线衍射仪(XRD,DX-2000,中国丹东方圆公司)分析复合材料中无机物晶相;利用傅里叶变换红外光谱仪(FTIR,Nicolet6700,USA)分析材料中官能团的位置和强度变化;采用AG-IC50型(SHIMADZU,Japan)力学试验机,依据国标GB/T1 041-92测试支架的抗压强度和弹性模量,试验的压头速度为0.5mm/min。
1.4孔隙率测定
采用水浸渍法测定孔隙率:干燥待测样品,测量体积为V,称重(W1);然后浸入去离子水(密度ρ)中直至充盈浸透,取湿样称重(W2),由下述公式(1)计算孔隙率P。
(1)
1.5抗细菌粘附实验
选用金黄色葡萄球菌(S.aureus,ATCC25923)评价支架的抗菌性能。将nHA/DCPD/PU、Ag3PO4-nHA/DCPD/PU支架(Ø6mm×2mm)用环氧乙烷灭菌,浸入2mL浓度约106CFU/mL的菌悬液中,于(37±1) ℃ 培养箱中培养24h。取出样品用磷酸盐缓冲液(PBS)冲洗,经固定、梯度脱水、临界点干燥、喷金等处理后用SEM观察细菌在不同材料表面的粘附情况。
1.6抑菌率实验
分别依次向6支试管中加入200μL浓度为106CFU/mL的金黄色葡萄球菌菌悬液,然后将Ag3PO4-nHA/DCPD/PU支架(Ø6mm×2mm)分别放入其中3支试, 剩余3支试管为空白对照。加入材料后开始计时,分别作用1,3,7,12和24h后,用移液枪从每支试管中移取200μL至2mL的生理盐水中,充分混匀,作适当稀释,取3~4个稀释度,分别移取200μL置于两个培养皿,倾注15mL40~45 ℃的营养琼脂培养基,转动培养皿,使金黄色葡萄球菌均匀地分布到营养琼脂平板上。琼脂凝固后翻转平板,在(37±1) ℃孵箱内培养48h,作活菌菌落计数。所有实验重复3次,按式(2)计算抑菌率(Bacteriostaticrate)
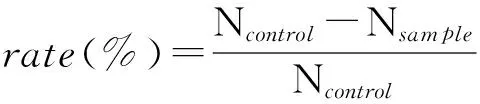
(2)
式中,Ncontrol为对照液平均菌落数,CFU/mL;Nsample为被试样液平均菌落数,CFU/mL。
2结果与讨论
2.1多孔支架形貌
DCPD在温度大于75 ℃逐渐释放出结晶水,可与PU中的—NCO反应生成CO2,实现材料自发泡成型。实验发现,添加磷酸银的复合材料在85 ℃发泡制备的Ag3PO4-nHA/DCPD/PU复合支架与90 ℃发泡制备的nHA/DCPD/PU支架结构相似,因此本文用90 ℃制备的nHA/DCPD/PU支架作为对照组。SEM观察表明,两种复合支架均富含贯穿孔,孔径分布较均匀,主要集中在300~700μm(图1(a,b)),此孔结构有利于提高细胞粘附,增加血管和组织的长入,以及有益于营养物的循环[19]。
由图1(c)-(e)可知,Ca、P和Ag元素在Ag3PO4-nHA/DCPD/PU支架中分布均匀,表明nHA、DCPD和Ag3PO4都均匀地分布在PU基体中。EDS面扫描图中各种元素的分布密度反映了材料中各种元素的含量,Ca和P元素含量较Ag元素高,与初始原料中的元素含量相对应。

图1复合多孔支架的SEM照片
Fig1SEMmicrographsofcompositeporousscaffolds
2.2X射线衍射分析
从图2可以看出,nHA/DCPD/PU和Ag3PO4-nHA/DCPD/PU支架的XRD谱图中均出现了nHA、DCPD和无水磷酸氢钙(DCPA)的衍射峰,峰强度较弱,可能是无机粒子被PU包覆,使其衍射峰强度减弱。DCPD和DCPA衍射峰同时出现表明在发泡过程中部分DCPD脱去结晶水,生成了DCPA,以DCPA形式存在于复合材料中。从Ag3PO4-nHA/DCPD/PU支架的XRD谱图可观察到明显的Ag3PO4的衍射峰。尽管Ag3PO4在材料中含量较低,但因磷酸银结晶度高,仍显示出较强的衍射峰强度。
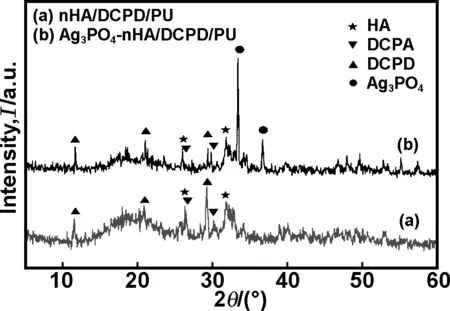
图2nHA/DCPD/PU和Ag3PO4-nHA/DCPD/PU复合支架的XRD谱图
Fig2XRDpatternsofnHA/DCPD/PUandAg3PO4-nHA/DCPD/PUcompositescaffolds
2.3FT-IR分析
图3为支架的红外光谱图,3 338,1 712,1 520和1 230cm-1附近出现的吸收峰表明反应生成了氨基甲酸酯交联键[18, 20-21]。

图3nHA/DCPD/PU和Ag3PO4-nHA/DCPD/PU复合支架的红外光谱图
Fig3FT-IRspectraofnHA/DCPD/PUandAg3PO4-nHA/DCPD/PUcompositescaffolds

2.4支架孔隙率与力学性能
表2列出了nHA/DCPD/PU和Ag3PO4-nHA/DCPD/PU复合多孔支架的孔隙率、抗压强度和弹性模量。结果显示,Ag3PO4的加入对复合支架的孔隙率没有明显影响,复合支架的孔隙率在80.5%左右;但对复合支架的力学性能产生了显著的影响,抗压强度和模量分别增加到2.83和116MPa,相比nHA-DCPD/PU支架增加了87%和170%。制备的抗菌复合支架的孔隙率和力学强度都能较好的满足骨组织工程支架的要求[22]。
表2nHA/DCPD/PU和Ag3PO4-nHA/DCPD/PU多孔复合支架的孔隙率和力学性能
Table2PorosityandmechanicalpropertiesofnHA/DCPD/PUandAg3PO4-nHA/DCPD/PUcompositescaffolds

组成孔隙率/%强度/MPa模量/MPanHA/DCPD/PU80.3±1.221.51±0.1543.49±4.24Ag3PO4-nHA/DCPD/PU80.7±3.772.83±0.4116±24.93
2.5抗细菌粘附实验
由图4可以看出,与金黄色葡萄球菌菌悬液共培养24h后,nHA/DCPD/PU支架表面附着大量细菌(图4(a)),Ag3PO4-nHA/DCPD/PU表面仅有少量细菌粘附,说明Ag3PO4-nHA/DCPD/PU支架具有较强的抗细菌粘附能力(图4(b))。说明分布在材料表面的磷酸银可有效抑制金黄色葡萄球菌在材料表面粘附和增殖,发挥接触抗菌作用。

图4金黄色葡萄球菌在复合多孔支架表面粘附的SEM照片
Fig4SEMmicrographsofS.aureusadhesiononcompositeporousscaffolds
2.6抑菌率实验
因Ag3PO4-nHA/DCPD/PU能有效抑制细菌在材料表面黏附,本研究进一步测试了该抗菌支架对金黄色葡萄球菌的抑菌率,结果如图5所示。Ag3PO4-nHA/DCPD/PU与菌悬液接触培养1,3,7,12和24h后,抑菌率分别为52.38%,68.25%,85.56%,90.37%与95.45%。抑菌率随着抗菌时间的延长而呈现出增大趋势,12h后抑菌率即超过90%,说明Ag3PO4-nHA/DCPD/PU支架对金黄色葡萄球菌具有高效的抑制和杀灭作用。其机理可能是随着抗菌时间的延长,更多银离子从支架中释放出来,发挥抗菌作用。
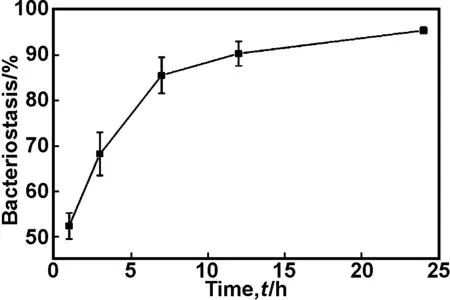
图5Ag3PO4-nHA/DCPD/PU支架对金黄色葡萄球菌的抑菌率
Fig5BacteriostaticrateofAg3PO4-nHA/DCPD/PUscaffoldsagainstS.Aureus
3结论
(1)在nHA/PU材料中复合磷酸银作为抗菌剂,复合DCPD作为发泡剂水的来源,通过释放结晶水与PU中异氰酸根反应产生CO2气体实现了复合材料均相发泡,制备了孔隙分布均匀、贯通性好、孔隙率高和力学性能佳的抗菌复合骨修复支架。
(2)Ag3PO4-nHA/DCPD/PU支架能有效抑制细菌在材料表面黏附,与细菌接触24h后抑菌率可达95%,表明添加3%(质量分数) 的Ag3PO4可赋予磷酸钙/聚氨酯复合支架良好的抗菌活性。
(3)制备的兼具适宜孔结构和高抗菌性能的复合多孔支架在骨修复领域有较大的应用潜力。
参考文献:
[1]WalidAME,MartinaF,MatthiasG,etal.ExpandingthescaffoldforbacterialRNApolymeraseinhibitors:design,synthesisandstructure-activityrelationshipsofureido-heterocyclic-carboxylicacids[J].TheRoyalSocietyofChemistry, 2014, 4: 2177-2194.
[2]RajmohanR,ElamparithiJ,HiwaM,etal.Antibacterialpropertiesof3-(phenylsulfonyl)-2-pyrazinecarbonitrile[J].BioorganicandMedicinalChemistryLetters, 2015, 25(22): 5203-5207.
[3]ShahSR,KurtisKF,MikosAG.Perspectivesonthepreventionandtreatmentofinfectionfororthopedictissueengineeringapplications[J].ChinSciBull,2013, 58:4342-4348.
[4]ChengQL,LiCZ,VladimirP,etal.Surface-modifiedantibacterialTiO2/Ag+nanoparticles:preparationandproperties[J].ApplSurfSci, 2006, 252(12): 4154-4160.
[5]ImazatoaS,EbiaN,TakahashiaY,etal.Antibacterialactivityofbactericide-immobilizedfillerforresin-basedrestoratives[J].Biomaterials, 2003, 24(16): 3605-3609.
[6]SauvetG,DupondS,KazmierskiK,etal.Biocidalpolymersactivebycontact.V.Synthesisofpolysiloxaneswithbiocidalactivity[J].JApplPolymSci, 2000, 75: 1005-1012.
[7]MaY,ZhouT,ZhaoC.Preparationofchitosan-nylon-6blendedmembranescontainingsilverionsasantibacterialmaterials[J].CarbohydRes, 2008, 343(2): 230-237.
[8]ChenW,LiuY,CourtneyHS,etal.Invitroanti-bacterialandbiologicalpropertiesofmagnetronco-sputteredsilver-containinghydroxyapatitecoating[J].Biomaterials, 2006, 27: 5512-5517.
[9]JonesJR,EhrenfriedLM,SaravanapavanP,etal.Controllingionreleasefrombioactiveglassfoamscaffoldswithantibacterialproperties[J].JournalofMaterialsScience:MaterialsinMedicine, 2006, 17: 989-996.
[10]GrayJE,NortonPR,AlnounoR.Biologicalefficacyofelectroless-depositedsilveronplasmaactivatedpolyurethane[J].Biomaterials, 2003, 24(16): 2759-2765.
[11]WangJianrong,LiuBin,HeKang.AstudyofdenturebaseAg-carryingzeolite/PMMAantibacterialcompositematerial[J].JournalofModernStomatology, 2009, 23(4): 395-398.
王建荣, 刘斌, 何康. 载银沸石/PMMA抗菌复合义齿基托材料的研究[J]. 现代口腔医学杂志, 2009, 23(4): 395-398.
[12]WangJian,ZhaoMinghui,LiYubao,etal.Antibacterialpropertiesevaluationofanovelpolyurethane-basedrootcanalsealer[J].MaterialsScienceForum, 2015, 804: 231-234.
[13]GuelcherSA.Biodegradablepolyurethanes:synthesisandapplicationsinregenerativemedicine[J].TissueEngineeringPartB:Reviews, 2008, 14(1): 3-17.
[14]McbaneJE,ShaifpoorS,CaiK,etal.Biodegradationandinvivobiocompatibilityofadegradable,polar/hydrophobic/ionicpolyurethanefortisseengineeringapplications[J].Biomaterials, 2011, 32(26): 6034-6044.
[15]GiannitelliSM,BasoliF,MozeticP,etal.Gradedporouspolyurethanefoam:apotentialscaffoldfororo-maxillaryboneregeneration[J].MaterialsScienceandEngineeringC, 2015, 51: 329 -335.
[16]YangW,BothSK,ZuoY,etal.Biologicalevaluationofporousaliphaticpolyurethane/hydroxyapatitecompositescaffoldsforbonetissueengineering[J].JournalofBiomedicalMaterialsReserachPartA, 2015, 103(7): 2251-2259.
[17]LiuHaohuai,ZhangLi,ZuoYi,etal.Preparationandcharacterizationofaliphaticpolyurethaneandhydroxyapatitecompositescaffold[J].JournalofAppliedPolymerScience, 2009, 112(5): 2968-2975.
[18]LiLimei,ZuoYi,DuJingjing,etal.Structuralandmechanicalpropertiesofcompositescaffoldsbasedonnano-hydroxyapatiteandpolyurethaneofalcoholizedcastoroil[J].JournalofInorganicMaterials, 2013, 28(8): 811-817.
李丽梅, 左奕, 杜晶晶,等.醇化改性蓖麻油基聚氨酯/n-HA复合支架材料的结构及力学性能[J].无机材料学报, 2013, 28(8): 811-817.
[19]HulbertSF,YoungFA,MathewsRS,etal.Potentialofceramicmaterialsaspermanentlyimplantableskeletalprostheses[J].JournalofBiomedicalMaterialsResearch, 1970, 4(3): 433-456.
[20]TeramotoN,SaitohY,TakahashiA,etal.Biodegradablepolyurethaneelastomerspreparedfromisocyanate-terminatedpoly(ethyleneadipate),castoroil,andglycero[J].JournalofAppliedPolymerScience, 2010, 115(6): 3199-3204.
[21]MishraAK,ChattopadhyayDK,SreedharB.FT-IRandXPSstudiesofpolyurethane-urea-imidecoatings[J].ProgressinOrganicCoatings, 2006, 55(3): 231-243.
[22]MathieuLM,MuellerTL,BourbanPE,etal.Architectureandpropertiesofanisotropicpolymercompositescaffoldsforbonetissueengineering[J].Biomaterials, 2006, 27(6): 905-916.
Preparationofantibacterialcompositeporousscaffoldsbyhomogeneousself-foamingmethod
LIGen,LILimei,JIANGJiaxing,LIJiongjiong,ZUOYi,LIYubao,ZOUQin,ZHANGLi,LIJidong
(Analytical&TestingCenter,SichuanUniversity,Chengdu610064,China)
Abstract:Infectionassociatedwithimplantedbonerepairmaterialsisstillachallengingissueinclinic.Thebonerepairmaterialswithlocaldrug-deliverycapacityhavedrewmuchattentioninsusceptiblebonedefectrepairrecently.Inthepresentstudy,Ag3PO4wasselectedasanantibacterialagentandincorporatedintothenano-hydroxyapatite/polyurethane(nHA/PU)composite,whichhavebeenprovedtobeabiocompatiblematerialswithgoodosteogenesis.Calciumhydrogenphosphatedihydrate(DCPD)wasaddintothenHA/PUcompositeandservedasfoamingagent.Undercertaincondition,thecrystallinewatercanreleasefromDCPDandreactwithisocyanate(—NCO)togenerateCO2,resultinginthehomogeneousself-foamingofthecomposite.TheresultsrevealedthattheporosityandcompressivestrengthoffabricatedAg3PO4loadednano-hydroxyapatite/Calciumhydrogenphosphatedihydrate/polyurethane(Ag3PO4-nHA/DCPD/PU)compositescaffoldscanreach80.7%and95.45%,respectively.ThefabricatedAg3PO4-nHA/DCPD/PUscaffoldsalsocanpreventbacteriaadhesiononthematerialsurfaceeffectivelyandbacteriostaticratecanreach95.45%afterincubationthebacteriawiththematerialsfor24h.TheresultantAg3PO4-nHA/DCPD/PUcompositescaffoldswithhighporosity,uniformporousstructureandinterconnectivityaswellasstrongantibacterialpropertiesfabricatedbysuchafacilemethodhaveagreatpotentialtobeappliedinthefieldsofbonerepair.
Keywords:antibacterial;polyurethane;nano-hydroxyapatite;silverphosphate;homogeneousself-foaming
文章编号:1001-9731(2016)06-06176-05
* 基金项目:国家高技术研究发展计划(863计划)重点资助项目(2013AA032203); 国家自然科学基金资助项目(31370971); 四川大学优秀青年学者基金资助项目(2014SCU04A20).
作者简介:李根(1991-),男,河南南阳人,硕士,师承李吉东副教授,从事生物材料研究。
中图分类号:TB33
文献标识码:A
DOI:10.3969/j.issn.1001-9731.2016.06.032
收到初稿日期:2016-03-28 收到修改稿日期:2016-05-10 通讯作者:李吉东,E-mail:nic1979@scu.edu.cn

