可溶性寡糖和小分子的热激蛋白与杂交水稻种子成熟过程中发芽能力及种子活力相关
朱丽伟曹栋栋付玉营胡琦娟利 站关亚静胡伟民胡 晋, *
1浙江大学农业与生物技术学院种子科学中心, 浙江杭州 310058;2贵州师范大学荞麦产业技术研究中心, 贵州贵阳 550001;3浙江农科种业有限公司, 浙江杭州 310058
可溶性寡糖和小分子的热激蛋白与杂交水稻种子成熟过程中发芽能力及种子活力相关
朱丽伟1,2,**曹栋栋3,**付玉营1胡琦娟1利 站1关亚静1胡伟民1胡 晋1, *
1浙江大学农业与生物技术学院种子科学中心, 浙江杭州 310058;2贵州师范大学荞麦产业技术研究中心, 贵州贵阳 550001;3浙江农科种业有限公司, 浙江杭州 310058
摘 要:系统研究了不同成熟期Y两优689杂交水稻种子的活力、可溶性寡糖含量和小分子热激蛋白表达量的变化。运用模糊隶属函数法综合分析种子的发芽率、发芽势、发芽指数、活力指数、平均发芽时间、根数、根长、苗高、苗重发现, 授粉后19~34 d的种子生活力与活力均较高。种子成熟过程中含水量呈下降趋势, 授粉后10~22 d, 种子含水量从48.2%下降至23.9%; 鲜种子棉子糖与果糖含量分别呈上升和下降趋势; 水苏糖和葡萄糖呈先上升后下降趋势。授粉后10~19 d, 小分子热激蛋白64SHsp18.0和Os03g0267200基因的表达量均呈上升趋势, 此后相对表达量下降。水分、棉子糖、水苏糖和蔗糖等物质含量, 鲜种子及干种子的千粒重, 以及64SHsp18.0和Os03g0267200基因的相对表达量均与种子发芽密切相关。
关键词:杂交水稻; 种子; 成熟; 小热激蛋白; 寡糖; 活力
本研究由国家公益性行业(农业)科研专项(201203052), 浙江省科技厅项目(2013C02005, 2013C32023), 浙江省自然科学基金项目(LZ14C130002, LY15C130002)和江苏省现代作物生产协同创新中心项目资助。
This study was supported by the China Special Fund for Agro-Scientific Research in the Public Interest (201203052), the Subject Fund of Zhejiang Province Science and Technology Hall (2013C02005, 2013C32023), the Natural Sciences Fund of Zhejiang Province (LZ14C130002, LY15C130002), and Jiangsu Collaborative Innovation Center for Modern Crop Production.
第一作者联系方式∶ 朱丽伟, E-mail∶ liweib0401001@163.com; 曹栋栋, E-mail∶ jellycao@163.com
URL∶ http∶//www.cnki.net/kcms/detail/11.1809.S.20160311.1604.006.html
种子的发芽能力是在种子发育过程中形成的,一般认为种子成熟度越高, 种子活力也越高。然而王仁祥等[1]发现杂交水稻株两优02和株两优819在制种母本终花期之后11~16 d收获的种子, 贮藏6个月后发芽率均达到国家标准, 而终花期17 d后收获的种子, 贮藏6个月后, 易发生发芽率低于80%的现象。周建明等[2]研究了不同收获期杂交粳稻种子的耐贮藏能力, 发现完熟期种子(授粉后50 d 收获)随着贮藏时间的延长, 发芽率显著下降, 而授粉后 35 d和45 d收获的种子, 贮藏1~8个月间, 发芽率有所上升, 贮藏至12个月, 发芽率显著下降。研究表明适宜的收获期对提高种子质量非常重要, 可极大地提高种子活力[3-4]。模糊综合评价是对受多种因素影响的事物做出全面评价的一种有效的多因素决策方法, 其特点是评价结果不是绝对地肯定或否定, 而是以一个模糊集合来表示。隶属度µ(x)越接近于 1,表示x属于A的程度越高, µ(x)越接近于0表示x属于 A的程度越低。孟庆立等[5]利用模糊综合评价的方法分析不同品种谷子的抗旱性, 发现此分析方法所得结果可避免单一指标的片面性和不稳定性, 可以较好地揭示谷子抗旱性状与其抗旱性的关系。本试验拟采用模糊隶属函数法分析不同成熟期Y两优689种子生活力与活力变化, 综合考虑种子发芽与幼苗质量指标, 进而选出适宜的种子收获期。
目前对种子成熟过程的研究大多集中在种子的含水量、干鲜重等生理指标的变化方面[6]。关于种子何时收获质量最佳, 说法不一。Harrington等[7]提出种子质量在种子获得最大干重时最佳, 随后种子生活力和活力下降。Eskandari等[8]提出种子质量并未在种子获得最大干重时获得, 反而最佳的种子质量发生在种子获得最大干重之后。近来也有研究利用种子的其他特征如种皮颜色、黑色层等指标, 作为检测成熟过程种子质量变化的指标[9-10], 说明需要更多指标综合判断种子的成熟度。研究发现不同收获时期可以影响到种子幼胚的成熟、各种功能蛋白、酶的合成、能量物质的合成转化、各种生理物质的转化(如单糖、激素), 以及种子的脱水程度, 进而影响种子活力[2]。Blackman等[11]发现糖类对大豆种子成熟过程中脱水耐性的获得发挥很大作用, 脱水速度不同的大豆种子, 其发芽率与蔗糖和水苏糖含量密切相关。Gorecki等[12]研究发现豌豆自交系种子成熟过程中, 种子脱水耐性的获得与蔗糖和棉子糖的积聚相关。拟南芥种子成熟过程中贮藏物质的合成随蔗糖、水苏糖和棉子糖等寡聚糖的积聚而终止, 且六碳糖同蔗糖含量的比值变化与种子胚胎发育紧密相关[13]。甜玉米种子成熟过程中还原性糖含量同种子发芽势、发芽率、发芽指数和活力指数显著负相关[4]。小分子热激蛋白(sHSPs)是植物响应逆境及发育信号合成的一类低分子量(15~30 kD)的热激蛋白的简称。Wehmeyer等[14]发现随着拟南芥种子的发育, 种子内 sHSPs的相对表达量也逐渐上升,至种子成熟达最大值。Neta-Sharir等[15]通过转基因技术, 将sHSP21基因转入番茄, 发现sHSP21蛋白可促进类胡萝卜素的积累, 参与果实的发育。Sarkar等[16]应用基因芯片技术发现不同的小热激蛋白在水稻种子发育的不同阶段、不同部位相对表达量差异很大, 其中小分子热激蛋白Hsp18.0-CII在种子干燥脱水阶段其基因表达量明显上调, 小分子热激蛋白Hsp18.0-CI在水稻遭受脱水胁迫时其基因表达量也明显上调。另外, 有研究发现作物遭受非生物胁迫时, 其小分子热激蛋白的基因表达量会显著上调或者下调[16-18]。以上研究说明小分子热激蛋白与作物种子的发育及其植株抗逆性有关。本文拟研究可溶性寡糖及小分子热激蛋白64SHsp18.0和Os03g0267200基因相对表达量的变化, 探索它们与种子生活力和活力的相关性, 综合考虑后确定种子的收获期。
1 材料与方法
1.1 试验材料
为杂交水稻Y两优689种子。
1.2 试验方法
1.2.1 不同成熟期水稻种子的获得 试验在浙江大学紫金港校区农场进行。分别于田间种植Y两优689的父母本。生长期间进行一致的传统田间管理。在水稻开花前, 将父母本隔离, 至水稻盛花期撤除隔离物, 集中一天人工授粉以保证种子有相同的授粉时间。授粉后继续隔离父母本。授粉当日记为授粉第0天。在授粉后的第10、第13、第16、第19、第22、第25、第28、第31和第34天收获水稻鲜种子, 将其部分材料液氮速冻后保存于-80℃冰箱,部分材料存于通风干燥处晾晒至含水量11%备用。
1.2.2 发芽试验 种子经0.1% NaClO溶液消毒15 min, 清水洗净, 放于铺有2层湿润发芽纸的发芽盒内进行发芽试验[19], 发芽盒规格为12 cm×18 cm,每盒100粒种子为1次重复, 3次重复, 将种子置20 ℃/30℃光照培养箱中, 16 h光照/8 h黑暗24 h交替。以种子胚根1 mm长为发芽标准, 每天记录发芽数,分别在发芽第5天和第14天计算发芽势(germination energy, GE)和发芽率(germination percentage, GP)。于统计发芽率当天, 随机选择每处理20株幼苗, 测定其鲜重, 然后将幼苗置105℃烘箱保持30 min, 再调整温度至80℃保持24 h, 取出放干燥器冷却后测定其干重。根数、根长和苗高均为20株幼苗平均值,每个收获期 3次重复。并根据每天发芽数计算发芽指数(germination index, GI)、活力指数(vigor index,VI)和平均发芽时间(mean germination time, MGT)。

式中, Dt为不同的发芽日数, Gt为不同发芽日数的相应发芽数, S为20株幼苗干重(g)。
1.2.3 种子含水量测定 采用二次烘干法测定种子含水量(moisture content, MC)[19]。每个收获时期设3次重复, 每个重复25 g种子(W1)。将样品放入103℃烘箱烘 30 min后放入干燥器, 冷却后称重(W2),然后将样品磨粉, 从中称取样品(W3)放入105℃烘箱持续8 h, 放入干燥器冷却后, 称重(W4)。
种子含水量(%)=(W2×W4)/(W1×W3)
1.2.4 种胚内可溶性寡糖的测定 参照Baily等[20]的方法, 稍有改进, 提取种胚内可溶性寡糖, 将水稻种胚小心自水稻种子剥离, 每个样品3次重复, 取每个重复10~15粒完整水稻种胚, 常温下充分研磨,加80%乙醇溶液1 mL继续研磨均匀后, 放入80℃恒温振荡水浴锅振荡30 min。将水浴后的混合物放至常温后, 在转速为 14 000×g离心机离心 15 min, 得第1次提取上清液。向第1次提取后的固体残渣中加80%乙醇溶液0.5 mL, 混合均匀后放超声振荡仪中再次萃取30 min, 振荡仪温度为15~25℃, 然后对混合物再次离心, 取其上清液。向第 2次离心后固体残渣加80%乙醇溶液0.35 mL, 混合均匀后放超声振荡仪中再次萃取 30 min, 超声振荡温度同上, 然后对混合物再次离心, 取上清液。合并 3次提取上清液, 在温度 35℃条件下以氮气吹干, 加超纯水定容至 100 μL。溶液经 0.45 μm滤膜过滤后, 进行HPLC测定。
用 Waters 2410示差折光检测器及 Xtimate Sugar-Ca色谱柱(7.8250 mm, 美国)检测; 流动相为去离子水; 柱温80℃; 流速0.5 mL min-1; 进样体积为50 μL。
1.2.5 种子小热激蛋白(sHSPs)基因的相对表达量测定 采用GK系列超快新型植物RNA提取试剂盒(华越洋, 北京), 按其说明书从新鲜的水稻种子内提取总RNA, 并用无RNase DNase I去除样品中的残留 DNA。将提取的样品放-80℃低温保存。利用NanoDrop 1000分光光度计(NanoDrop Technologies,Wilmington, 美国)检测RNA的纯度和浓度后, 添加无RNase H2O, 将每个样品的RNA浓度调整至200 ng mL-1, 备用。采用PrimerScript II 1 st strand cDNA Synthesis Kit试剂盒(TaKaRa, 日本)进行RNA的反转录试验。反应终止得到cDNA模板, 保存在-20℃冰箱待用。根据NCBI网站上查询到的64S Hsp18.0 和Os03g0267200的CDS序列, 利用Primer 5.0软件设计引物(表1)。
在96孔板上利用SYBR Premix Ex Taq II (Ta-KaRa)法以cDNA为模板, 采用CFX96实时PCR检测系统(Bio-Rad, Hercules, 美国)进行实时定量PCR。每个样品 3次重复。PCR体系含 5×SYBR Premix Ex Taq II 10 μL、模板DNA 2 μL和上下游引物各1 μL, 以ddH2O补足20 μL。PCR程序为95℃保温30 s, 然后95℃ 5 s, 60℃ 20 s进行40个循环。在60℃步骤时收集荧光信号。每循环结束后进行溶解曲线分析, 以线性方式从 65℃升温至 95℃。以β-OsActin (内参基因)基因为参照, 采用 2-ΔΔCt法计算64SHsp18.0和Os3g0267200基因的相对转录量。

表1 不同成熟期水稻基因表达量的实时荧光定量PCR所用的引物序列Table 1 Primers used in q-PCR analysis of the expression of sHsp genes in hybrid rice seeds at different development phases
1.2.6 种子发芽与幼苗质量综合评价 利用模糊隶属函数法综合评价种子活力。参考孟庆立等[5]的方法, µ(x)=(X-Xmin)/(Xmax-Xmin), 其中µ(x)为某个指标性状的模糊隶属函数值, 若指标与活力呈负相关(如平均发芽时间)则用1-µ(x)表示, X指某一指标数值, Xmax、Xmin分别表示所有发育期内种子某一指标的最大和最小值。平均模糊隶属函数值(average value, A-value)为各个指标隶属函数值的平均数。发芽与幼苗质量的平均模糊隶属函数值为测定的所有种子发芽与幼苗生长指标的平均隶属函数值。
1.3 统计分析
采用SAS软件对所得数据进行方差分析。对多重比较采用LSD, α=0.05, 在分析前, 采用y=arcsin [sqrt (x/100)]公式, 将百分率数据进行反正弦转换。采用SAS软件对种子含水量、鲜种子与干种子千粒重、水苏糖、棉子糖、蔗糖、葡萄糖、果糖等物质含量的变化以及小热激蛋白(64SHsp18.0和Os03g0267200)基因相对表达量的变化分别与种子生活力和活力进行相关性分析[21]。
2 结果与分析
2.1 不同成熟期杂交水稻种子生活力与活力的变化
随着种子成熟度的提高, 种子发芽能力显著上升, 授粉后 10 d种子发芽势为 19.3%, 发芽率为30.7% (表2)。授粉后10~16 d, 种子发芽势、发芽率、发芽指数和活力指数均显著上升, 平均发芽时间显著缩短。授粉后16~19 d, 不同时期种子的发芽势与发芽率无显著差异, 然而授粉后19 d种子的发芽指数与活力指数显著高于授粉后16 d的种子, 平均发芽时间也显著缩短。授粉后19~34 d, 不同成熟度种子的发芽率与发芽势无显著差异。从种子生活力和活力变化趋势看, 19 d时达到最高水平, 生活力一直保持至34 d不变, 但活力水平在31~34 d时, 发芽势和平均发芽时间保持不变, 发芽指数和活力指数有所下降。从种子生活力与活力水平看, 种子的收获时间宜在授粉后19~34 d (表2)。
2.2 不同成熟期杂交水稻种子幼苗质量的变化
授粉后10~19 d, 不同成熟期的Y两优689水稻幼苗根数、苗高、苗鲜重和苗干重均显著上升, 而幼苗根长无明显变化规律。授粉后19~31 d, 不同成熟期种子幼苗的根数和苗干重无显著差异, 授粉后25 d种子幼苗的苗高显著低于其他4个时期。授粉后34 d采收种子的幼苗, 其根数和苗高显著低于授粉后 31 d, 二者在根长、苗鲜重和苗干重间无显著差异(表3)。
随着种子成熟度的提高, Y两优689杂交水稻种子生活力与活力的平均模糊隶属函数呈先上升后下降的变化趋势。授粉后28 d和34 d采收的种子发芽率模糊隶属函数值较大。授粉后19 d采收种子的发芽势、活力指数和平均发芽时间的模糊隶属函数值均较高。综合考虑种子的生活力与活力, 授粉后19 d采收种子的平均函数值最高, 其次分别是授粉后28、31和34、22、25、16、13和10 d采收的种子(表4)。
授粉后22 d采收的Y两优6809杂交水稻种子幼苗的根数、苗高和幼苗干重的模糊隶属函数值均较高。授粉后25 d采收种子的幼苗干重与鲜重均较高。综合考虑幼苗的各项指标, 授粉后 31 d采收种子幼苗平均模糊隶属函数值最高, 其次分别是授粉后22、34、19、25、28、16、13和10 d采收的种子(表5)。

表2 不同成熟期Y两优689杂交水稻种子的发芽势、发芽率、发芽指数、活力指数和平均发芽时间Table 2 Germination energy (GE), germination percentage (GP), germination index (GI), vigor index (VI), and mean germination time (MGT) of Y Liangyou 689 hybrid rice seeds at different maturation stages
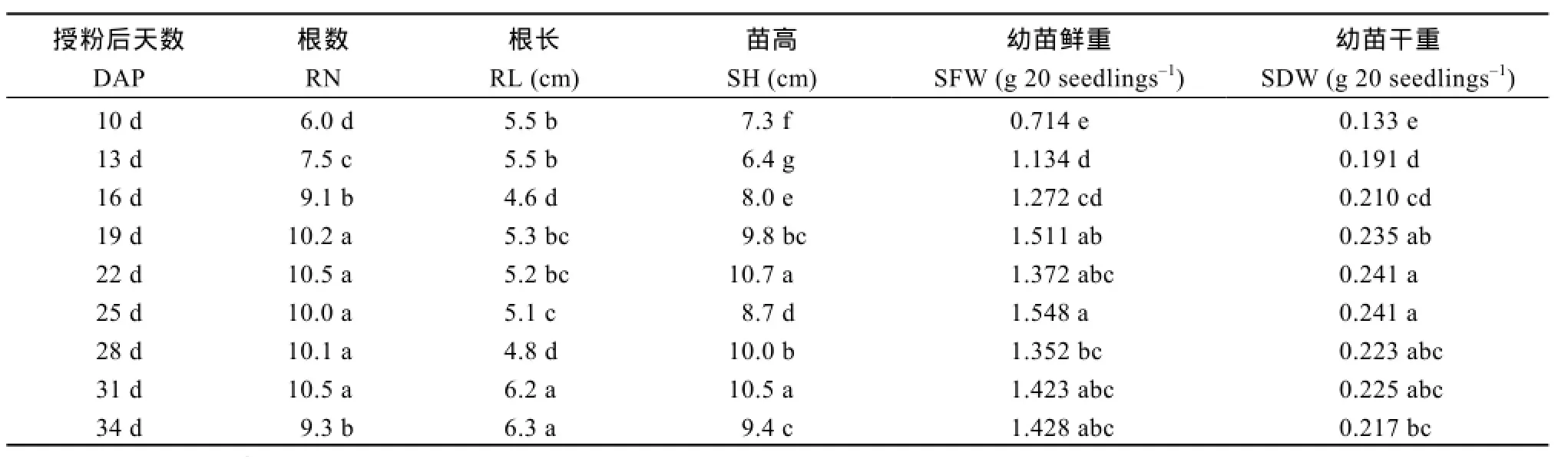
表3 不同成熟期Y两优689杂交水稻种子幼苗的根数、根长、苗高和幼苗鲜重、幼苗干重Table 3 Root numbers and length, shoot height, seedling fresh, and dry weights of Y Liangyou 689 hybrid rice seedlings at different maturation stages

表4 不同成熟期Y两优689杂交水稻种子的发芽势、发芽率、发芽指数、活力指数和平均发芽时间的模糊隶属函数值Table 4 Mean fuzzy subordinate function value of germination energy, germination percentage, germination index, vigor index, and mean germination time of Y Liangyou 689 rice seeds at different maturation stages

表5 不同成熟期Y两优689杂交水稻种子幼苗的根数、根长、苗高和苗鲜重、苗干重的模糊隶属函数值Table 5 Mean fuzzy subordinate function values of root number and length, shoot height, fresh and dry weights of seedling in Y Liangyou 689 hybrid rice at different maturation stages

图1 不同成熟期Y两优689杂交水稻种子发芽与幼苗质量的平均模糊隶属函数值Fig.1 Mean fuzzy subordinate function value in seed germination and seedling quality at different maturation stages of Y Liangyou 689 hybrid rice
授粉后19 d采收的种子, 其发芽与幼苗质量显著高于授粉后10~16 d采收的种子批。综合考虑不同成熟期杂交水稻种子发芽与幼苗质量, 模糊隶属函数值最高的是授粉后 31 d收获的种子, 授粉后19、22、25、28和34 d收获的种子其综合模糊隶属函数值均较高(图1)。
2.3 不同成熟期杂交水稻种子含水量与鲜重和干重的变化
授粉后10~28 d Y两优689杂交水稻种子, 含水量整体呈下降趋势。如授粉后 10~16 d种子的含水量显著下降, 下降了22.2%。授粉后19~28 d, 种子含水量呈先下降后上升的趋势。其中授粉后16~19 d和25~28 d种子含水量呈上升趋势。这可能和当时的天气有关, 因为授粉后10 d、19 d和28 d均为降雨天气, 且当时空气相对含水量都在 95%以上(表6)。授粉后16~28 d, 种子鲜重无显著变化且达最大值。授粉后10~16 d, 种子干重显著上升, 其千粒重由11.640 g上升至19.047 g。授粉后16~22 d, 种子干重间无显著差异。授粉后22~28 d, 种子干重无显著变化且达最大值(表6)。
2.4 不同成熟期杂交水稻种子可溶性寡糖含量的变化
Y两优689杂交水稻种子成熟过程中, 还原性糖与非还原性糖含量均有显著的变化。种子内水苏糖含量在授粉后10~19 d呈上升趋势, 授粉后19~22 d, 含量无显著变化且达最高值, 授粉后22~25 d显著下降,授粉后25~28 d, 趋于稳定达最低值。种子内棉子糖含量在授粉后10~13 d显著上升, 授粉后13~16 d无显著变化, 授粉后16~28 d呈持续上升趋势且授粉后28 d达最大值。种子内蔗糖含量在授粉后10~19 d呈上升趋势且在授粉后19 d达最大值。授粉后19~25 d呈下降的趋势, 授粉后25~28 d呈上升的趋势(表7)。
随着种子成熟, 种子内葡萄糖在授粉后10~16 d呈先上升后下降的趋势, 授粉后 16~19 d显著上升且在授粉后19 d时达最大值, 授粉后19~28 d显著下降。种子内果糖含量在授粉后10~13 d无显著变化, 授粉后13~16 d显著下降且授粉后16 d达最低值, 授粉后16~19 d显著上升, 授粉后19~22 d无显著变化, 授粉后22~25 d显著下降, 授粉后25~28 d无显著变化(表7)。

表6 不同成熟期Y两优689杂交水稻种子含水量及其鲜重和干重Table 6 Differences of moisture content, thousand-seed weight of fresh seeds and dry seeds at different maturation stages of Y Liangyou 689 hybrid rice seeds
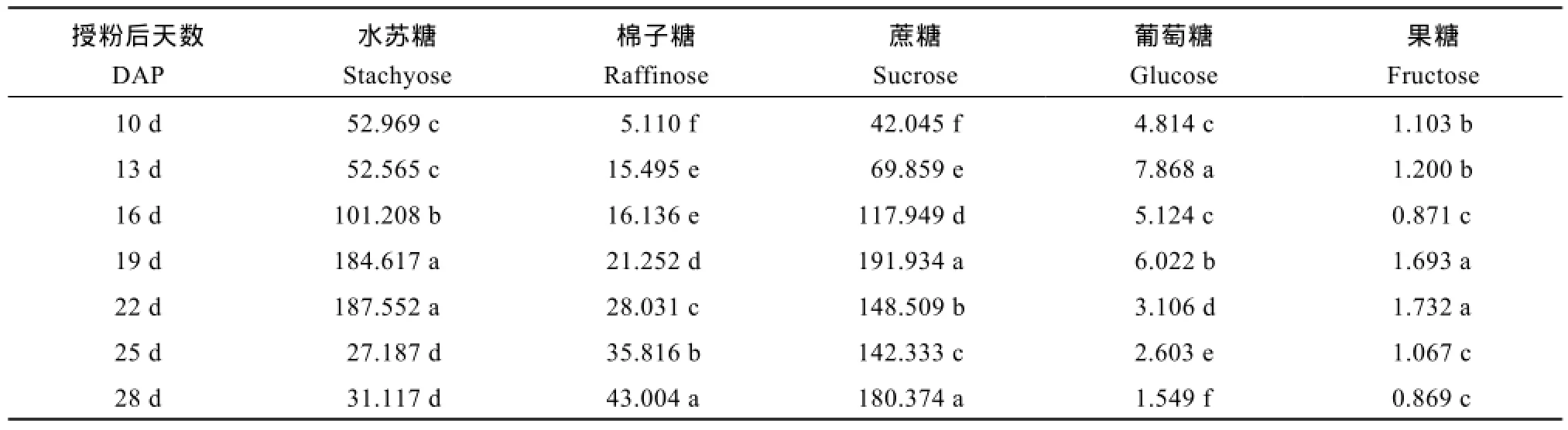
表7 不同成熟期Y两优689杂交水稻种子中水苏糖、棉子糖、蔗糖、葡萄糖和果糖的含量Table 7 Soluble stachyose, raffinose, sucrose, glucose, and fructose contents at different maturation stages of Y Liangyou 689 hybrid rice (µg 10-seed-1)
2.5 不同成熟期杂交水稻种子热激蛋白 64SHsp18.0 和Os03g0267200基因相对表达量的变化
授粉后10~19 d, Y两优689杂交水稻鲜种子内64SHsp18.0基因的表达量呈上调的变化趋势, 授粉后19 d采收的种子其基因相对表达量最高。授粉后19~25 d, 此基因的表达量下调(图2-A)。热激蛋白基因Os03g0267200的表达量具有相似的趋势, 如授粉后10~19 d, 鲜种子内Os03g0267200的相对表达量上调,特别是授粉后16~19 d, 基因的表达量上调极其明显。授粉后19~28 d, 此基因的表达量明显下调(图2-B)。
2.6 种子成熟过程中含水量、鲜重、干重、可溶性寡糖等物质含量及sHSPs基因相对表达量与种子生活力和活力的相关性
Y两优 689杂交水稻种子成熟过程中, 种子内棉子糖、水苏糖和蔗糖等 3个指标均与种子发芽率呈显著正相关, 而含水量与种子的发芽率呈显著负相关。种子内棉子糖、水苏糖、蔗糖等 3种物质的含量以及64S Hsp18.0和Os03g0267200等2种小热激蛋白基因的相对表达量与种子的发芽势呈显著正相关。鲜种子与干种子的千粒重均与种子发芽率和发芽势无显著相关性(表8)。
Y两优689杂交水稻种子成熟过程中, 棉子糖、水苏糖和蔗糖物质的含量以及 64S Hsp18.0和Os03g0267200基因的相对表达量均与种子发芽指数显著正相关。棉子糖和水苏糖的含量以及 64S Hsp18.0和Os03g0267200基因的相对表达量均与种子活力指数显著正相关。种子成熟过程中含水量、千粒重、葡萄糖和果糖含量变化与种子发芽指数和活力指数的相关性均不显著(表9)。
Y两优689杂交水稻种子成熟过程中, 种子含水量与种子的平均发芽时间呈显著正相关, 鲜种子与干种子的千粒重均与种子的平均发芽时间呈显著负相关, 而可溶性寡糖及2个小热激蛋白均与种子平均发芽时间的相关性不显著(表10)。

图2 不同成熟期Y两优689水稻种子64S Hsp18.0 (A)和Os03g0267200 (B)基因相对表达量Fig.2 Relative expression levels of 64S Hsp18.0 (A) and Os03g0267200 (B) genes at different maturation stages of Y Liangyou 689 hybrid rice seed

表8 Y两优689杂交水稻种子成熟过程生理生化的变化与种子发芽率和发芽势之间的直线回归关系(授粉后10~22 d)Table 8 Linear regression relationships of the physiological and biochemical changes with germination percentage and germination energy at different maturation stages in Y Liangyou 689 hybrid rice seeds (10 to 22 DAP)

表9 Y两优689杂交水稻种子成熟过程中生理生化变化与种子发芽指数和活力指数间的直线回归关系(授粉后10~22 d)Table 9 Linear regression relationships of the physiological and biochemical changes with germination index and vigor index at different maturation stages in Y Lianyou 689 hybrid rice seeds (10 to 22 DAP)
3 讨论
本文的研究结果表明, Y两优689杂交水稻种子成熟过程中, 种子活力逐渐升高, 授粉后19~34 d种子的生活力和活力均保持较高水平。刘信[22]对春江15和中组1号2个水稻品种研究的结果也表明水稻种子生理成熟较早, 授粉后10 d就具有发芽能力。Y两优689水稻种子成熟过程中含水量呈下降趋势,且与种子发芽率和平均发芽时间显著相关, 然而授粉后19 d遇阴雨天气时, 含水量又有所上升。有研究认为利用雄性不育系制种, 喷施赤霉素后植株易倒伏, 种子在穗上易萌动发芽[23]。因此在Y两优689杂交水稻制种后期, 保证其较低含水量水平非常重要。近年来, 很多实践和研究都表明, 水稻穗萌发在我国很严重, 一般年份穗发芽率为5%左右, 但成熟期遇阴雨天气, 其穗芽率少则 10%, 多的可达到90%[24]。先前对杂交水稻Y两优689的研究表明, 授粉后19 d其种子的长、宽、厚、种皮、胚、胚乳、千粒重等大部分生理指标均达稳定状态[25], 本文的发芽试验更加证明Y两优 689杂交稻授粉后19 d,其种子即生理成熟, 因此可通过提早收获来避开阴雨天气, 降低稻穗萌发率。

表10 Y两优689杂交水稻种子成熟过程中生理生化变化与种子平均发芽时间(MGT)的直线回归关系(授粉后10~22 d)Table 10 Linear regression relationships of the physiological and biochemical changes with mean germination time at different maturation stages in Y Liangyou 689 hybrid rice seeds (10 to 22 DAP)
Y两优 689杂交水稻品种成熟过程中, 授粉后22 d采收的种子, 其千粒重达最大值, 此后无显著变化, 然而授粉后19 d采收的种子活力指数最高。授粉后10~22 d种子的千粒重均与种子生活力和活力显著相关。因此种子千粒重可作为Y两优689杂交水稻种子成熟过程中活力的判断指标之一。一般认为种子干物质重最大时种子质量最佳, 有研究发现ZR02和金23A/ZR02两个杂交水稻品种的种子最大萌发率与最大干重同时出现[6]。不过先玉335、郑单958和吉祥1号3个杂交玉米成熟过程中, 种子百粒重不到最大百粒重90%时的活力最高[26]。可见种子活力最高值的出现与种子千粒重最高值出现时间不一定完全吻合, 具体还要看作物类别和品种。
种子中所含的糖类包括多糖(主要是淀粉)、寡糖(水苏糖、棉子糖、半乳糖等)、二糖(主要是蔗糖和麦芽糖)和单糖(葡萄糖、果糖和甘露糖等)。本研究发现, 棉子糖、水苏糖和蔗糖均与种子生活力和活力显著相关, 而葡萄糖和果糖与之不相关。这与前人的研究结果相符, 糖的含量确实可作为指标来显示种子的活力和耐贮藏能力[27-28]。蔗糖是高等植物光合作用主要终产物之一, 有研究发现蔗糖合成基因的表达与大豆、棉花和拟南芥种子的发育相关。蔗糖合成酶基因在豆科种子发育过程中表达量急剧上升[29-30], 抑制蔗糖合成酶基因的表达将影响纤维素和果胶的合成, 进而停止棉花种子发育[31], 蔗糖含量显著上升的拟南芥突变体, 其种子体积变小且种皮所占比例加大, 种胚所占比例缩小[32]。研究还发现种子发育过程中棉子糖、水苏糖和蔗糖含量的变化影响其抗逆性。板栗种子脱落时其子叶和胚轴中棉子糖和水苏糖含量最高, 二者可能抑制板栗种子的褐变[33]。当大豆种子成熟时棉子糖、水苏糖和蔗糖的含量较少, 会导致其对冷害更加敏感, 且田间出苗率也显著下降[34]。近年来关于糖类在种子脱水耐性获得上的研究颇多, 研究发现棉子糖和水苏糖与巴拿马栗种子脱水耐性有关[35], 而水苏糖对于大豆种子发育中脱水耐性的形成起重要作用[36]。杂交水稻成熟过程也是种子逐渐脱水的过程, 棉子糖、水苏糖和蔗糖含量的上升有助于脱水耐性的增强。Lehner等[37]也发现小麦种子脱水过程中种胚内的蔗糖和棉子糖均呈上升趋势。推测对于禾本科作物, 寡糖类对于种子成熟过程中发芽能力的形成发挥重要作用。寡糖的积聚可促进种子细胞玻璃化的形成或者在磷脂双分子层内作为水的替代物抑制相变的发生[38-39], 保护遭受脱水胁迫的种子。
本研究发现, 杂交水稻种子成熟过程中,64SHsp18.0和Os03g0267200小分子热激蛋白基因的相对表达量均在种子授粉后19 d急剧增加。值得注意的是, 授粉后 19 d种子的生活力与活力均趋于稳定, 推断64SHsp18.0和Os03g0267200小分子热激蛋白与杂交水稻种子活力形成有关。事实上, 杂交水稻种子成熟过程也是逐渐脱水的过程, 快速脱水会对细胞产生一定的渗透压力。Wehmeyer等[16]发现拟南芥种子发育过程遭遇脱水胁迫, sHSPs表达量急剧上升至最高水平。小热激蛋白(sHSPs)还是植物响应逆境及发育信号合成的一类低分子量(15~30 kD)热激蛋白, 研究发现高温逆境条件下水稻种子成熟过程中垩白的发生率与sHSP的表达量有关[40]。有研究发现, 逆境条件下, 转入热激蛋白基因的植株光合系统稳定性较非转基因植株高[41]。不过小热激蛋白基因是如何调控种子发育与活力的, 还有待进一步研究。
4 结论
杂交水稻Y两优689制种过程, 授粉后19~34 d的种子, 生活力与活力均较高, 授粉后 19 d种子,蔗糖、棉子糖、水苏糖的含量以及 64S Hsp18.0和Os03g0267200基因的相对表达量均达最大值。同时种子成熟过程中千粒重、含水量、蔗糖、棉子糖和水苏糖等物质含量以及64S Hsp18.0和Os03g0267200基因的相对表达量均与其生活力和活力显著相关, 可用于判断成熟过程中种子的发芽潜力。
以国际文化活动提升艺术品格。基于国际化现代城市的建设定位和年轻多元的市民结构,以优质品牌活动打造为突破口,办好“荷兰郁金香大乐团音乐会”“亚历山大室内乐团中西室内乐作品音乐会”“卓别林电影原声音乐会”等文化演出,丰富市民的国际文化视野和时尚选择。
References
[1]王仁祥, 曹文亮, 肖层林, 谢建华.株 1 S杂交组合制种不同收获期种子贮藏特性研究.种子, 2008, 27(12)∶ 101-104 Wang R X, Cao W L, Xiao C L, Xie J H.Study on seed storage in different harvesting dates of Zhu 1 S hybrid rice combinations.Seed, 2008, 27(12)∶ 101-104 (in Chinese)
[2]周建明, 林一波, 何建华, 沈雪林, 戴华军, 吴锡清.不同收获期和贮藏时间对杂交粳稻种子活力的影响.种子, 2010,29(10)∶ 98-101 Zhou J M, Lin Y B, He J H, Shen X L, Dai H J, Wu X Q.Effects of different harvest date and storage time on seed vigor of hybrid japonica.Seed, 2010, 29(10)∶ 98-101 (in Chinese)
[3]Fussell L K, Pearson C J.Effects of grain development and thermal history on grain maturation and seed vigour of Pennisetuma mericanum.J Exp Bot, 1980, 31∶ 635-643
[4]Cao D D, Hu J, Huang X X, Wang X J, Guan Y J, Wang Z F.Relationships between changes of kernel nutritive components and seed vigor during development stages of F1seeds of sh2sweet corn.J Zhejiang Univ-Sci B, 2008, 9∶ 964-968
[5]孟庆立, 关周博, 冯佰利, 柴岩, 胡银岗.谷子抗旱相关性状的主成分与模糊聚类分析.中国农业科学, 2009, 42∶2667-2675 Meng Q L, Guan Z B, Feng B L, Chai Y, Hu Y G.Principal component analysis and fuzzy clustering on drought-tolerance related traits of foxtail millet (Setaria italica).Sci Agric Sin,2009, 42∶ 2667-2675 (in Chinese with English abstract)
[6]黄先晖, 杨远柱, 姜孝成.水稻种子脱水耐性的形成及其与贮藏特性的关系.种子, 2010, 29(7)∶ 25-29 Huang X H, Yang Y Z, Jiang X C.Studies on the formation of desiccation tolerance and the correlation with storage of Oryza sativa L.seeds.Seed, 2010, 29(7)∶ 25-29 (in Chinese with English abstract)
[7]Harrington J F.Seed storage and longevity.In∶ Kozlowski T T,ed.Seed Biology.New York∶ Academic Press, 1972.pp 145-245
[9]Demir I, Samit Y.Seed quality in relation to fruit maturation and seed dry weight during development in tomato.Seed Sci Technol, 2001, 29∶ 453-462
[10]Demir I, Mavi K, Oztokat C.Changes in germination and potential longevity of watermelon (Citrullus lanatus) seeds during development.New Zeal J Crop Hortic, 2004, 32∶139-145
[11]Blackman S A, Obendorf R L, Leopold A C.Maturation proteins and sugars in desiccation tolerance of developing soybean seeds.Plant Physiol, 1992, 100∶ 225-230
[12]Gorecki R J, Lahuta L B, Jones A D, Hedley C L.Soluble sugar in maturing pea seeds of different lines in relation to desiccation tolerance.In∶ Black M, Bradford K J, Vazquezramos J, eds.Seed Biology∶ Advances and Applications.Proceedings of the Sixth International Workshop on Seeds.Merida, Mexico, 1999.CABI,2000.pp 67-74
[13]Baud S, Boutin J P, Miquel M, Lepiniec L, Rochat C.An integrated overview of seed development in Arabidopsis thaliana ecotype WS.Plant Physiol Biochem, 2002, 40∶ 151-160
[14]Wehmeyer N, Vierling E.The expression of small heat shock proteins in seeds responds to discrete developmental signals and suggests a general protective role in desiccation tolerance.Plant Physiol, 2000, 122∶ 1099-1108
[15]Neta-sharir I, Isaacson T, Lurie S, Weiss D.Dual role for tomato heat shock protein 21∶ protecting photosystem II from oxidative stress and promoting color changes during fruit maturation.Plant Cell, 2005, 17∶ 1829-1838
[16]Sarkar N K, Kim Y K, Grover A.Rice sHsp genes∶ genomic organization and expression profiling under stress and development.BMC Genomics, 2009, 10∶ 393
[17]Zou J, Liu C F, Liu A L, Zou D, Chen X B.Overexpression of OsHsp17.0 and OsHsp23.7 enhances drought and salt tolerance in rice.J Plant Physiol, 2012, 169∶ 628-635
[18]Chauhan H, Khurana N, Agarwal P, Khurana P.Heat shock factors in rice (Oryza sativa L.)∶ genome-wide expression analysis during reproductive development and abiotic stress.Mol Genet Genomics, 2011, 286∶ 171-187
[19]Tian Y X, Li Z, He F, Guan Y J, Zhu S J, Hu J.A novel anti-counterfeiting methods∶ application and decomposition of RB for broad bean seeds (Vicia faba L.).Ind Crop Prod, 2014,61∶ 278-283
[20]Bailly C, Audigier C, Ladonne F, Ladonne F, Wagner M H,Coste F, Corbineau F, CômeD.Changes in oligosaccharide content and antioxidant enzyme activities in developing bean seeds as related to acquisition of drying tolerance and seed quality.J Exp Bot, 2001, 52∶ 701-708
[21]Zheng Y Y.Hu J, Xu S C, Guan Y J, Wang X J.Relationship between polyamine changes in embryos of maize and seed imbibitional chilling tolerance.Seed Sci Technol, 2009, 37∶ 59-69
[22]刘信.水稻种子耐干性机理和超干种子贮藏稳定性的研究.浙江大学硕士学位论文, 浙江杭州2003 Liu X.Studies on the Mechanism of Ultra-drying Tolerance of Rice Seed and Storage Stability of Ultra-dried Seed.MS Thesis of Zhejiang University, Hangzhou, China, 2003 (in Chinese)
[23]肖层林, 刘爱民, 张海清, 肖晓, 余雪晴.中国杂交水稻制种技术的进步与发展方向.杂交水稻, 2010, (增刊1)∶ 46-50 Xiao C L, Liu A M, Zhang H Q, Xiao X, Yu X Q.Progress and developing direction of hybrid rice seed production technology in china.Hybrid Rice, 2010, (suppl-1)∶ 46-50 (in Chinese)
[24]王业文, 张莹, 靳西彪, 魏毅, 朱建清.抗穗萌药剂组合的筛选及其抑制种子发芽的同功酶电泳研究.种子, 2008, 27(8)∶18-21 Wang Y W, Zhang Y, Jin X B, Wei Y, Zhu J Q.The selection of inhibitor combination to inhibit pre-harvest sprouting in rice and study on eletrophoretic analysis.Seed, 2008, 27(8)∶ 18-21 (in Chinese with English abstract)
[25]朱丽伟.杂交水稻种子成熟过程活力、生理生化和耐藏力的变化及脱水剂应用效果的研究.浙江大学博士学位论文, 2015 Zhu L W.Changes of Vigor, Physiology, Biochemistry and Storability during Hybrid Rice Seed Maturity and the Effect of Dehydrating Agent Application.PhD Dissertation of Zhejiang University, Hangzhou, China, 2015 (in Chinese with English abstract)
[26]樊廷录, 王淑英, 王建华, 杨珍.河西制种基地玉米杂交种种子成熟期与种子活力的关系.中国农业科学, 2014, 47∶2960-2970 Fan T L, Wang S Y, Wang J H, Yang Z.Relationship of days after pollination and vigor traits on maize seed maturity in Hexi seed production area in China.Sci Agric Sin, 2014, 47∶ 2960-2970 (in Chinese with English abstract)
[27]Steadman K J, Pritchard H W, Dey P M.Tissue-specific soluble sugars in seeds as indicators of storage category.Ann Bot-London,1996, 77∶ 667-674
[28]Obendorf R L.Oligosaccharides and galactosyls in seed desiccation tolerance.Seed Sci Res, 1997, 7∶63-74
[29]Heim U, Weber H, Baumlein H, Wobus U.A sucrose synthase gene of Vicia faba L.expression pattern in developing seeds in relation to starch synthesis and metabolic regulation.Planta, 1993, 191∶ 394-401
[30]Abid G, Muhovski Y, Jacquemin J M, Mingeot D, Sassi K, Toussaint A, Baudoin J.Characterization and expression profile analysis of a sucrose synthase gene from common bean (Phaseolus vulgaris L.) during seed development.Mol Biol Rep, 2012, 39∶1133-1143
[31]Ruan Y L, Liewellyn D J, Liu Q, Xu S M, Wu L M, Wang L,Furbank R T.Expression of sucrose synthase in the developing endosperm is essential for early seed development in cotton.Funct Plant Biol, 2008, 35∶ 382-393
[32]Angeles-Núñez J G, Tiessen A.Mutation of the transcription factor LEAFY COTYLEDON 2 alters the chemical composition of Arabidopsis seeds, decreasing oil and protein content, while maintaining high levels of starch and sucrose in mature seeds.J Plant Physiol, 2011, 168∶ 1891-1900
[33]陶月良, 朱诚.顽拗性板栗种子成熟前后褐变与可溶性糖的关系.农业工程学报, 2003, 19(4)∶ 201-204 Tao Y L, Zhu C.Relationship between browning and soluble sugar of recalcitrant seeds of chestnut in front of and behind maturation.Trans CSAE, 2003, 19(4)∶ 201-204 (in Chinese with English abstract)
[34]Obendorf R L, Zimmerman A D, Zhang Q Y, Castillo A, Kosina S M, Bryant E G, Sensenig E M, Wu J, Schnebly S R.Accumulation of soluble carbohydrates during seed development and maturation of low-raffinose, low-stachyose soybean.Crop Sci,2009, 49∶ 329-341
[35]李永红, 马颖敏, 许柏球, 赵梁军.巴拿马栗种子发育中可溶性糖变化与种子脱水耐性的关系.中国农业科学, 2009, 42∶2882-2891 Li Y H, Ma Y M, Xu B Q, Zhao L J.Relationship between dehydration tolerance and soluble sugars during seed development of Pachira macrocarpa.Sci Agric Sin, 2009, 42∶ 2882-2891 (in Chinese with English abstract)
[36]Sheila A B, Ralph L O, Leopold A C.Maturation proteins and sugars in desiccation tolerance of developing soybean seeds.Plant Physiol, 1992, 100∶ 225-230
[37]Lehner A, Bailly C, Flechel B, Poels P, Côme D, Corbineau F.Changes in wheat seed germination ability, soluble carbohydrate and antioxidant enzymes activities in the embryo during the desiccation phase of maturation.J Cereal Sci, 2006, 43∶ 175-182
[38]Koster K L, Leopold A C.Sugars and desiccation tolerance in seeds.Plant Physiol, 1988, 88∶ 829-832
[39]Crowe J H, Hoekstra F A, Crowe L M.Anhydrobiosis.Annu Rev,1992, 54∶ 579-599
[40]Lin S K, Chang M C, Tsai Y G, Lur H S.Proteomic analysis of the expression of proteins related to rice quality during caryopsis development and the effect of high temperature on expression.Proteomics, 2005, 5∶ 2140-2156
[41]郭鹏, 隋娜, 于超, 郭尚敬, 董新纯, 孟庆伟.转入甜椒热激蛋白基因CaHSP18提高番茄的耐冷性.植物生理学通讯,2008, 44∶ 409-412 Guo P, Sui N, Yu C, Guo S J, Dong X C, Meng Q W.CaHSP18.0 of sweet pepper enhanced chilling tolerance of transgenic tomato plants.Plant Physiol Commun, 2008, 44∶409-412 (in Chinese with English abstract)
DOI:10.3724/SP.J.1006.2016.00714
*通讯作者(
Corresponding author)∶ 胡晋, E-mail∶ jhu@zju.edu.cn**同等贡献(Contributed equally to this work)
收稿日期Received()∶ 2015-08-14; Accepted(接受日期)∶ 2016-03-02; Published online(网络出版日期)∶ 2016-03-11.
Soluble Oligosaccharide and Small Heat Shock Protein Correlated with Seed Germination and Vigor during Hybrid Rice Seed Maturation
ZHU Li-Wei1,2,**, CAO Dong-Dong3,**, FU Yu-Ying1, HU Qi-Juan1, LI Zhan1, GUAN Ya-Jing1, HU Wei-Min1, and HU Jin1,*
1Seed Science Center, College of Agriculture and Biotechnology, Zhejiang University, Hangzhou 310058, China;2Research Center of Buckwheat Industry Technology, Guizhou Normal University, Guiyang 550001, China;3Zhejiang Agriculture Science Limited Company, Hangzhou 310058,China
Abstract:To study the relationship between seed soluble oligosaccharide, small heat shock protein (sHSPs) and seed vigor, we systematically studied their changes during hybrid rice seed maturity.The mean fuzzy subordinate function values of germination percentage, germination energy, germination index, vigor index and mean germination time, root number, root length, shoot length and seedling weight were analyzed.The results indicated that seeds harvesting at 19 to 34 days after pollination (DAP) had a higher viability and vigor.The seed moisture content had a decline trend, with a decrease from 48.2% at 10 DAP to 23.9% at 22 DAP.The raffinose content increased significantly, the fructose content kept decreasing, the contents of stachyose and glucose significantly increased firstly and then decreased during seed development.The relative expression levels of 64SHsp18.0 and Os03g0267200 genes increased significantly from 10 to 19 DAP, and then decreased.The moisture content, the contents of raffinose, stachyose and sucrose, thousand seed weight of fresh seeds and dry seeds, relative transcriptions of 64SHsp18.0 and Os03g0267200 genes were all significantly correlated with seed germination during seed maturity.
Keywords:Hybrid rice; Seed; Maturity; sHSPs; Oligosaccharide; Vigor

