NOX 4对高糖代谢乳腺癌细胞侵袭转移能力的作用
李雪娜,尹雅芙,杜补林,李亚明
(中国医科大学附属第一医院 核医学科,辽宁 沈阳 110001)
NOX 4对高糖代谢乳腺癌细胞侵袭转移能力的作用
李雪娜,尹雅芙,杜补林,李亚明
(中国医科大学附属第一医院 核医学科,辽宁 沈阳110001)
摘要:利用2-氟[18F-2]脱氧葡萄糖([18F]fluorodeoxyglucose,18F-FDG)乳腺癌细胞摄取实验筛选高糖酵解率的乳腺癌细胞;采用基因沉默技术,降低细胞烟酰胺腺嘌呤二核苷酸磷酸氧化酶4 (NOX 4)表达;采用免疫印迹方法检测三组细胞(空白对照组、非特异性siRNA转染组和特异性NOX 4-siRNA转染组)的上皮间质转化(epithelial mesenchymal transition, EMT)相关分子HIF-1α和TGF-β表达水平;通过细胞侵袭实验分析三组细胞的侵袭能力差异。结果显示,高侵袭力的MDA-MB-231较低侵袭力的MCF-7乳腺癌细胞系具有高糖酵解率(t=10.52,P<0.05);抑制MDA-MB-231细胞的NOX 4表达,降低了细胞EMT相关因子HIF-1α、TGF-β表达(P均<0.01)与细胞侵袭能力(t=-8.0,P<0.01)。本研究初步证实NOX 4失活能够降低高糖代谢乳腺癌细胞的侵袭转移能力。
关键词:乳腺癌;氟18-脱氧葡萄糖;烟酰胺腺嘌呤二核苷酸磷酸氧化酶4;肿瘤转移
乳腺癌是威胁人类健康的主要疾病,肿瘤转移是导致乳腺癌患者死亡的重要原因,肿瘤细胞活性氧(reactive oxygenspecies, ROS)增加会影响肿瘤转移。烟酰胺腺嘌呤二核苷酸磷酸氧化酶4(nicotinamide adenine dinucleotide phosphate oxidase 4, NOX 4)由细胞内ROS产生,主要在成人和胎儿肾脏组织表达。在硬化发病过程中,NOX 4表达增高使ROS生成增高,引起平滑肌细胞凋亡[1];氧化的低密度脂蛋白能使动脉内皮细胞的NOX 4促进ROS生成[2]。NOX 4在不同肿瘤中表达并与肿瘤侵袭转移相关[3-7],包括乳腺癌[8]。NOX 4在肿瘤中的表达与肿瘤生物学行为相关性为研究热点[9-11],正常细胞生物能量主要依赖线粒体氧化磷酸化,肿瘤细胞能量主要依赖于有氧糖酵解,但NOX 4在高糖代谢肿瘤细胞转移中的作用尚不明确。近年来,肿瘤线粒体功能障碍与肿瘤生物学行为以及转移的关系越来越受关注。Kozie等[12]发现在内皮细胞年龄-衰老模型中,持续增高NOX 4活性能降低线粒体呼吸链复合物Ⅰ的功能。ROS被证实与肿瘤的增殖和侵袭相关,其产生重要来源是NOX 蛋白和线粒体。线粒体内的抗氧化剂在细胞中水平最高,并在维持细胞氧化还原状态发挥重要作用,在疾病情况下,NOX 蛋白能作用于线粒体而影响其氧化还原反应。NOX 蛋白主要定位于核周区和内质网,但也存在于质膜,并与线粒体有关[13-16]。Kelly等[17]应用线粒体定位信号(MLS)进行示踪分析,发现NOX 4蛋白的N端含有MLS,证明NOX 4定位于线粒体上。因此,NOX 4与肿瘤的能量代谢关系密切。
本研究通过18F-FDG 细胞摄取实验筛选出高糖代谢的乳腺癌细胞系,探究NOX 4对高糖代谢乳腺癌细胞侵袭转移能力的影响,为乳腺癌转移机制提供依据。
1实验部分
1.1主要材料
人乳腺癌细胞系(MDA-MB-231,MCF-7):中国科学院上海细胞库,细胞接种在含10%胎牛血清、10 U/mL青霉素和100 mg/L链霉素的DMEM培养液中,37 ℃,5% CO2环境下培养;NOX 4抗体:Abcam公司;兔抗人TGF-β单克隆抗体、多克隆抗体、HIF-1α兔抗人多克隆抗体:Cell signal公司;羊抗兔IgG-HRP、胰酶:碧云天公司;内参抗体 β-actin:WanLei Life Sciences公司;DMEM培养基:美国Invitrogen公司;胎牛血清:美国Hyclone公司;磷酸缓冲盐溶液(PBS):双螺旋公司;Transwell小室:美国Corning公司。
1.218F-FDG乳腺癌细胞摄取
按照参考文献[18]中方法,孵育MDA-MB-231和MCF-7乳腺癌细胞摄取18F-FDG。分为不同的细胞铺板密度组:1×105、2×105、5×105、1.0×106;不同的细胞孵育时间组:60、90、120、180 min。确定最佳细胞摄取实验条件,并筛选高糖酵解的乳腺癌细胞。
1.3siRNA干扰和细胞转染
根据siRNA设计原则,选取人NOX 4 RNA中的特异性核酸片段为靶目标,应用Ambion公司iRNA软件设计NOX 4的RNAi序列(上海吉玛基因化学技术有限公司合成)。实验分三组:空白对照组、非特异性siRNA转染组(NC)和特异性siRNA转染组(分三个siRNA序列进行特异性转染)。转染具体方法按照说明书进行。NOX 4 siRNA序列如下:
非特异性siRNA序列:5’-UUCUCCGAACGUGUCACGUTT-3’。
特异性NOX 4-siRNA序列:
1:5’-GCCUCAGCAUCUGUCUUATTUAAGAACAGAUGCUGAGGCTT-3’;
2:5’-CCCUCAACUUCUCAGUGAATTUUCACUGAGAAGUUGAGGGTT-3’;
3:5’-GCCUCUACAUAUGCAAUAATTUUAUUGCAUAUGUAGAGGCTT-3’。
1.4免疫印迹检测
胰酶消化细胞,离心(4 ℃、1 000 r/min、5 min),用PBS清洗细胞1次,加入适量M-PER细胞裂解液并吹打均匀,放置冰上裂解30 min,期间间隔混匀,离心(4 ℃、12 000 r/min、15 min),取上清液,弃去沉淀的细胞碎片。根据二喹啉甲酸(bicinchoninic acid, BCA)试剂盒的说明,测定裂解液蛋白浓度。
参照参考文献[19] 中免疫印迹(Western blot)检测方法,以β-actin作为内参对照,提取细胞总蛋白进行检测,检测三组细胞(空白对照组、非特异性siRNA转染组和特异性NOX 4-siRNA转染组)的HIF-1α、TGF-β、NOX 4蛋白表达水平。实验中一抗为NOX 4抗体(1∶1 000)、HIF-1α(1∶2 000)和TGF-β(1∶2 000);二抗为羊抗兔IgG-HRP(1∶5 000)。
1.5细胞侵袭实验
实验Matrigel胶4 ℃过夜解冻,将Matrigel置冰上后放入超净台,用无血清培养基将胶以1∶2稀释,下室加入800 μL 30% FBS培养液;上室加入200 μL细胞悬液,细胞数为每孔2×104个。置于37 ℃、5% CO2、饱和湿度条件下培养24 h。0.5%结晶紫染液染色5 min,在倒置显微镜下(200×)对迁移至微孔膜下层的细胞计数。
1.6统计分析

2实验结果
2.118F-FDG 细胞摄取

图1 MCF-7细胞的18F-FDG摄取率Fig.1 18F-FDG uptake rates of MCF-7 cells
MCF-7和MDA-MB-231在不同细胞铺板密度,不同18F-FDG孵育时间下18F-FDG放射性摄取率分别示于图1、图2。相同细胞摄取实验条件下(90 min孵育时间、1.0×106细胞计数),MDA-MB-231放射性摄取率为(32.37±0.81)%ID/g,高于MCF-7的(15.49±5.08)%ID/g,差异具有显著性(t=10.52,P<0.05)。因此,筛选出高糖酵解乳腺癌细胞系为MDA-MB-231。
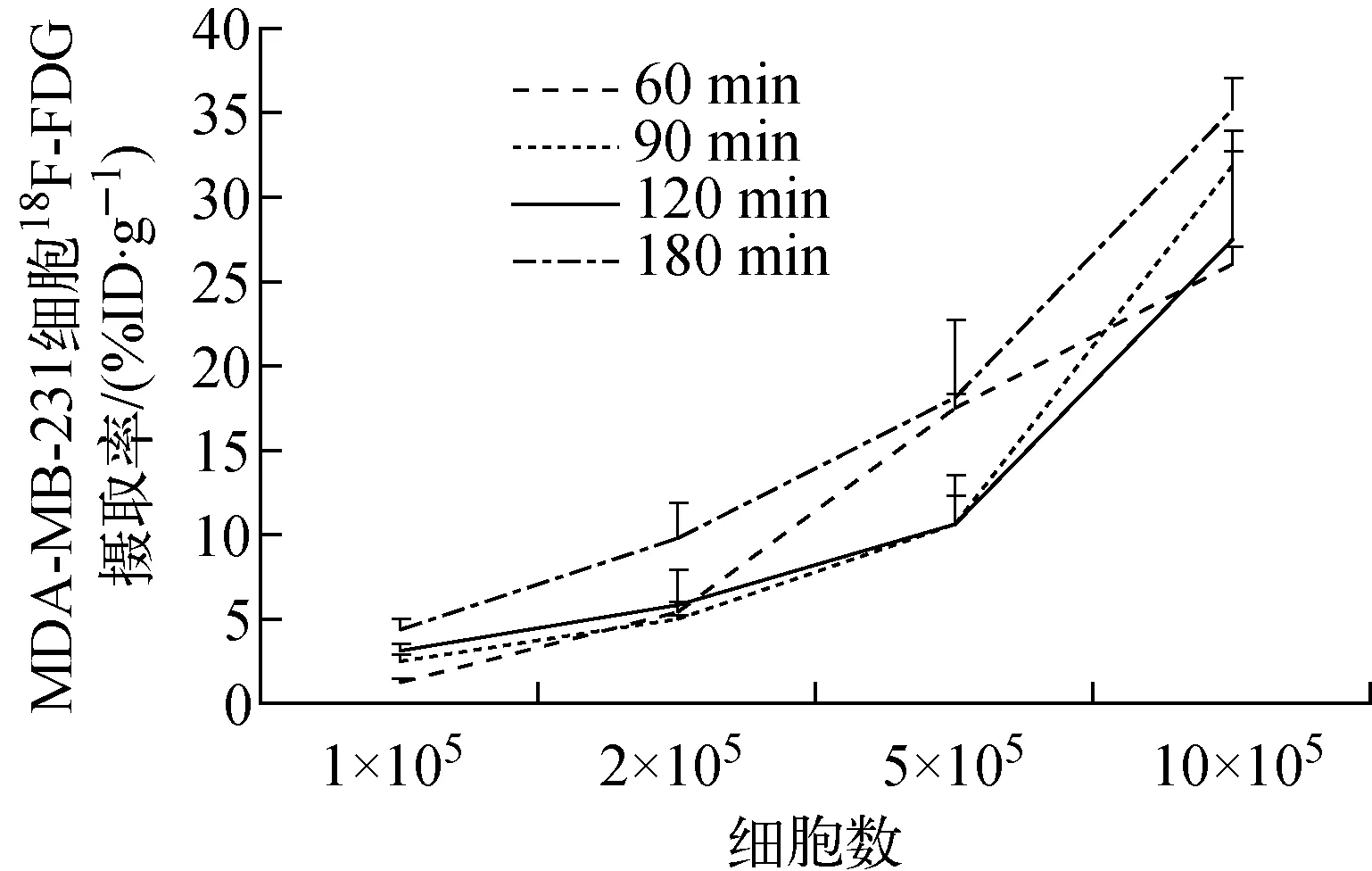
图2 MDA-MB-231细胞的18F-FDG摄取率Fig.2 18F-FDG uptake rates of MDA-MB-231 cells
2.2NOX 4 siRNA 瞬时转染
应用三个siRNA序列进行特异性转染MDA-MB-231细胞,分为MDA-MB-231细胞、NC细胞、NOX 4-siRNA-1细胞、NOX 4-siRNA-2细胞、NOX 4-siRNA-3细胞。
不同特异性siRNA转染后MDA-MB-231乳腺癌细胞的NOX 4表达示于图3。由图3可知,进行siRNA-2序列转染后,MDA-MB-231细胞NOX 4 表达下降,筛选出NOX 4基因沉默效率高的为siRNA-2细胞系。

图3 不同乳腺癌细胞NOX 4表达Fig.3 Expression of NOX 4in different breast cancer cells
验证siRNA-2转染MDA-MB-231细胞系的NOX 4基因表达沉默效率,分为MDA-MB-231细胞、NC细胞、转染的NOX 4 siRNA-2细胞。
不同细胞系的NOX 4表达示于图4,Western blot的灰度定量分析示于图5。结果显示,siRNA-2序列转染后的MDA-MB-231细胞NOX 4 表达下降,与未转染的MDA-MB-231相比具有显著性差异(P<0.01);NC细胞NOX 4表达与未转染的MDA-MB-231相比无显著性差异(P=0.76)。
2.3Western blot检测
不同细胞的HIF-1α与TGF-β表达示于图6,HIF-1α与TGF-β Western blot 灰度定量分析示于图7。结果表明,特异性siRNA转染组细胞HIF-1α蛋白和TGF-β表达低于未转染MDA-MB-231(P均<0.01),NC细胞HIF-1α和TGF-β表达与MDA-MB-231相比无显著性差异(P=0.158,P=0.821),表明特异性siRNA转染抑制NOX 4表达,降低了乳腺癌细胞的上皮间质转化(epithelial mesenchymal transition, EMT)水平。
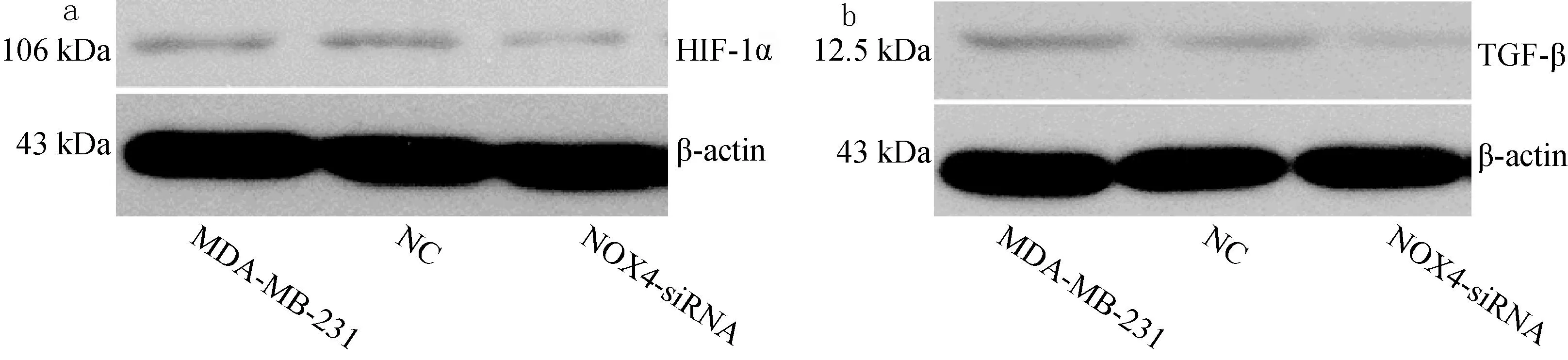
a——HIF-1α;b——TGF-β图6 不同细胞的HIF-1α与TGF-β表达a—HIF-1α;b—TGF-βFig.6 Expression of HIF-1α and TGF-β in different breast cancer cells
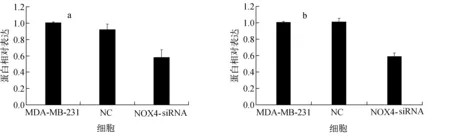
a——HIF-1α;b——TGF-β图7 HIF-1α与TGF-β Western blot 灰度定量分析a——HIF-1α;b——TGF-βFig.7 HIF-1α and TGF-β quantitative analysis of gray scale of Western blot
2.4细胞侵袭
细胞侵袭结果示于图8,定量分析示于图9。结果显示,特异性转染NOX 4-siRNA MDA-MB-231细胞侵袭数较未转染MDA-MB-231细胞侵袭数显著性降低(分别为38.6±4.5vs94.6±11.1,t=-8.0,P<0.01),非特异性转染组NC细胞与未转染MDA-MB-231细胞侵袭数相比无显著性差异(分别为94.00±13.5vs94.6±11.1,t=-0.06,P=0.71)。

a——MDA-MB-231;b——NC;c——NOX 4-siRNA图8 细胞侵袭显微镜图(200×)a——MDA-MB-231;b——NC;c——NOX 4-siRNAFig.8 The microscope chart of invasion experimental
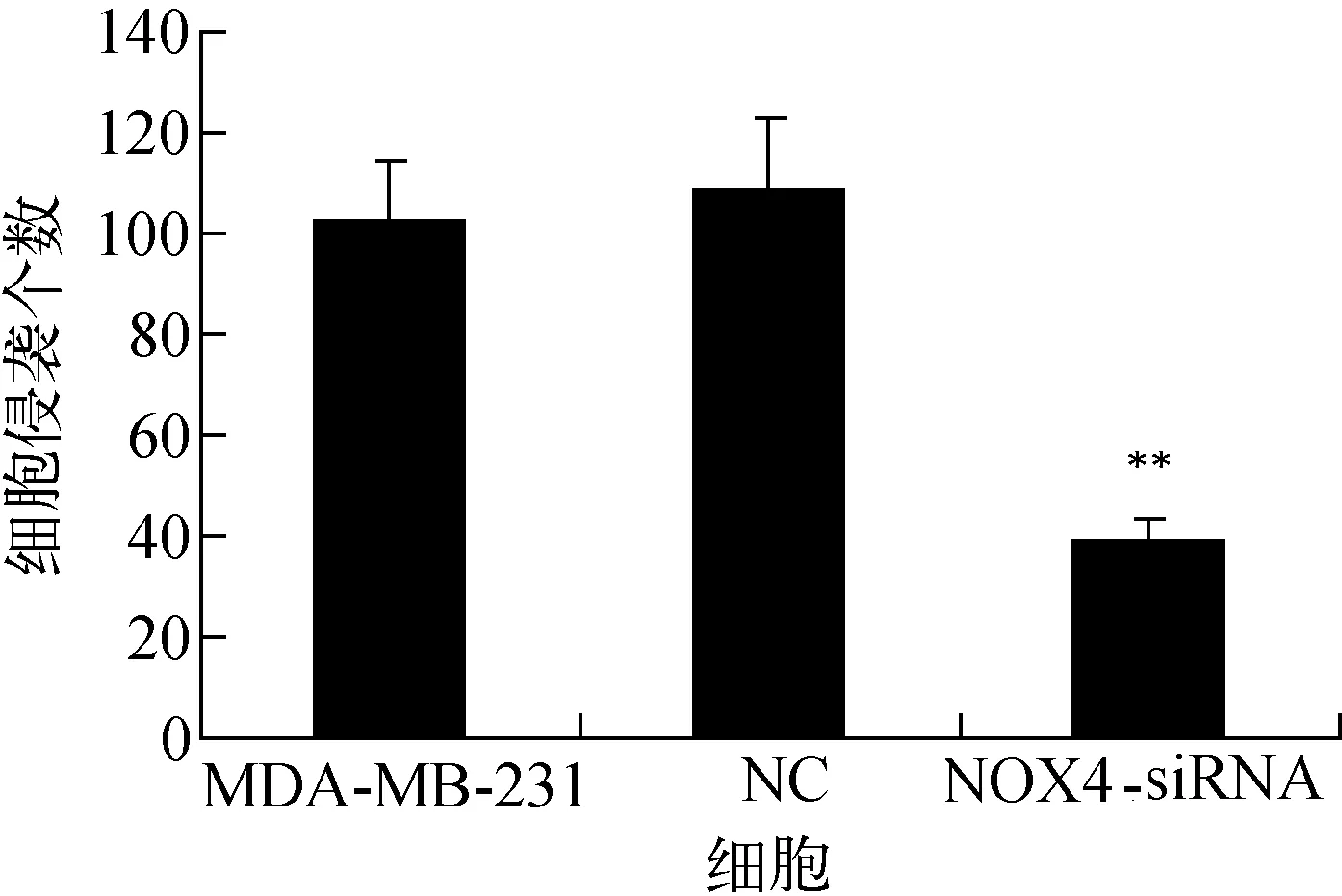
图9 细胞侵袭实验的定量分析Fig.9 Quantitative analysis of cell invasion assay
3讨论
肿瘤转移发生后,通过破坏细胞间的连接、活化金属蛋白酶改变间质环境、激活与细胞运动能力相关的Rho通路而获得更强的细胞迁徙能力。研究引发EMT的机制对于治疗肿瘤转移具有重要意义。采用免疫印迹方法检测细胞EMT相关分子HIF-1α和TGF-β表达水平,结果显示,特异性siRNA转染组较对照组乳腺癌细胞HIF-1α、TGF-β表达降低,与Boudreau 等[20]报道的NOX 4依赖ROS产生诱导乳腺癌MDA-MB-231的EMT结果一致。有研究报道,NOX 4通过参与TGF-β和SMAD3驱动诱导的肿瘤发生侵袭[21],TGF-β通过Smad转录作用直接增加NOX 4蛋白的表达量而使ROS升高;但也有研究提出,EGF因子的加入能抑制TGF-β引起的FAO细胞NOX 4蛋白量升高,但并不能影响Smad的磷酸化水平[22]。
细胞侵袭实验结果显示,特异性siRNA转染组较对照组乳腺癌细胞的迁徙能力明显下降,表明在高糖代谢乳腺癌细胞中,NOX 4失活能降低高糖代谢乳腺癌细胞MDA-MB-231的HIF-1α和TGF-β的表达,抑制乳腺癌细胞的侵袭能力,NOX 4可能是高糖代谢乳腺癌细胞转移治疗的重要靶点。
4小结
通过摄取实验筛选出高糖酵解乳腺癌细胞系MDA-MB-231;NOX 4-siRNA 瞬时转染实验筛选出沉默效率高的NOX 4-siRNA-2特异性转染组细胞系,siRNA-2序列转染后MDA-MB-231细胞NOX 4 表达下降,HIF-1α、TGF-β表达降低,乳腺癌细胞MDA-MB-231细胞侵袭数显著性降低。
参考文献:
[1]Eric P, Cécile G, Véronique O, et al. NADPH oxidase NOX 4 mediates 7-ketocho-lesterol-induced endoplasmic reticulm stress and apoptosis in human artic smooth muscle cells[J]. Mol Cell Biol, 2004, 24(24): 10 703-10 717.
[2]Thum T, Borlak J. Mechanistic role of cytochrome P450 monooxy-genases in oxidized low-density lipoprotein induced vascular injury: therapy through LOX-1 receptor antagonism[J]. Circ Res, 2004, 94(1): e1-13.
[3]Weyemi U, Caillou B, Talbot M, et al. Intracellular expression of reactive oxygen species-generating NADPH oxidase NOX 4 in normal and cancer thyroid tissues[J]. Endocr Relat Cancer, 2010, 17(1): 27-37.
[4]Xia C, Meng Q, Liu L Z, et al. Reactive oxygen species regulate angiogenesis and tumor growth through vascular endothelial growth factor[J]. Cancer Res, 2007, 67(22): 10 823-10 830.
[5]Shimada K, Fujii T, Anai S, et al. ROS generation via NOX 4 and its utility in the cytological diagnosis of urothelial carcinoma of the urinary bladder[J]. BMC Urol, 2011, 11: 22.
[6]Cai T, Kuang Y, Zhang C, et al. Glucose-6-phosphate dehydrogenase and NADPH oxidase 4 control STAT3 activity in melanoma cells through a pathway involving reactive oxygen species, c-SRC and SHP2[J]. Am J Cancer Res, 2015, 5(5): 1 610-1 620.
[7]Kim H J, Magesh V, Lee J J, et al. Ubiquitin C-terminal hydrolase-L1 increases cancer cell invasion by modulating hydrogen peroxide generated via NADPH oxidase 4[J].Oncotarget, 2015,6(18): 16 287-16 303.
[8]Juhasz A, Ge Y, Markel S, et al. Expression of NADPH oxidase homologues and accessory genes in human cancer cell lines, tumours and adjacent normal tissues[J]. Free radical research, 2009, 43(6): 523-532.
[9]Bauer K M, Watts T N, Buechler S, et al. Proteomic and functional investigation of the colon cancer relapse-associated genes NOX 4 and ITGA3[J]. J Proteome Res, 2014, 13(11): 4 910-4 918.
[10]Zhang C, Lan T, Hou J, et al. NOX 4 promotes non-small cell lung cancer cell proliferation and metastasis through positive feedback regulation of PI3K/Akt signaling[J].Oncotarget, 2014, 5(12): 4 392-4 405.
[11]Choi J A, Jung Y S, Kim J Y, et al. Inhibition of breast cancer invasion by TIS21(/BTG2/Pc3)-Akt1-Sp1-Nox4 pathway targeting actin nucleators, mDia genes[J].Oncogene, 2016, 35(1): 83-93.
[12]Antonio F, Akemi M, Melissa R, et al. Mitochondrial complex I activity and NAD+/NADH balance regulate breast cancer progression[J]. J Clin Invest, 2013, 123(3): 1 068-1 081.
[14]Hilenski L L, Clempus R E, Quinn M T, et al. Distinct subcellular localizations of Nox1 and Nox4 in vascular smooth muscle cells[J]. Arterioscler Thromb Vasc Biol, 2004, 24(4): 677-683.
[15]Block K, Gorin Y, Abboud H E. Subcellular localization of Nox4 and regulation in diabetes[J]. Proc Natl Acad Sci USA, 2009, 106(34): 14 385-14 390.
[16]Kuroda J, Nakagawa K, Yamasaki T, et al. The superoxide-producing NAD(P)H oxidase Nox4 in the nucleus of human vascular endothelial cells[J]. Genes Cells, 2005, 10(12): 1 139-1 151.
[17]Kelly A, Graham M, Mariola K M, et al. NADPH oxidase 4 is an oncoprotein localized to mitochondria[J]. Cancer Biol Ther, 2010, 10(3): 223-231.
[18]王利利,秦颂兵,娄成,等.18F-FDG摄取率评价肿瘤细胞辐射效应[J]. 核技术,2011,34(3):222-226.
Wang Lili, Qin Songbing, Lou Cheng, et al. Evaluation of radiation effect on tumor cells by the uptake rate18F-FDG in vitro[J]. Nuclear Techniques, 2011, 34(3): 222-226(in Chinese).
[19]Wen Y Y, Yang Z Q, Song M, et al. The expression of SIAH1 is downregulated and associated with Bim and apoptosis in human breast cancer tissues and cells[J]. Mol Carcinog, 2010, 49(5): 440-449.
[20]Boudreau H E, Casterline B W, Rada B, et al. Nox4 involvement in TGF-beta and SMAD3-driven induction of the epithelial-to-mesenchymal transition and migration of breast epithelial cells[J]. Free Radic Biol Med, 2012, 53(7): 1 489-1 499.
[21]Biao Z, Zhen L. Inhibiting cancer metastasis via targeting NAPDH oxidase 4[J]. Biochemical Pharmacology, 2013, 86(2): 253-266.
[22]Carmona-Cuenca I, Herrera B, Ventura J J, et al. EGF blocks NADPH oxidase activation by TGF-P in fetal rat hepatocytes, impairing oxidative stress, and cell death[J]. Journal of Cellular Physiology, 2006, 207(2): 322-330.
Effect of NOX 4 on the Invasion and Metastasis of Breast Cancer Cells with High Glucose Metabolism
LI Xue-na, YIN Ya-fu, DU Bu-lin, LI Ya-ming
(DepartmentofNuclearMedicine,theFirstHospitalofChinaMedicalUniversity,Shenyang110001,China)
Abstract:The breast cancer cells with high glucose metabolism were screened by18F-FDG cell uptake experiment. The gene silencing technique was used to reduce NOX 4 expression in cells. The experiment was divided into three groups: control group, the non-specific transfection group and specific transfection group. Western blotting was used to detect differences in the expression of HIF-1α and TGF-β in three groups. The invasion ability of the three groups by transwell cell invasion assay was analyzed. The results showed that MDA-MB-231 breast cancer cells had a higher rate of glycolysis than MCF-7 tumor cells(t=10.52,P<0.05). The expression of HIF-1α and TGF-β and the invasiveness of cells were reduced by inhibiting the level of NOX 4. This study showed that inhibition of NOX 4 expression was able to inhibit the invasion of breast cancer cell with high glucose metabolism.
Key words:breast cancer;18F- FDG; nicotinamide adenine dinucleotide phosphate oxidase 4; tumor metastasis
收稿日期:2015-12-30;修回日期:2016-02-14
基金项目:国家自然科学基金(81271605);辽宁省科学技术计划项目 (2012225013)
作者简介:李雪娜(1980—),女,辽宁盘锦人,主治医师,核医学专业 通信作者:李亚明,E-mail: ymli2001@163.com
中图分类号:R817.1
文献标志码:A
文章编号:1000-7512(2016)02-0076-06
doi:10.7538/tws.2016.29.02.0076

