南京地区1株猪伪狂犬病毒的分离与鉴定
常 晨,张道华,唐 波,刘国阳,华 涛,侯继波
(江苏省农业科学院 国家兽医生物制品工程技术中心,江苏 南京 210000)
南京地区1株猪伪狂犬病毒的分离与鉴定
常 晨,张道华*,唐 波,刘国阳,华 涛,侯继波
(江苏省农业科学院 国家兽医生物制品工程技术中心,江苏 南京 210000)
摘要:于2013年从南京某猪场送检发病仔猪脏器中分离获得1株病毒。病样组织液上清经BHK细胞分离培养后,利用PCR和间接免疫荧光反应进行鉴定,PCR可以扩增出PRVgE基因的全长片段,且在间接免疫荧光检测中呈现阳性荧光反应。将命名为NJ株的分离病毒接种家兔,被接种的家兔很快出现瘙痒、死亡等伪狂犬病症状。与以往发表的伪狂犬病毒gE基因序列比对及进化树分析结果显示,分离株属于一个相对独立的分支。由中国兽药监察所提供的伪狂犬病阳性血清对分离株有一定的中和能力。根据实验结果推测,南京某猪场流行的伪狂犬病毒存在一定的抗原变异。
关键词:猪;伪狂犬病病毒;分离;鉴定;gE基因
伪狂犬病毒(Pseudorabies virus, PRV)属于疱疹病毒科、甲型疱疹病毒亚科。由伪狂犬病毒引起的以发热、奇痒(猪除外)及脑脊髓炎为主要症状的疾病称为伪狂犬病(Pseudorabies, PR)[1]。猪是PRV的主要贮存宿主及疫源动物[1-2]。猪伪狂犬病常引起妊娠母猪繁殖功能障碍和初生仔猪的神经症状,仔猪感染率和死亡率极高[3]。早年欧洲一些国家采用大规模接种gE缺失疫苗的DIVA国家根除计划战略,使PRV在一些地区的猪场消失[4]。在这些缺失疫苗株中应用最广泛的是匈牙利的Bartha株,我国大多规模化猪场也采用该弱毒疫苗株。但近年来,许多使用弱毒疫苗免疫的规模化猪场出现了疑似伪狂犬病毒感染的症状,主要表现为猪群gE抗体阳性率显著升高,母猪产死胎[5]。尤其是2011年底,大规模的伪狂犬疫情在许多使用弱毒疫苗免疫的猪场暴发[6-9],现有疫苗不能完全防控伪狂犬病的流行,伪狂犬病防控形势依然严峻。目前,已有科研人员从发病猪体内分离出抗原变异的伪狂犬毒株[6,9]。本研究对南京地区1个疑似发生猪伪狂犬病的猪场病料进行了伪狂犬病毒的分离、鉴定,旨在为该病毒的进一步研究提供材料,也为我国猪伪狂犬病的诊断和防治提供参考。
1材料与方法
1.1病料与病毒株
病料来源于南京某发病猪场,该猪场接种PRV基因缺失弱毒疫苗,出现疑似伪狂犬病症状。对送检的病死新生仔猪,取其脾、肾、脑等组织进行研磨及冻融,离心后将上清液分装,于-20 ℃下保存。PRV毒株ZC株为本实验室保存。
1.2实验试剂及实验动物
LA TaqDNA聚合酶、dNTP、MgCl2、2×GC Buffer I、pMD18-T Vector、DL 2000 DNA Marker购于TAKARA宝生物工程(大连)有限公司。FITC标记的羊抗豚鼠抗体、胎牛血清(fetal bovine serum, FBS)和DMEM培养基为Invitrogen公司产品。用于病毒分离的BHK 21细胞由本实验室保存,以含10% FBS的DMEM培养。伪狂犬病阳性血清参考品由中国兽医药品监察所提供。伪狂犬豚鼠阳性血清为本实验室保存。其他各种试剂均为分析纯试剂。2只健康家兔购自南京江宁青龙山动物繁殖场。
1.3引物
参照GenBank中PRV Becker株的全基因组序列(GenBank: JF797219),设计了针对gE基因的1对引物: gE-F/gE-R,用于扩增gE全长基因序列。引物均由上海英骏生物工程有限公司合成,引物序列如表1。

表1 用于PRV病毒鉴定和gE基因扩增的引物
1.4病毒核酸的提取及PCR
分别取研磨后的病料和反复冻融的实验室对照毒株PRV ZC株,按常规方法提取DNA。PCR反应体系: DNA模板5 μL、dNTP(各2.5 mmol/L)8 μL、上下游引物各1 μL、2×GC Buffer I 25 μL、LA Taq酶0.5 U,加去离子水补充至总体积50 μL。PCR程序为:94 ℃预变性5 min;94 ℃变性1 min,63 ℃退火1 min,72 ℃延伸2 min,共30个循环;最后72 ℃延伸10 min。用1%琼脂糖凝胶电泳,在紫外灯光下观察扩增结果。
1.5PCR产物的克隆与序列分析
将PCR扩增产物经胶回收纯化后,克隆至pMD18-T载体上,将经过鉴定的阳性重组质粒送上海英骏生物工程有限公司进行测序。利用NCBI BLAST对PRVgE核苷酸序列进行比对。从GenBank中提取所提交的大部分gE基因全序列作为参考序列,并构建系统进化树。
1.6病毒分离与增殖
将PCR鉴定结果为阳性的病料组织研磨液以12000 r/min离心15 min,上清经0.22 μm滤器过滤后,取500 μL接种至长势良好的单层BHK 21细胞,在37 ℃孵育1 h后换成含2%胎牛血清的DMEM培养液,置37 ℃培养箱中培养,每隔12 h观察1次细胞病变情况。
1.7提取DNA与PCR鉴定
待70%左右的细胞发生病变时收获病毒液,取上清,继续接种单层BHK 21细胞。传代2次之后,取细胞上清液提取DNA,用PCR方法再次鉴定。
1.8病毒含量测定
待96孔细胞板上的BHK 21细胞长成单层,取病毒液进行10倍梯度稀释,稀释倍数为10~108倍,每个稀释度接种6孔,每孔0.1 mL,同时设正常细胞对照。置于37 ℃、5%二氧化碳培养箱中培养。每日观察细胞病变情况,共观察3~5 d,计算TCID50,参照Reed-Muench法计算分离毒的TCID50。
1.9间接免疫荧光检测(Indirect fluorescence assay, IFA)
用分离的病毒接种96孔板中的BHK 21细胞,同时设立正常细胞对照及接种PRV ZC株的阳性对照。在接种约24 h后弃培养液,用PBS洗涤2遍后待其干燥,用预冷的无水乙醇在4 ℃下固定1 h,弃乙醇,用PBS洗涤。将实验室保存的伪狂犬豚鼠阳性血清100倍稀释液加入96孔板中,每孔加入50 μL,在37 ℃下孵育1 h,弃血清,用PBS洗涤;每孔加入50 μL经2000倍稀释的FITC标记的羊抗豚鼠抗体,在37 ℃下孵育1 h,弃二抗,用PBS洗涤;最后置荧光显微镜下观察。
1.10易感动物接种试验
取2只健康成年家兔,在颈背部肌肉处注射病毒细胞培养液(107.5TCID50/mL)2 mL/只;同时取1只健康成年家兔,注射正常细胞培养物,作为对照。观察、记录家兔的发病情况;在实验结束后解剖试验组的家兔,采集脏器并分离病毒,提取核酸并进行PCR。对所有接触物品及动物尸体进行无害化处理。
1.11血清中和指数的测定
采用固定血清稀释病毒法测定正常豚鼠血清和伪狂犬病阳性血清参考品对病毒Bathar k61、ZC株和NJ株的中和抗体效价,操作参照阳性血清参考品使用说明书。将抗血清在56 ℃下灭活30 min后进行30倍稀释。对病毒按10倍进行系列稀释,取10~106倍共6种稀释液,分别与事先灭活并作30倍稀释的血清等体积混合,再置于37 ℃下作用1 h;然后每个稀释度分别接种已长满单层BHK 21的96孔细胞培养板4孔,每孔200 μL,在37 ℃下培养3~6 d,每日观察细胞病变情况,计算毒株的中和指数。
2结果与分析
2.1PCR鉴定与序列分析结果
对研磨后的病料和病毒对照PRV ZC株分别提取总DNA,用gE的特异性引物进行PCR检测,结果如图1所示。病料与PRV ZC株都扩增出gE的特异性片段,长度为1731 bp,与预期的目的片段相同。这表明仔猪存在PRV感染,由于该猪场使用的疫苗株缺失gE基因,gE基因阳性表明感染的PRV为野毒株。分离株与ZC株的gE全长基因重组质粒经HindIII和EcoRI双酶切后均释放出大小约为1700 bp的片段,证明目的片段与pMD18-T Vector正确重组,结果如图2所示。利用NCBI BLAST对PRVgE核苷酸序列进行比对,结果显示分离的病毒株与PRV经典株Becker株的相似性为94%。为了分析PRV-NJ株gE基因的遗传演化,将其与GenBank中的参考毒株HB-HS(KC415028.1)、HB-BD(KC415026.1)、HB-LF(KC415029.1)、HB-HD(KC415027.1)、LXB88(GQ926933.1)、LXB6(GQ926932.1)、GDSH(EF552427.1)、Ea(AF171937.1)、Min-A(AY170318.1)、HNJZ(EU561349.1)、LA(AY173124.1)、Guizhou-DY(JX417716.1)、P-PrV(FJ176390.1)、gp63(M14336.1)、Becker(JF797219.1)、NiA3(EU502923.1)、Nia-1(FJ605136.1)、CL-15(JF460026.1)、Kaplan(JF797218.1)、75V19(FJ605133.1)、NS374(FJ605135.1)、00V72(FJ605132.1)、89V87(FJ605134.1)及GZ-Z1(HQ832846.1)的gE基因的部分核苷酸序列进行同源性比较,并构建了系统进化树,这包括中国分离株和国外分离株。利用ClustalW方法对PRVgE核苷酸序列进行比对,结果如图3所示。从图3中可以发现:NJ株位于gE基因的进化树上一个相对独立的分支中,而与以前的分离株的亲缘关系较远。
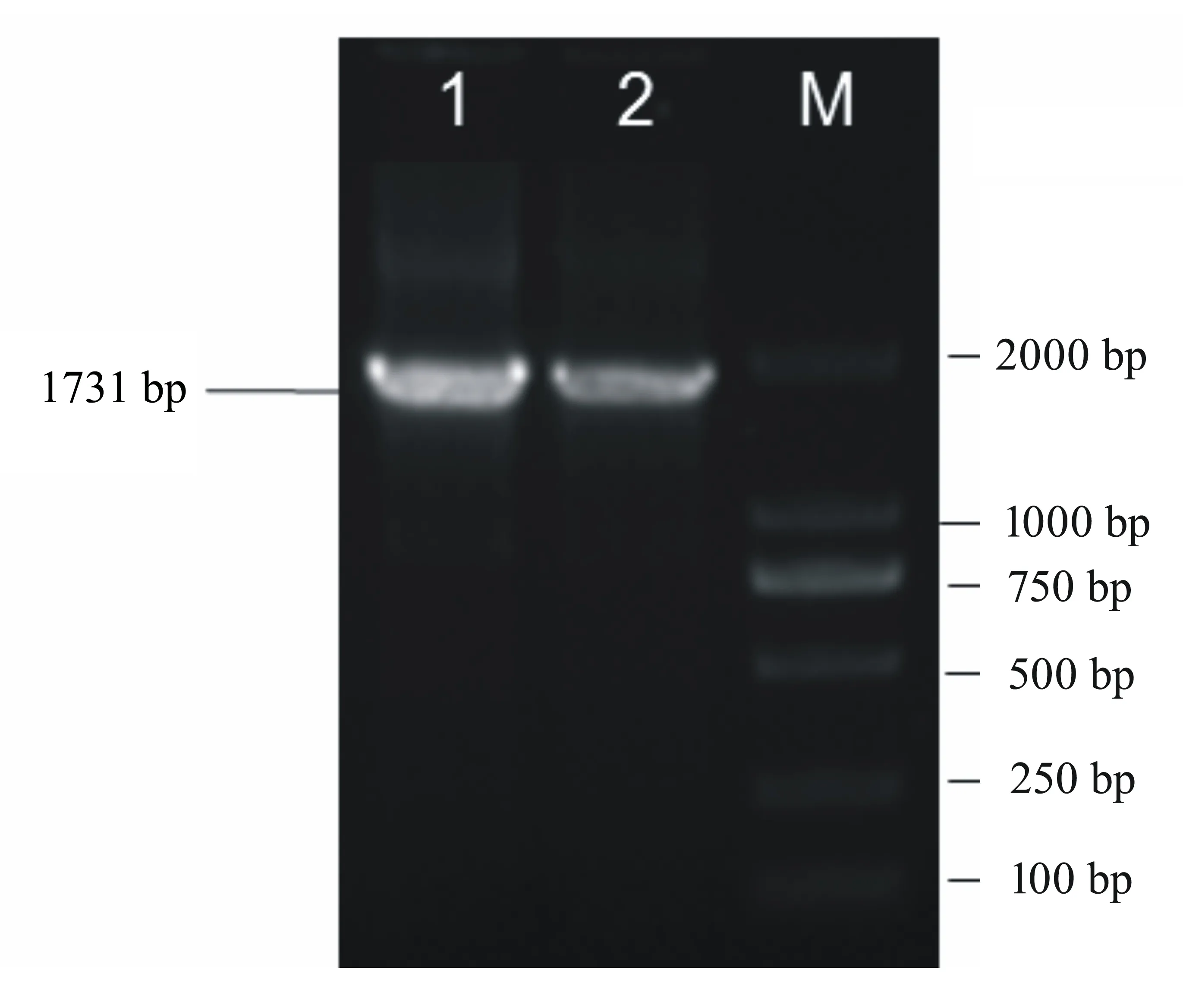
1: PRV ZC株;2:阳性病料; M: DL 5000。
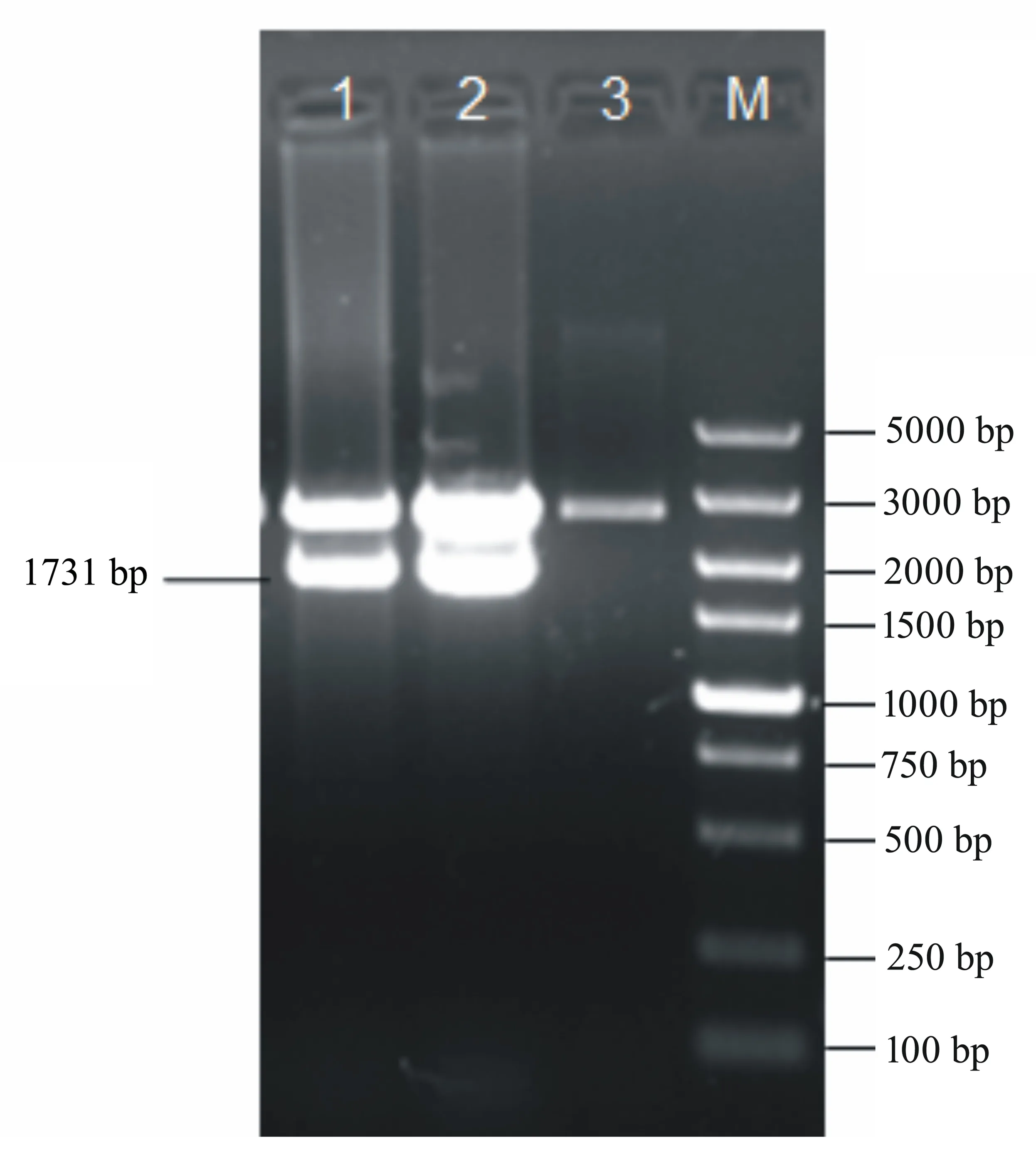
1:阳性病料重组质粒酶切鉴定;
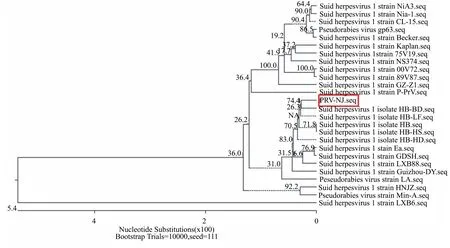
图3 PRV-NJ株gE基因的进化树分析结果
2.2病毒分离与细胞病变的观察结果
将研磨后的病料上清过滤除菌后接种BHK 21细胞,培养48 h后出现聚集、变圆、脱落,有的形成合胞体;而正常的对照细胞无病变(图4)。
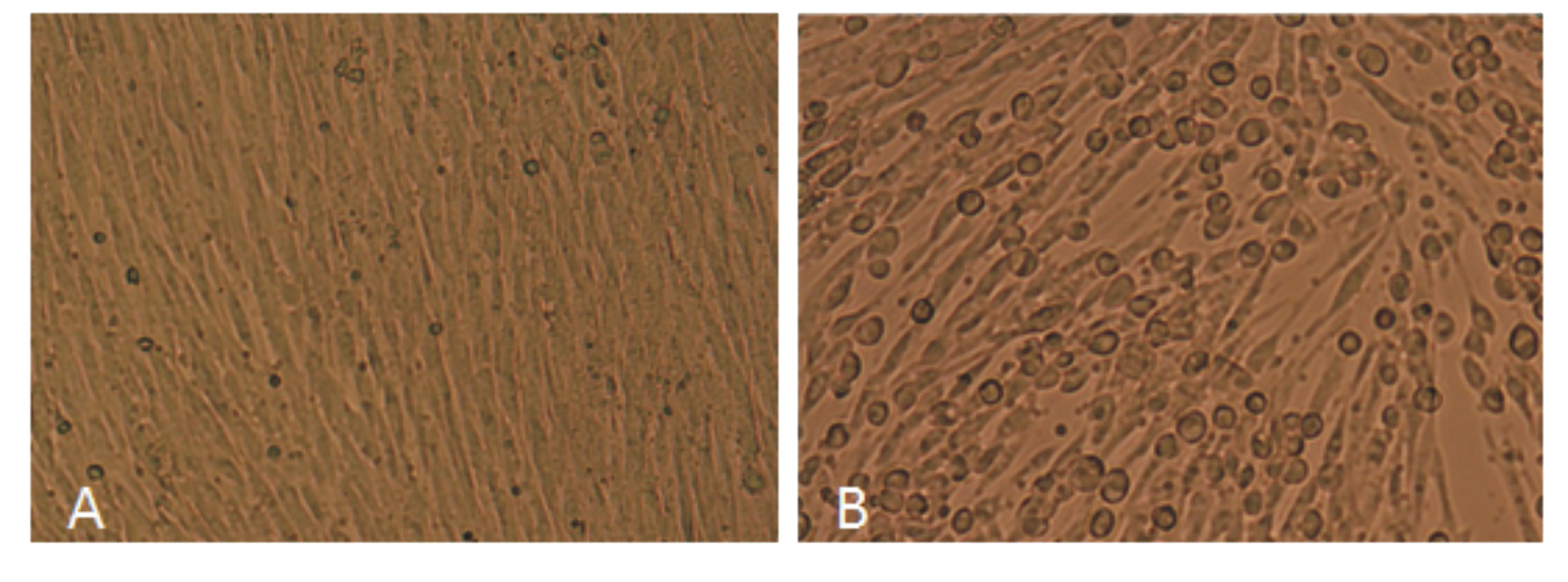
A:对照BHK 21细胞; B:病料上清感染的BHK 21细胞。
2.3病毒含量的测定结果
分别取10~108倍的病毒稀释液接种96孔板中的BHK 21细胞,观察每日细胞病变情况,计算出分离株在BHK 21细胞上的TCID50值为107.5/mL。
2.4间接免疫荧光检测鉴定结果
分离病毒株与PRV ZC株(阳性对照)感染BHK 21细胞后,用伪狂犬豚鼠阳性血清的100倍稀释液作IFA检测,结果如图5。由图5可见,病毒感染细胞能与PRV阳性血清作用,产生荧光,同时病毒阳性对照成立,正常细胞对照无荧光。这证实分离的病毒确为PRV。
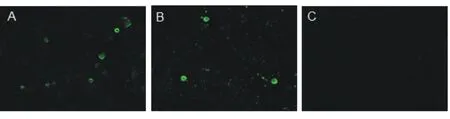
A:伪狂犬分离株; B: PRV ZC株; C:细胞对照。
2.5兔体接种试验结果
注射病毒细胞培养物后24 h,试验组家兔开始兴奋不安,食欲下降;40 h左右出现呼吸急促、不断用嘴啃或用爪抓接种部位的现象,接种部位被毛脱落、皮肤潮红、出血,暴露出红色肌肉;至48 h试验组家兔四肢麻痹倒地,角弓反张,抽搐而死,而对照组家兔表现正常(见图6)。解剖试验组的家兔,采集脏器并分离病毒,提取核酸并进行PCR,结果证实分离的病毒为伪狂犬病毒。
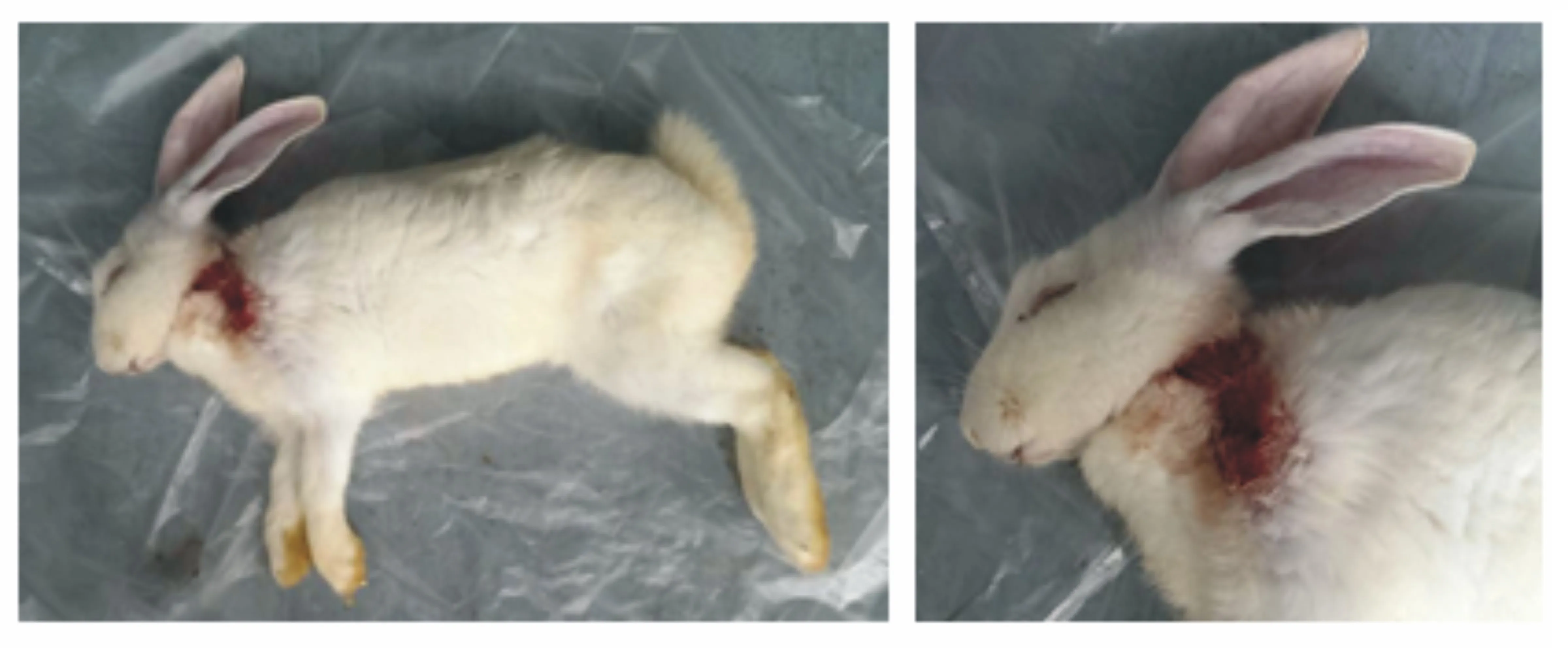
图6 试验组的家兔
2.6血清中和指数测定结果
将Bathar k61、NJ株及ZC株做10~106倍梯度稀释,分别与等量正常豚鼠血清(30倍稀释)及伪狂犬病阳性血清参考品(30倍稀释)混合作用,接种BHK 21细胞。中和实验结果(表2)表明, PRV阳性血清对分离株病毒有一定的中和能力。
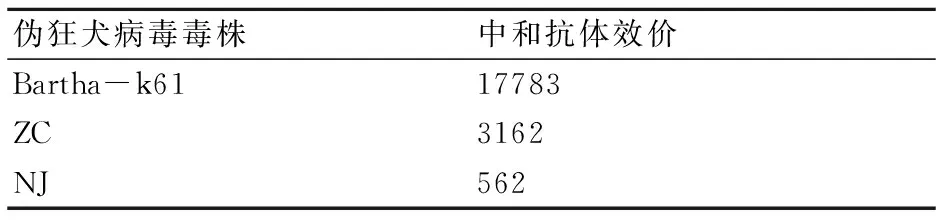
表2 伪狂犬阳性血清参考品中和
3讨论
我国目前对伪狂犬病的防治主要依靠接种基因缺失疫苗。PRV Bartha-k61株疫苗是常用的基因缺失疫苗,应用该疫苗很好地控制了PR[10-11]。但近年来不断有规模化养猪场发生伪狂犬病流行,浙江地区6个规模化猪场猪伪狂犬病血清学调査结果显示:猪群gE抗体阳性率偏高,猪场存在因PRV野毒感染所致的仔猪发病,而使用的疫苗不能提供完全的保护[12]。基因组分析结果显示,伪狂犬新分离野毒株的一些病毒蛋白与经典毒株有所不同。动物试验结果表明, Bartha-k61不能提供对新分离野毒株的完全保护[6]。
本实验室从南京某猪场送检的仔猪组织中检测出PRV野毒,该猪场接种PRV Bartha k61疫苗。通过对分离株gE基因进行测序并与GenBank中登录的相应序列进行比对,我们发现本实验分离的PRV-NJ株在一个相对独立的分支中。与以前的分离株相比,当前的流行株有一定程度的变异,这些变异株可能是导致疫苗免疫失败的原因。但新分离的毒株是否形成一个新的流行毒株还有待更多的分子流行病学数据来验证。本文血清中和试验结果显示,伪狂犬阳性血清对NJ分离株有一定的中和能力,但不及其对Bartha-k61的中和能力。新分离的病毒株与之前的毒株之间在抗原性方面存在一定的差异,现有疫苗株对NJ分离株的免疫保护效果还有待通过动物试验来进一步验证。
参考文献:
[1] 殷震,刘景华.动物病毒学[M].第2版.北京:科学出版社,1997:700-713.
[2] 斯特劳 B E,阿莱尔 S D,蒙加林W L,等.猪病学[M].第8版.北京:中国农业大学出版社,2000:195-196.
[3] Müller T, Klupp B G, Freuling C, et al. Characterization of pseudorabies virus of wild boar origin from Europe[J]. Epidemiol Infect, 2010, 1-11.
[4] Mettenleiter T C, Ehlers B, Müller T, et al. Herpesviruses (Aujeszky’s disease virus, porcine cytomegalovirus, porcine lymphotropic her-pesviruses, malignant catarrhal fever virus) [J]. Diseases of Swine, 2012, 412-444.
[5] 孔德江,何晓玲,易栋,等.规模化猪场猪伪狂犬病的筛查与防控[J].中国兽医学报,2009,10(5):75-77.
[6] An T Q, Peng J M, Tian Z J, et al. Pseudorabies virus variant in Bartha-K61-vaccinated pigs, China, 2012[J]. Emerg Infect Dis, 2013, 19(11): 1749-1755.
[7] Wang C H, Yuan J, Qin H Y, et al. A novelgE-deleted pseudorabies virus (PRV) provides rapid and complete protection from lethal challenge with the PRV variant emerging in Bartha-K61-vaccinated swine population in China[J]. Vaccine, 2014, 32(27): 3379-3385.
[8] Wu R, Bai C, Sun J, et al. Emergence of virulent pseudorabies virus infection in Northern China[J]. J Vet Sci, 2013, 14(3): 363.
[9] Yu X, Zhou Z, Hu D, et al. Pathogenic pseudorabies virus, China, 2012[J]. Emerg Infect Dis, 2014, 20(1): 102-104.
[10] Klupp B G, Lomniczi B, Visser N, et al. Mutations affecting theUL21 gene contribute to avirulence of pseudorabies virus vaccine strain Bartha[J]. Virology, 1995, 212(2): 466-473.
[11] 童光志,陈焕春.伪狂犬病流行现状及我国应采取的防制措施[J].中国兽医学报,1999,19(1):1-2.
[12] 文昌清.浙江6个规模化猪场伪狂犬病血清学调查及3种伪狂犬疫苗免疫比较试验[D].南京:南京农业大学,2011:26-31.
(责任编辑:黄荣华)
Separation and Identification of A Strain of Porcine Pseudorabies Virus in Nanjing Area
CHANG Chen, ZHANG Dao-hua*, TANG Bo, LIU Guo-yang, HUA Tao, HOU Ji-bo
(National Veterinary Biological Product Engineering and Technology Research Center,Jiangsu Academy of Agricultural Sciences, Nanjing 210000, China)
Abstract:A virus was isolated from affected piglet of Nanjing city in 2013. The tissue supernatant was inoculated to BHK 21 cells, a pair of primers specific for PRVgEwas designed and used to amplify the corresponding DNA segments by PCR, the infected cells showed positive reaction with PRV antibodies in IFA. The rabbit infected with this isolate appeared the symptoms of pseudorabies. Sequence alignments ofgEindicated thatgEgene belonged to a relatively independent sub-branch in phylogenetic analysis. The positive serum of pseudorabies provided by Chinese Veterinary Drug Supervisory Institute had a certain ability to neutralize the separated strain. In conclusion, the prevalence of PRV might has antigenic variation.
Key words:Pig; Porcine pseudorabies virus; Separation; Identification;gEgene
收稿日期:2015-11-19
基金项目:江苏省农业科技自主创新基金项目[CX(11)2047];江苏省农业支撑计划(BE2012370)。
作者简介:常晨(1987─),女,江苏南京人,研究实习员,硕士,从事动物疫苗产品研究工作。*通讯作者:张道华。
中图分类号:S858.28
文献标志码:A
文章编号:1001-8581(2016)06-0082-05

