1Dx5高分子量麦谷蛋白亚基研究进展
温亮 龙小玲 靳晓杰
摘要 综述了1Dx5亚基的基因序列、高级结构、分子标记、氨基酸序列一级、二级结构的研究进展以及在小麦品质改良中的应用,以期为更高效地运用1Dx5亚基提高小麦品质提供理论依据。
关键词 小麦;高分子量麦谷蛋白亚基;1Dx5;品质改良
中图分类号 S512.1 文献标识码 A 文章编号 0517-6611(2016)05-149-03
Abstract This study summarizes the research of 1Dx5 subunit on gene sequence, molecular marker, deduced amino acid sequence, secondary structure, and its application in wheat quality improvement, so as to provide theoretical basis for improving wheat quality by effective use of 1Dx5 subunit.
Key words Wheat; HMWGS; 1Dx5; Quality improvement
小麦储藏蛋白中,麦谷蛋白与小麦面包品质密切相关。麦谷蛋白按照分子量的大小分为高分子量麦谷蛋白亚基和低分子量麦谷蛋白亚基,其中高分子量麦谷蛋白亚基主要决定生面团的黏弹特性[1]。小麦中HMWGS编码基因定位于1A、1B和1D染色体的长臂上,靠近着丝点9 cM处,分别命名为GluAl 、GluBl 和GluDl[2]。每个位点含有2个编码不同类型紧密连锁的高分子量谷蛋白基因(X型和Y型)。在SDS-PAGE中,同一位点编码的X型高分子量谷蛋白亚基比Y型高分子量谷蛋白亚基具有较低的迁移速度[3]。
Glu1A、Glu1B和Glu1D相互之间没有连锁关系,但Glu1A 、Glu1B和Glu1D每一个位点内的2个基因紧密连锁;即Glu1Ax与 Glu1Ay紧密连锁,Glu1Bx与Glu1By紧密连锁,Glu1Dx与Glu1Dy紧密连锁。每一个小麦品系都表达一组特定的高分子量谷蛋白亚基,该特定的高分子量谷蛋白亚基组成在MALDITOFMS质谱分析中表现出几个特定的峰值或在SDSPAGE中表现为特定的谱带类型[3-4]。理论上,普通小麦在Glu1位点共有6个高分子量谷蛋白编码基因,编码6种高分子量谷蛋白亚基;但因一些基因的沉默(如1Ay基因),一般小麦表达4~5种高分子量谷蛋白亚基。普通小麦中大部分1Ay基因都是沉默的。
普通小麦及其近缘种中Glu1位点遗传多态性较高,存在广泛的等位变异。Payne等[5]报告了19种高分子量谷蛋白基因类型,在GluA1位点有3种类型,GluB1位点有11种类型,GluD1位点有6种等位基因类型。1Dx5+1Dy10,1Dx2+1Dy12是GluD1位点常见类型,其中1Dx5+1Dy10为优质亚基[6-7]。目前因为1Dx5亚基在小麦品质遗传改良中的重要作用,该亚基成为研究最多的亚基之一[8-13]。笔者综述了1Dx5亚基在基因序列、分子标记、氨基酸序列一级、二级结构的研究结果以及在小麦品质改良等方面的应用,为更高效地运用1Dx5亚基提高小麦品质提供理论依据。
1 1Dx5亚基编码基因克隆及其结构特点
目前高分子量麦谷蛋白亚基基因克隆方法主要有2种:文库克隆法[14-15]和ASPCR法[16]。文库克隆法运用一段HMWGS基因序列为探针筛选gDNA或cDNA文库,从而得到靶基因序列,然后再将靶基因序列连到合适的载体进行下一步测序。文库克隆法需要构建基因组文库,工作量较大,技术要求较高、成本高。ASPCR法克隆高分子量麦谷蛋白亚基基因则克服了文库克隆法的缺点,具有工作量较小、技术要求较低、成本较低的优点。ASPCR法克隆主要依靠已经克隆的HMWGS编码基因序列,利用HMWGS基因两端序列高度保守的特点,在序列两端的保守区域设计特异引物,通过PCR技术直接从基因组或者cDNA中扩增目的基因片段,后将扩增的目的片段连接到测序载体进行后续研究。
Anderson等[16]运用文库克隆法首次从普通小麦品种Cheyenne中得到1Dx5亚基基因全序列(X12928)。1Dx5亚基基因开放阅读框以及上下游序列全长8 463 bp,编码序列为3 899~6 445 bp,长度为2 547 bp,编码一条含849个氨基酸的亚基。起始密码子ATG上游为启动子区,TATAbox 核心序列为TATAAAA,位于起始密码子上游-91~-85 bp 处。另外,启动子区还发现与CCAAATbox类似的序列,分别是位于起始密码子上游-334~-330 bp以及-234~-230 bp处的CCAAT和-476~-473 bp以及-119~-116 bp处的CCAT。与所有高分子量麦谷蛋白基因相同,1Dx5中不含有内含子。1Dx5亚基基因开放阅读框的序列长为2 547 bp,分成4个区域:信号肽区域,一个无重复的5′末端区域,一个有高度重复碱基的中间区域和一个无重复的3′末端区域。从起始密码子ATG开始的一段63 bp序列,为编码一段21个氨基酸的信号肽序列。该信号肽在蛋白亚基成熟过程中被切除。5′末端序列长度为258 bp,中间重复区域长度为2 043 bp,3′端的无重复区域长度为126 bp。1Dx5基因在起始密码子ATG位点下游2 543~2 548 bp处含有2个紧密相连的终止密码子TGATAG。同时,在第1个终止密码子下游51 bp处为一个6 bp的PolyA信号序列(AATAAA)。
2 1Dx5亚基的氨基酸序列特征
亚基1Dx5成熟肽共有827个氨基酸残基,推导的相对分子量为88 127 Da。成熟的肽链包括3个基本区域:一个N末端区域,由89个氨基酸残基;一个高度重复的中间区域,由696个氨基酸残基组成;一个由42个氨基酸残基组成的C末端区域 。中央重复区域主要由多拷贝的三肽(一致序列GQQ)、六肽(一致序列PGQGQQ)和九肽(一致序列GYYPTSPQQ)构成。六肽和九肽都存在于x和y型亚基中,三肽仅存在于x型亚基中[16]。中央重复区域中共有三肽22个,六肽72个,九肽19个。1Ax1亚基的N端非重复区域具有3个半胱氨酸残基(Cys),C端非重复区域有1个半胱氨酸残基。
不同于其他x型亚基的是1Dx5中央重复区域还含有1个半胱氨酸残基,研究者认为这个半胱氨酸残基是导致1Dx5亚基成为优质亚基的重要因素[6]。1Dx5亚基中的半胱氨酸残基通过巯基于链内形成二硫键,或与其他高分子量麦谷蛋白亚基或低分子量麦谷蛋白亚基作用形成链间二硫键,赋予面团黏弹特性[17-18]。
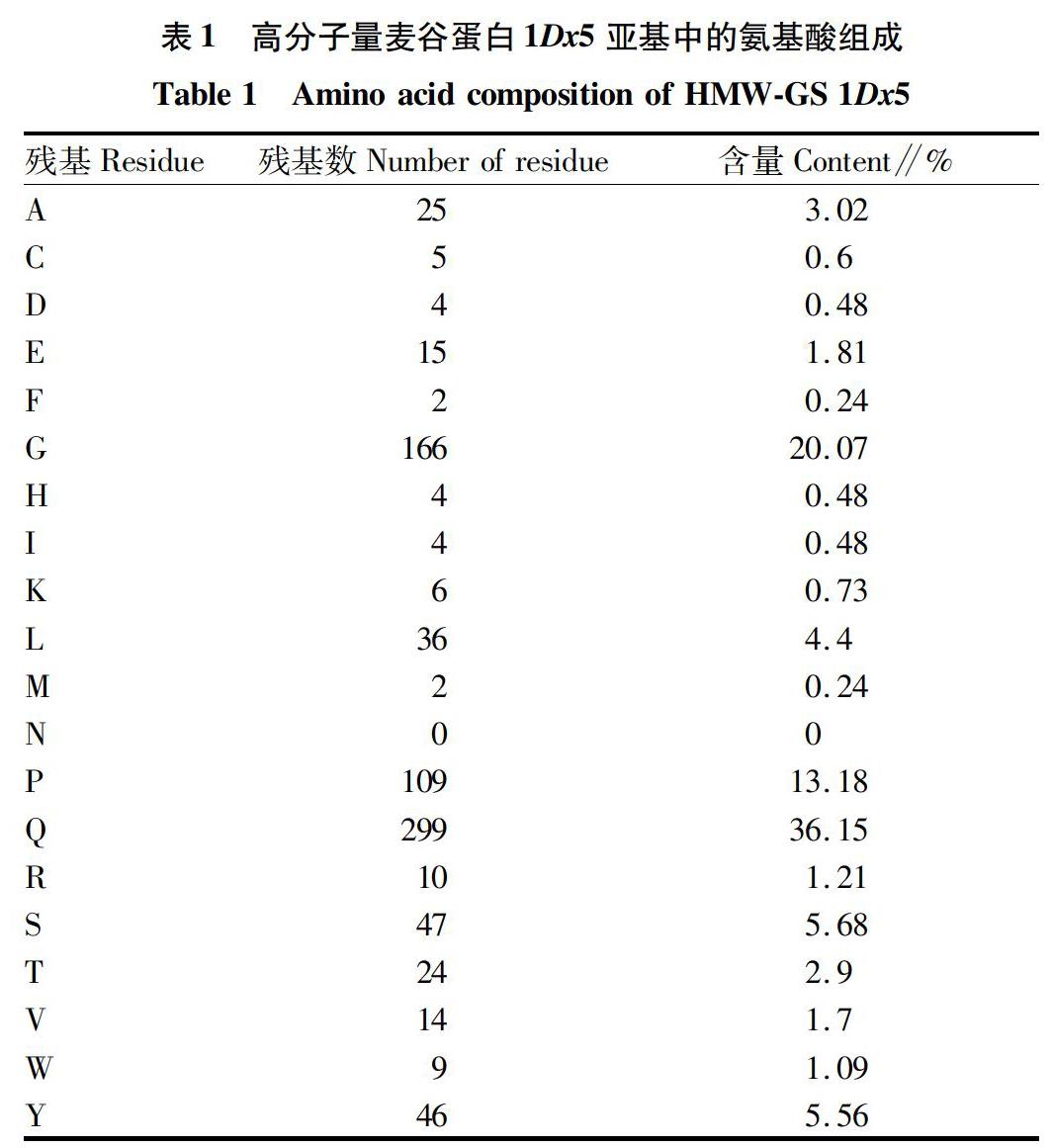
1Dx5亚基氨基酸序列含有丰富的谷氨酰胺(36.2%)、甘氨酸(20.1%)和脯氨酸(12.8%);由20种氨基酸中的19种组成(不含有天冬酰胺)(表1)。谷氨酰胺残基主要分布在三肽序列的2、3位,六肽序列的3、5和6位,九肽序列的8和9位。研究显示,高分子量麦谷蛋白亚基中谷氨酰胺的含量可影响小麦面筋的强度[19-20]。具有高谷氨酰胺含量的蛋白亚基可以在谷蛋白亚基之间形成更多的氢键,维持蛋白多聚体的结构。1Dx5亚基中丝氨酸、谷氨酰胺、苏氨酸、酪氨酸和甘氨酸都是极性氨基酸,易溶于水,可以在分子间形成氢键,维持面筋中蛋白多聚体的结构。
3 1Dx5亚基高级结构分析
Tatham等[21]运用圆二色光谱和计算机软件相结合分析了面筋蛋白的构造,对高分子量麦谷蛋白亚基的N末端和C末端结构预测表明,这些区域富含a螺旋。Van Dijk等[22]运用圆二色光谱、傅氏转换红外线光谱分析仪和核磁共振证明在1Dx5亚基的PGQGQQ和GYYPTSPQQ基序中存在β转角。其中Ⅱ型β转角发生在线性序列PGQGQQPGQGQQ的QPGQ处,Ⅰ型β转角分别发生在GYYPTSPQQGA、PGQGQQGYYPTSPQQ的YPTS、SPQQ处。且在GYYPTSPQQ GA、PGQGQQGYYPTSPQQ的GAGY、QQGY处发现Ⅰ型和Ⅱ型β转角。Miles等[23]运用扫描隧道电镜分析品种Bidi中纯化的单个1Bx20亚基,结果表明亚基中的PGQGQQ、GYYPTSPQQ可以形成重复的有规则的β转角,这些β转角继而形成β螺旋的超级结构。1Dx5和1Bx20氨基酸序列中央重复区域都具有相似的PGQGQQ、GYYPTSPQQ基序,据此推测,1Dx5亚基中的PGQGQQ、GYYPTSPQQ可能形成重复的有规则的β转角,这些β转角继而形成β螺旋的超级结构。
Gilbert等[24]在大肠杆菌中表达了1Dx5亚基的103~643位氨基酸序列(分子量为58 ku),该序列对应1Dx5亚基中央重复区域,经纯化后,运用傅里叶变换红外光谱法分析其水合行为,发现1Dx5亚基可以形成具有黏弹性的大聚体,而分子量为58 ku的亚基之间可形成黏性更强但没有弹性的大聚体。1Dx5亚基在烷基化和非烷基化2种状态下都不溶于水,而58 ku的亚基在烷基化和非烷基化2种状态下都溶于水。这表明1Dx5亚基的N末端和C末端结构对1Dx5亚基的水化作用起重要作用。
Wang等[25]利用PSIPRED 软件,预测了1Dy10、1Dy12、1Dx2、1Dx5等亚基的蛋白二级结构,发现1Dx5亚基中a螺旋的含量为6.6%,共为8个,分别有4个位于N末端和C末端;β折叠股的含量为1.5%,共为3个,其中2个位于N末端,1个位于C末端。
4 1Dx5亚基基因分子标记的开发
采用SDSPAGE鉴定小麦高分子量谷蛋白亚基的组成,但SDSPAGE法不能区分迁移速率非常接近的不同亚基,且只能用收获后的小麦子粒为材料进行鉴定,不利于试验的加速进行。研究者根据不同亚基基因序列的特点,开发出一系列高分子量谷蛋白亚基分子标记来区分不同亚基。
因为1Dx5和1Dy10基因紧密连锁,1Dx2和1Dy12基因紧密连锁,Smith等[26]设计了3对共显性标记区分1Dy10和1Dy12两个基因,从而间接区分1Dx2和1Dx5基因。Dovidio 等[27]根据1Dx2和1Dx5基因之间的SNP和Indel分布情况,在 1Dx5基因起始密码子上下游各200 bp处设计了一对引物,可以扩增450 bp的片段,在其他含有1Dx2、1Dx3、1Dx4、1Dx2.2基因的多个小麦品种中都不能扩增出条带,证实了该标记的可用性。Ahmad[28]首次将多重PCR技术运用于区分1Dx2+1Dy12、1Dx5+1Dy10基因,结果表明,两对引物在一次PCR反应结果可以区分1Dx2、1Dy12、1Dx5、1Dy10四个基因。Radovanovic等[29]依据1Dx5基因序列特点,设计了一对显性标记引物(Dx5F384、Dx5R655)在1Dx5基因可以扩增一条272 bp的片段,从而区分1Dx5和1Dx2基因。Ma等[30]也在1Dx5基因上设计了一对特异扩增一条478 bp的显性标记,这对标记和另外两对标记可以联合在一个PCR反应中同时检测区分1Ax2*与1Ax1,1Bx17与非1Bx17,1Dx5与非1Dx5基因,提高了检测效率。Ishikawa等[31]设计了3条引物,当材料中含有1Dx5基因时,可以扩增2条320和343 bp的片段,当材料中无1Dx5基因时,可以扩增一条361 bp的片段。刘东涛等[32]选用已发表的5个1Dx5基因的PCR标记,发现Ishikawa等[31]设计标记在测试材料中稳定扩增目标片段,不产生非特异性扩增产物,是检测1Dx5基因的最佳标记。
5 1Dx5亚基在小麦品质改良工程中的应用
尽管小麦高分子量麦谷蛋白仅占种子总蛋白的10%左右,但对面团的黏弹性起着决定性作用。Blechl等[33]通过基因枪转化法将优质亚基1Dx5的编码基因导入小麦中,获得了至少在三代内稳定表达的转基因株系,证实通过转基因技术可以改良小麦的高分子量麦谷蛋白亚基组成。Barro等[34]通过基因枪转化法将1Dx5基因导入小麦中,获得T2代转基因株系种子,对其品质研究结果表明,转基因种子提高了面团弹性。He等[35]通过基因枪转化法将1Dx5基因导入硬粒小麦中,结果显示转基因硬粒小麦在面团强度和稳定时间上都得到显著提高。唐风兰等[36]通过花粉管通道法向小麦品系91B569和92K809中导入1Dx5基因,得到表达1Dx5亚基的株系,转基因株系除芒的类型发生分离外,其他农艺性状表现和亲本几乎一致。说明花粉管通道法在改善小麦高分子量麦谷蛋白亚基组成的同时,可以保持亲本原有的大部分优异特性。王广金等[37]利用花粉管通道法将1Dx5+1Dy10同时转入小麦,蛋白质、基因组水平检测后代,筛选得到优质高产的转1Dx5+1Dy10基因品系21K867。对比与受体新克旱9号、21K867的主要品质性状都得到提高,其中稳定时间增加1.3 min,面积增加5.1 cm2,延伸性增加1.4 cm,沉降值增加8.9 mL。Gadaleta 等[12]以大肠杆菌磷酸甘露糖异构酶基因为正选择标记,创建了将1Dx5和1Dy10基因共同转化到硬粒小麦的“最小基因盒”。该“最小基因盒”最大特点是不含有除草剂和抗生素抗性标记基因。研究发现,在T2代中1Dx5、1Dy10和大肠杆菌磷酸甘露糖异构酶基因之间不存在连锁关系,从T3代中分离得到无1Dx5和大肠杆菌磷酸甘露糖异构酶基因,仅含有1Dy10表达的植株;在T4代得到仅表达1Dy10的纯合个体。研究表明,通过“最小基因盒”基因枪转化法与遗传分离相结合有可能获得新性状的转基因小麦植株,且该植株不含有转化标记。Beckles等[38]研究一个非转基因的对照Bobwhite和3个转基因株系小麦Bobwhite的淀粉特性,结果表明,3个转基因株系分别为:一个为仅转bar基因的对照,2个为转1Dx5并超量表达(2.3和3.5倍)的株系。研究发现这4个株系糊化参数有较小差异。另外,超量表达3.5倍1Dx5的株系和其他株系相比,淀粉积累低而己糖积累高。其原因可能是基因变换过程引起的。这些变化并没有严重地破坏淀粉的结晶度或改变淀粉的糊化焓或淀粉中直链淀粉脂质复合物,直链淀粉含量和淀粉颗粒的糊化内在蛋白体无变化。
6 结语
随着消费者生活水平的提高,对小麦等加工品质的要求越来越高。近年来一些优质小麦品种应用于生产中,起到了一定的社会经济效应,但不能满足市场的旺盛需求。 研究者可以利用转基因技术、分子标记辅助选择等对控制小麦加工品质关键基因1Dx5进行操作,加速优质小麦品种的培育,满足消费者的需求。
参考文献
[1]CORNISH G B,SKYLAS D J,SIRIAMORNPUN S,et al.Grain proteins as markers of genetic traits in wheat[J].Crop and pasture science,2001,52(12):1161-1171.
[2]LAWRENCE G J,SHEPHERD K W.Chromosomal location of genes controlling seed proteins in species related to wheat[J].Theor Appl Genet,1981,59:25-31.
[3]LIU L,WANG A,APPELS R,et al.A MALDITOF based analysis of high molecular weight glutenin subunits for wheat breeding[J].Journal of cereal science,2009,50(2):295-301.
[4]ZHENG W,PENG Y,MA J,et al.High frequency of abnormal high molecular weight glutenin alleles in Chinese wheat landraces of the YangtzeRiver region[J].Journal of cereal science,2011,54(3):401-408.
[5]PAYNE P I,LAWRENCE G J.Catalogue of alleles for the complex gene loci,GluA1,GluB1,and GluD1 which code for highmolecularweight subunits of glutenin in hexaploid wheat[J].Cereal research communications,1983,11:29-35.
[6]ANDERSON O D,GREENE F C,YIP R E,et al.Nucleotide sequences of the two highmolecularweight glutenin genes from the Dgenome of a hexaploid bread wheat,Triticum aestivum L.cv Cheyenne[J].Nucleic acids research,1989,17(1):461-462.
[7]张小娟,祝长青,覃建兵.转1Dx5基因小麦突变株系的研究[J].华中师范大学学报(自然科学版),2013,47(2):254-258.
[8]BARRO F,BARCEL P,LAZZERI P A,et al.Functional properties of flours from field grown transgenic wheat lines expressing the HMW glutenin subunit 1Ax1 and 1Dx5 genes[J].Molecular breeding,2003,12(3):223-229.
[9]DARLINGTON H,FIDO R,TATHAM A S,et al.Milling and baking properties of field grown wheat expressing HMW subunit transgenes[J].Journal of cereal science,2003,38(3):301-306.
[10]BLECHL A,LIN J,NGUYEN S,et al.Transgenic wheats with elevated levels of Dx5 and/or Dy10 highmolecularweight glutenin subunits yield doughs with increased mixing strength and tolerance[J].Journal of cereal science,2007,45(2):172-183.
[11]RAKSZEGI M,BEKES F,LANG L,et al.Technological quality of transgenic wheat expressing an increased amount of a HMW glutenin subunit[J].Journal of cereal science,2005,42(1):15-23.
[12]GADALETA A,GIANCASPRO A,BLECHL A E,et al.A transgenic durum wheat line that is free of marker genes and expresses 1Dy10[J].Journal of cereal science,2008,48(2):439-445.
[13]LEON E,MARN S,GIMNEZ M J,et al.Mixing properties and dough functionality of transgenic lines of a commercial wheat cultivar expressing the 1Ax1,1Dx5 and 1Dy10 HMW glutenin subunit genes[J].Journal of cereal science,2009,49(1):148-156.
[14]FORDE J,MALPICA J M,HALFORD N G,et al.The nucleotide sequence of a HMW glutenin subunit gene located on chromosome 1A of wheat(Triticum aestivum L.)[J].Nucleic Acids Res,1985,13(19):6817-6832.
[15]SUGIYAMA T,RAFALSKI A,PETERSON D,et al.A wheat HMW glutenin subunit gene reveals a highly repeated structure[J].Nucleic Acid Res,1986,13(24):8729-8737.
[16]PENG Y,YU K,ZHANG Y,et al.Two novel Ytype high molecular weight glutenin genes in chinese wheat landraces of the YangtzeRiver region[J].PloS one,2015,10(11):142348.
[17]KOHLER P,KECK B,MULLER S,et al.Disulphide bonds in wheat gluten[M]//Wheat kernel proteins,molecular and functional aspects.Viterbo,Italy:University of Tuscia,1994.
[18]LAFIANDRA D,DOVIDIO R,PORCEDDU E,et al.New data supporting high Mr glutenin subunit 5 as the determinant of quality differences among the pairs 5+10 vs.2+12.[J].Cereal Sci,1993,18:197-205.
[19]BELTON P S,COLQUHOUN I J,GRANT A,et al.FTIR and NMR studies on the hydration of a highMr subunit of glutenin[J].Int J Biol Macromol,1995,17:74-80.
[20]BELTON P S.Mini review:On the elasticity of wheat gluten[J].Cereal Sci,1999,29:103-107.
[21]TATHAM A S,MIFLIN B J,SHEWRY P R.The betaturn conformation in wheat gluten proteins:Relationship to gluten elasticity[J].Cereal Chem,1985,62:405-412.
[22]VAN DIJK A A,VAN WIJK L L,VAN SWIETEN E,et al.Structure characterization of the central repetitive domain of high molecular weight gluten proteins.I.Model studies using cyclic and linear peptides[J].Protein science,1997,6(3):637-648.
[23]MILES M J,CARR H J,MCMASTER T C,et al.Scanning tunneling microscopy of a wheat seed storage protein reveals details of an unusual supersecondary structure[J].Proceedings of the national academy of sciences,1991,88(1):68-71.
[24]GILBERT S M,WELLNER N,BELTON P S,et al.Expression and characterisation of a highly repetitive peptide derived from a wheat seed storage protein[J].Biochimica et biophysica acta(BBA)protein structure and molecular enzymology,2000,1479(1):135-146.
[25]WANG K,AN X L,PAN L P,et al.Molecular characterization of HMWGS 1Dx3t and 1Dx4t genes from Aegilops tauschii and their potential value for wheat quality improvement[J].Hereditas,2012,149(1):41-49.
[26]SMITH R L,SCHWEDER M E,BARNETT R D.Identification of glutenin alleles in wheat and triticale using PCRgenerated DNA markers[J].Crop science,1994,34(5):1373-1378.
[27]DOVIDIO R,ANDERSON O D.PCR analysis to distinguish between alleles of a member of a multigene family correlated with wheat breadmaking quality[J].Theoretical and applied genetics,1994,88(6/7):759-763.
[28]AHMAD M.Molecular markerassisted selection of HMW glutenin alleles related to wheat bread quality by PCRgenerated DNA markers[J].Theoretical and applied genetics,2000,101(5/6):892-896.
[29]RADOVANOVIC N,CLOUTIER S.Geneassisted selection for high molecular weight glutenin subunits in wheat doubled haploid breeding programs[J].Molecular breeding,2003,12(1):51-59.
[30]MA W,ZHANG W,GALE K R.MultiplexPCR typing of high molecular weight glutenin alleles in wheat[J].Euphytica,2003,134(1):51-60.
[31]ISHIKAWA G,NAKAMURA T.A new codominant PCRbased marker to identify the highmolecularweight glutenin subunit combination“ 5+ 10” of common wheat[J].Wheat Inf Serv,2007,103:1-4.
[32]刘东涛,陈荣振,刘世来,等.优质高分子量麦谷蛋白亚基 1Dx5 的分子检测[J].麦类作物学报,2008,28(3):425-429.
[33]BLECHL A E,ANDERSON O D.Expression of a novel highmolecularweight glutenin subunit gene in transgenic wheat[J].Nature biotechnology,1996,14(7):875-879.
[34]BARRO F,ROOKE L,BKS F,et al.Transformation of wheat with high molecular weight subunit genes results in improved functional properties[J].Nature biotechnology,1997,15(12):1295-1299.
[35]HE G Y,ROOKE L,STEELE S,et al.Transformation of pasta wheat(Triticum turgidum L.var.durum)with highmolecularweight glutenin subunit genes and modification of dough functionality[J].Molecular breeding,1999,5(4):377-386.
[36]唐风兰,张晓东,王广金,等.利用花粉管通道法向小麦中导入麦谷蛋白高分子量优质亚基基因的研究初报[J].黑龙江农业科学,2002(3):1-2.
[37]王广金,李忠杰,张晓东,等.利用花粉管通道法将编码优质HMWGS 基因导人小麦进行品质改良的研究[J].黑龙江农业科学,2002(6):1-3.
[38]BECKLES D M,TANANUWONG K,SHOEMAKER C F.Starch characteristics of transgenic wheat (Triticum aestivum L.)overexpressing the Dx5 high molecular weight glutenin subunit are substantially equivalent to those in nonmodified wheat[J].Journal of food science,2012,77(4):437-442.

