手术治疗3岁以下儿童腺样体肥大所致阻塞性睡眠呼吸暂停综合征的临床疗效分析
闵馨霆, 汪照炎, 程 岚, 李 磊, 曹荣萍
(上海交通大学医学院附属新华医院耳鼻咽喉-头颈外科,上海 200092)
·临床研究·
手术治疗3岁以下儿童腺样体肥大所致阻塞性睡眠呼吸暂停综合征的临床疗效分析
闵馨霆, 汪照炎, 程 岚, 李 磊, 曹荣萍
(上海交通大学医学院附属新华医院耳鼻咽喉-头颈外科,上海 200092)
目的 探讨3岁以下儿童腺样体肥大手术治疗的可行性。方法 回顾性研究2166例经全身麻醉手术治疗的腺样体肥大患儿,按年龄分为3岁以下与3~6岁两组,其中3岁以下组148例患者,3~6岁组2018例患者。术前均行鼻内镜检查确诊为腺样体重度肥大,睡眠呼吸监测检查确诊为重度阻塞性睡眠呼吸暂停综合征。对两组患儿手术并发症、术后症状、生长发育改善情况及术后复发率进行统计分析。结果 两组患儿术中出血量无明显差异,术中副损伤、术后住院天数相近,3岁以下患儿无术后出血、感染、呼吸道梗阻发生。术后随访3年,3岁以下患儿阻塞性睡眠呼吸暂停综合征临床症状明显缓解,术后最低血氧饱和度及血清胰岛素样生长因子-1(serum insulin-like growth factors-1, IGF-1)与术前比较明显改善,但3岁以下腺样体肥大患儿术后复发率高于3~6岁组。结论 3岁以下病情严重、保守治疗无效的腺样体肥大患儿行手术治疗是可行且必要的。
儿童; 腺样体肥大; 阻塞性睡眠呼吸暂停综合征; 腺样体切除术
婴儿出生时鼻咽部即有腺样体,并随年龄逐渐增大,6~7岁时达顶峰,10岁以后逐渐萎缩[1],可因反复炎症刺激而发生病理性增生肥大从而引起相应症状[2-3],是导致阻塞性睡眠呼吸暂停综合征(obstructive sleep apnea syndrome, OSAS)的主要病因。Jain等[4]指出,腺样体肥大程度与OSAS的严重程度显著相关。研究[5-6]显示,OSAS如得不到有效治疗可能导致严重的心肺疾病、代谢并发症、神经行为障碍及高血压等。2012年,美国儿科协会颁布的OSAS最新治疗指南[7]指出因腺样体肥大所致的儿童OSAS最有效的治疗方法为腺样体切除。3岁以上腺样体肥大患者可选择手术治疗已获得公认[7],3岁以下患儿目前大都选择保守治疗[8],但3岁以下腺样体肥大明显且严重影响生长发育的患儿是否需要积极的外科手术干预目前国内研究较少。本研究回顾分析2008年1月至2012年12月上海交通大学医学院附属新华医院耳鼻咽喉-头颈外科收治的148例3岁以下因腺样体肥大所致OSAS患儿的临床手术治疗情况,并与同期2018例3~6岁腺样体肥大患儿临床手术疗效进行对照,探讨3岁以下患儿手术治疗的可行性与临床疗效。
1 资料与方法
1.1 一般资料
2008年1月至2012年12月我科收治3岁以下因腺样体肥大所致OSAS患儿148例,平均年龄31个月,其中男103例,女45例。同期3~6岁腺样体肥大患儿2018例,平均年龄(4.9±1.2)岁,其中男1458例,女560例,所有患儿术前行鼻内镜检查显示腺样体重度肥大,整夜多导睡眠呼吸监测(polysomnography, PSG)诊断为重度OSAS,且门诊使用保守治疗(如使用鼻腔局部用药、口服抗过敏药、短期抗生素治疗等)3个月症状无改善。所有患儿均为首次手术,术前排除导致OSAS的其他病因,术后随访36个月。
1.2 方法
1.2.1 手术方法 2166例OSAS患儿均在气管插管全身麻醉下行手术治疗,使用Davis开口器撑开并暴露口咽,用2条导尿管经前鼻孔导入咽腔,经口腔导出,于口外固定,使软腭前移,使用70°鼻内镜及动力吸割器切除腺样体组织,直至后鼻孔完全暴露,并使用低温等离子射频刀充分止血。
1.2.2 术后症状减轻评估方法 参考Franco等研究制订儿童OSA-18生活质量调查表,用于对比患儿术前术后症状改善情况[9]。
1.3 统计学处理
采用SPSS 19.0统计学软件处理数据,计量资料比较采用t检验,率(%)的比较采用χ2检验。P< 0.05为差异有统计学意义。
2 结 果
2.1 术后处理及术后随访
所有患儿手术顺利,术后夜间均能正常入睡,术后第一天进食半流质。术后均留院观察,3岁以下患儿予以心电监护24h,全部患儿常规观察3d,若无发热、呼吸道阻塞、出血、脱水等症状则予以出院,全部患者随访36个月。
2.2 术中出血量及手术副损伤发生率
所有患儿均安全渡过麻醉期,无麻醉意外发生。3岁以下年龄组患儿术中牙齿脱落,咽鼓管圆枕损伤等副损伤率与3~6岁组患儿相当,术中出血量比较亦无统计学意义,提示3岁以下年龄组患儿手术风险与3~6岁年龄组患儿相当,见表1。
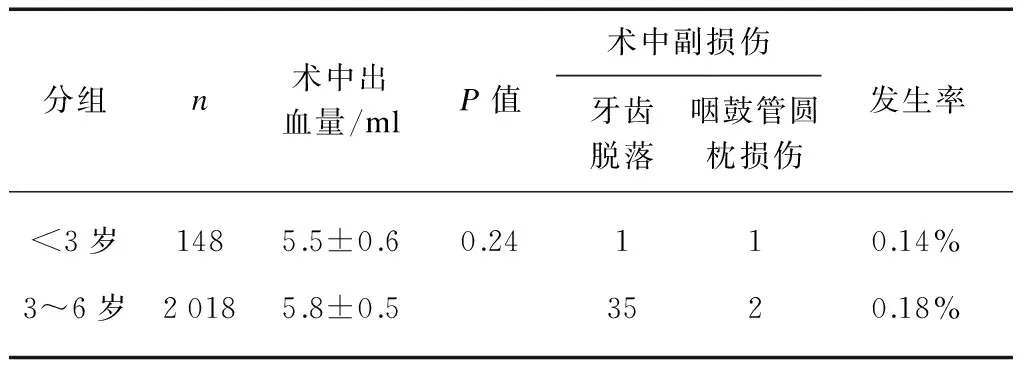
表1 术中出血量及副损伤发生率
2.3 术后出血、感染、呼吸道梗阻发生率与平均住院天数
3岁以下年龄组患儿无1例发生术后出血、感染及呼吸道梗阻,提示3岁以下年龄组患儿术后并发症发生率不高于3~6岁年龄组患儿;3岁以下患儿住院天数与3~6岁组相比差异无统计学意义(P= 0.12),提示3岁以下患儿手术并不增加住院时间,见表2。

表2 术后出血、感染、呼吸道梗阻发生率与平均住院天数
2.4 手术疗效
术后随访36个月,两组患儿术后打鼾、憋气、张口呼吸症状改善明显,3岁以下患儿OSAS临床症状缓解率(88.5%)与3~6岁患儿(88.7%)相当(P=0.78),但3岁以下OSAS患儿术后复发率高于3~6岁组(P<0.01),见表3。3岁以下组患儿术后最低血氧饱和度、血清胰岛素样生长因子-1(insulin-like growth factors-1, IGF-1)水平与术前比较明显改善(P值<0.05或<0.001),见表4。
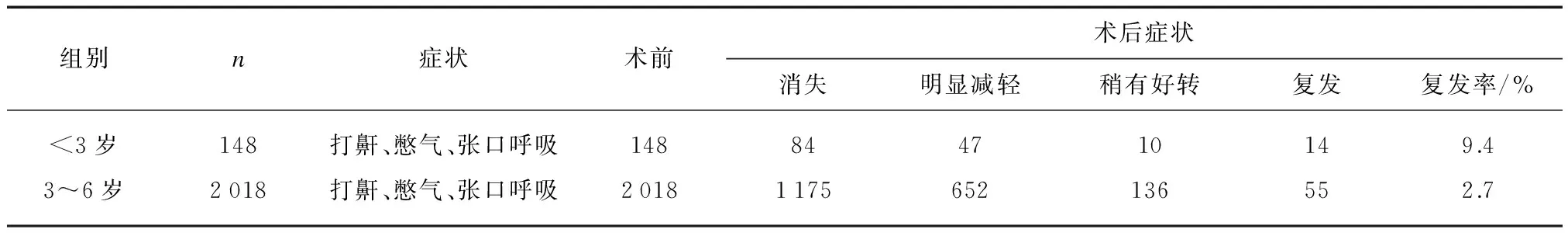
表3 手术治疗效果比较
注: 临床症状缓解率=(症状消失+明显减轻)/n
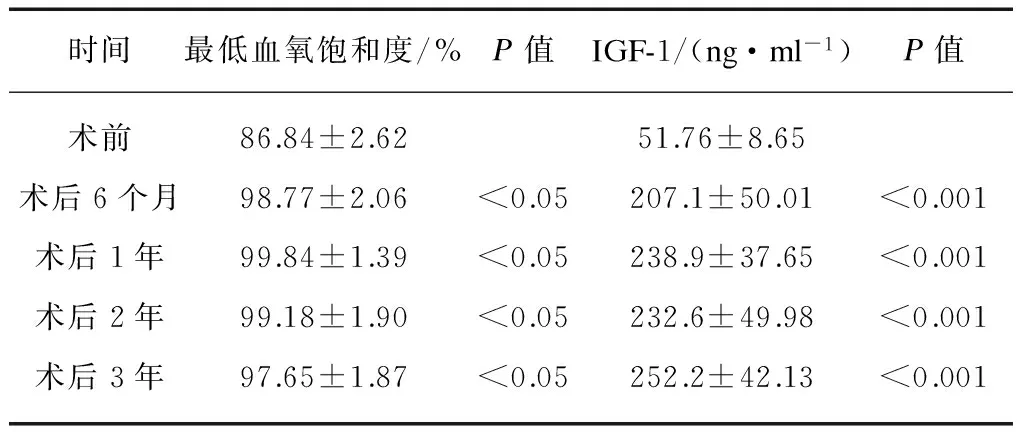
表4 3岁以下患儿术前术后最低血氧饱和度及血清IGF-1水平比较
3 讨 论
腺样体在患儿出生时即存在,一般6~7岁时达到最大,10岁后逐渐萎缩[1]。若患儿3岁前即出现腺样体明显肥大,则OSAS症状很难自行缓解,如得不到及时治疗会影响生长发育,并对心肺功能、神经系统造成影响[10]。流行病学调查[11-12]显示,OSAS在儿童中发病率为1%~5%。其常见临床表现为夜间睡眠打鼾、憋气、张口呼吸、盗汗、遗尿及睡眠姿势异常等,白天常表现为喜怒无常、多动、注意力不能集中、记忆力下降等行为异常和认知功能障碍[13]。
2012年,美国儿科协会颁布OSAS治疗指南[7]指出腺样体肥大所致儿童OSAS其一线治疗方法为腺样体切除,但患儿年龄小于3岁为行此手术的危险因素,故大多采取保守治疗。然此类患儿如到3岁以上进行手术,将对生长发育、认知功能产生影响。研究[14]证实,OSAS与体内生长激素水平密切相关。研究[15]显示,OSAS患儿术后血清IGF-1水平呈爆发性升高,身高及体质量均有快速增长。故有学者[16-17]认为,如果症状明显,小于1岁的患儿也可以考虑手术,年龄并不是OSAS患儿的绝对手术禁忌,但术前应详细询问病史,完善各项相关检查,充分排除导致OSAS的其他病因,严格掌握手术指征,术中、术后加强监护,及时对症处理,减少并发症的产生。
对于3岁以下因腺样体肥大所致OSAS者,出现以下几种情况需要手术治疗: (1) 夜间打鼾、憋气及张口呼吸症状明显,导致睡眠不安或无法入睡且保守治疗3个月症状无明显改善者;(2) 生长发育受到严重影响(如身高、体重明显低于同龄儿一般水平);(3) 鼻内镜检查显示腺样体重度肥大且PSG检查诊断为重度OSAS。
在本研究中,148例3岁以下OSAS患儿平均病程8.6个月,夜间打鼾、憋气症状明显,生长发育明显受阻,术前鼻内镜显示腺样体近乎完全阻塞双侧后鼻孔,PSG检查显示AHI>5次/h,最低血氧饱和度<90%。本研究比较3岁以下手术患儿与3~6岁手术患儿,发现术中出血量及副损伤发生率两者并无明显差异,表明3岁以下患儿术中风险并不高于3~6岁组患儿;3岁以下组患儿无1例发生术后出血且两组患儿均无术后感染及呼吸道梗阻发生,提示3岁以下年龄组患儿术后并发症发生率不高于3~6岁年龄组患儿。两组患儿住院天数相近,表明3岁以下患儿并不增加住院时间;通过随访调查,两组患儿术后症状明显改善,3岁以下组患儿术后最低血氧饱和度及血清IGF-1水平较术前明显升高,提示腺样体切除手术可明显改善患儿的缺氧及生长发育状况。但是3岁以下组患儿术后复发率高于3~ 6岁组,分析其原因可能为患儿年龄小,腺样体仍然处于增殖期,术后如患儿出现呼吸道感染等易导致腺样再次增生,故术前应充分告知家属。
综上所述,3岁以下病情严重、保守治疗无效的腺样体肥大患儿行手术治疗是可行且必要的,但应严格掌握手术指征,加强术中术后监护。
[1] 陈恩宽,宋文光,胡亿文,等.等离子射频消融术治疗腺样体肥大对儿童免疫功能的影响[J].广东医学,2014,35(11): 1731-1732.
[2] Brambilla I, Pusateri A, Pagella F, et al. Adenoids in children: advances in immunology, diagnosis, and surgery[J]. Clin Anat, 2014,27(3): 346-352.
[3] Marseglia GL, Caimmi D, Pagella F, et al. Adenoids during childhood: the facts[J]. Int J Immunopathol Pharmacol, 2011,24(4 Suppl): 1-5.
[4] Jain A, Sahni JK. Polysomnographic studies in children undergoing adenoidectomy and/or Tonsillectomy[J]. J Laryngol Otol, 2002,116(9): 711-715.
[5] Schwengel DA, Dalesio NM, Stierer TL. Pediatric obstructive sleep apnea[J]. Anesthesiol Clin, 2014,32(1): 237-261.
[6] 赵普庆,邓兵,艾自胜,等.高血压合并OSA患者夜间缺氧与外部形态特征关系[J].同济大学学报: 医学版,2011,32(6): 95-99.
[7] Marcus CL, Brooks LJ, Draper KA, et al. Diagnosis and management of childhood obstructive sleep apnea syndrome[J]. Pediatrics, 2012,130(3): e714-755.
[8] Robison JG, Wilson C, Otteson TD, et al. Analysis of outcomes in treatment of obstructive sleep apnea in infants[J]. Laryngoscope, 2013,123(9): 2306-2314.
[9] Franco RA Jr, Rosenfeld RM, Rao M. First place—resident clinical science award 1999. Quality of life for children with obstructive sleep apnea[J]. Otolaryngol Head Neck Surg, 2000,123(1 Pt 1): 9-16.
[10] 张亚梅,徐洁.儿童阻塞性睡眠呼吸暂停低通气综合征[J].中国医学文摘: 耳鼻咽喉科学,2013,28(1): 5-8.
[12] Tauman R, Gozal D. Obstructive sleep apnea syndrome in children[J]. Expert Rev Respir Med, 2011,5(3): 425-440.
[13] Grime C, Tan HL. Sleep disordered breathing in children[J]. Indian J Pediatr, 2015,82(10): 945-955.
[14] 谢利生,黄群.阻塞性睡眠呼吸暂停综合征患儿体内生长激素水平的变化[J].山东大学耳鼻喉眼学报,2011,25(4): 4-5.
[15] Zhang XM, Shi J, Meng GZ, et al. The Effect of obstructive sleep apnea syndrome on growth and development in nonobese children: a parallel study of twins[J]. J Pediatr, 2015,166(3): 646-650.
[16] Cheng J, Elden L. Outcomes in children under 12 months of age undergoing adenotonsillectomy for sleep-disordered breathing[J]. Laryngoscope, 2013,123(9): 2281-2284.
[17] 刘卫一,赵靖,安嘉清,等.婴幼儿阻塞性睡眠呼吸暂停低通气综合征诊治特点[J].中国耳鼻咽喉头颈外科,2008,15(1): 7-10.
Surgical treatment for obstructive sleep apnea/hypopnea syndrome caused by adenoid hypertrophy in children
MINXin-ting,WANGZhao-yan,CHENGLan,LILei,CAORong-ping
(Dept. of Otolaryngology, Head and Neck Surgery, Xinhua Hospital, Shanghai Jiaotong University School of Medicine, Shanghai 200092, China)
Objective To assess the therapeutic effects of surgical treatment for obstructive sleep apnea/hypopnea syndrome(OSAHS) caused by adenoid hypertrophy in children. Methods Clinical data of 2166 children(148 children under 3 years and 2018 aged 3-6 years) with OSAHS caused by adenoid hypertrophy were retrospectively reviewed. The adenoid hypertrophy was diagnosed by nasal endoscopy, and severe OSAHS was confirmed by polysomnography. The postoperative complications, symptom improvement, the growth and development, recurrence rate were analyzed in both age groups. Results There were no significant differences in intraoperative blood loss and secondary injury, length of hospital stay between two age groups. No bleeding, infection and airway obstruction occurred in under 3 years group. After 3 years of postoperative follow-up, the clinical symptoms of OSAHS were significantly alleviated, and the low oxygen saturation and serum insulin-like growth factors-1(IGF-1) levels were significantly improved in children under 3 years, but the recurrence rate was higher than that in children aged 3-6 years. Conclusion When conservative treatment is invalid, surgical treatment is feasible and necessary for children under 3 years with OSAHS caused by adenoid hypertrophy.
child; adenoid hypertrophy; obstructive sleep apnea syndrome; adenoidectomy
10.16118/j.1008-0392.2016.05.012
2016-02-17
国家自然科学基金青年项目(81400446)
闵馨霆(1989—),女,住院医师,硕士研究生.E-mail: minxinting66@163.com
曹荣萍.E-mail: caorongp@163.com
R 765
A
1008-0392(2016)05-0058-04

