第Ⅲ组亲代谢型谷氨酸受体在内脏高敏性大鼠结肠中的表达
邵利梅, 刘雁冰, 肖军华, 刘 菲
(1. 同济大学医学院,上海 200092; 2. 同济大学附属东方医院消化内科,上海 200120)
·基础研究·
第Ⅲ组亲代谢型谷氨酸受体在内脏高敏性大鼠结肠中的表达
邵利梅1,2, 刘雁冰2, 肖军华2, 刘 菲2
(1. 同济大学医学院,上海 200092; 2. 同济大学附属东方医院消化内科,上海 200120)
目的 探讨第Ⅲ组亲代谢型谷氨酸受体mGluR4、mGluR7、mGluR8在内脏高敏性大鼠结肠中的表达变化。方法 12只SD雄性幼鼠分为母婴分离(neonatal maternal separation, NMS)组和对照组(normal control, NC)组。利用结直肠扩张(colorectal distention, CRD)刺激下的腹壁回缩反射(abdominal withdrawal reflex, AWR)评分和腹壁肌电活动(electromyography, EMG)检验模型有效性;应用RT-PCR、Western印迹法和免疫组化检测第Ⅲ组亲代谢型谷氨酸受体mGluR4、mGluR7、mGluR8在模型组和对照组大鼠结肠中的表达变化。结果 在 不同压力CRD刺激下,NMS组大鼠的AWR评分(P<0.01)和腹壁肌电活动(P<0.05)明显高于NC组;NMS组大鼠结肠中第Ⅲ组亲代谢型谷氨酸受体mGluR4、mGluR7、mGluR8的mRNA(P<0.01,P<0.05,P<0.01)和蛋白水平表达(积分光度值integrated density, ID)(P<0.05,P<0.01,P<0.01)分别高于相对应NC组的表达;NMS组mGluR4、mGluR7、mGluR8的阳性表达率明显高于NC组。结论 第Ⅲ组亲代谢型谷氨酸受体mGluR4、mGluR7、mGluR8在内脏高敏性大鼠结肠中的表达明显升高,肠易激综合征(irritable bowel syndrome, IBS)发病可能与第Ⅲ组亲代谢型谷氨酸受体相关。
肠易激综合征; 内脏高敏性; 第Ⅲ组亲代谢型谷氨酸受体; 大鼠
肠易激综合征(irritable bowel syndrome, IBS)临床最常见的功能性胃肠病之一,发病机制复杂,其中内脏高敏感性(visceral hypersensitivity)作为IBS的生物学标记受到广泛关注[1],母婴分离(neonatal maternal separation, NMS)模型能较好地模拟IBS的内脏高敏性[2]。第Ⅲ组mGluR分为mGluR4、mGluR6、mGluR7、mGluR8,在中枢和外周均有分布,其中mGluR6特异性地表达于视网膜[3]。以往重视第Ⅲ组mGluR在中枢神经系统疾病中的作用,而在胃肠道功能性的疾病中作用尚不清楚,有限的研究[3-4]提示第Ⅲ组mGluR在胃肠道动力和分泌功能有调节作用,但关于内脏高敏性方面研究甚少,故本研究分析第Ⅲ组mGluR在NMS模型中的表达变化,探讨IBS内脏高敏性机制。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 SD孕鼠4只,由上海实验动物中心提供,有效新生雄鼠12只。饲养条件安静,恒温恒湿,12h自然光照与黑暗交替,食水持续供给,3~ 5只/笼。
1.1.2 主要试剂与仪器 mGluR4、mGluR7、mGluR8、GAPDH引物由生工生物工程股份有限公司设计和合成;SYBR Green Master Mix购自美国Life Technologies公司;mGluR4抗体购自英国Abcam公司;mGluR7、mGluR8抗体购自美国Novus Biologicals公司;辣根过氧化物酶标记抗体购自北京博尔西科技有限公司;自制结直肠扩张气囊(由8号橡胶导尿管插入乳胶手套制成,长约6cm)及BL-420F生物机能实验系统购自成都泰盟科技有限公司。
1.2 方法
1.2.1 NMS模型制备 将新生鼠分为NMS组与对照组(NC组),每组6只,NMS组新生鼠出生后第2~14天,每天与母鼠分离3h(9:00~12:00am),NC组不做特殊处理。饲养至2月龄,雄鼠体质量250~300g,进行内脏痛觉敏感性测定,备用。
1.2.2 内脏痛觉敏感性测定 结直肠扩张(colorectal distention, CRD)刺激下腹壁回缩反射(abdominal withdrawal reflex, AWR)评分: 8周龄时,对大鼠CRD刺激下AWR进行半定量评分。测定前12h禁食不禁水,以便减少肠道粪便。将大鼠置于安静的房间30min适应环境后,自肛门内置入抽空气体气囊,气囊进入后距肛门约1cm,用胶布将气囊导管固定于尾巴,大鼠放于自制塑料盒制动,按从低到高压力打入空气,使气囊内压力分别为20、40、60、80mmHg(1mmHg=0.133kPa),每次扩张持续20s,间隔4min,分别对各压力CRD刺激下进行AWR评分。以上操作重复3次,取平均值。AWR评分标准参照Al-chaer的方法: 0分(对CRD刺激无反应);1分(刺激后大鼠有动作停顿并有短暂头部运动);2分(见有腹壁肌肉收缩);3分(有腹部抬起行为);4分(身体上拱并抬起盆腔和阴囊)[5]。
腹壁肌电活动(electromyography, EMG)评估肠道敏感性: 8周龄时,进行电极埋置,电极埋置术已有实验[6]叙述,戊巴比妥钠(30mg/kg)麻醉下,旁正中切口,钝性分离筋膜,将3根银制电极线一端缝合到腹股沟韧带上方,距中线1.5cm的一侧腹外斜肌上,电极线相互间距0.5cm,电极游离端经皮下隧道置于颈后,加以固定。术后5d记录EMG,按照前述步骤将气囊导管经肛门插入到直肠内,气囊末端距离肛门1cm,用胶布固定导管和尾巴,然后将大鼠颈后电极连接于BL-420F生物机能试验系统,选择肌电模块。增益: 1mV,时间: 0.01s,高频滤波: 1kHz,采样率: 50kHz,扫描速度: 250ms/div。同上从低到高进行各压力CRD刺激(20、40、60、80mmHg),记录EMG,以上操作重复3次,取平均值。统计的数据为各梯度压力下,波幅面积改变量(area under curve, ΔAUC)=CRD刺激下波幅面积(AUC during CRD)-基线水平波幅面积(AUC baseline)[7]。
进行痛觉敏感性测定后,NMS组中剔除各压力梯度CRD刺激下AWR评分和EMG差异不明显的大鼠,并且电极埋置术大鼠颈后电极易咬断,无法进行EMG的检测,故最终有效NMS组大鼠6只,NC组大鼠6只。
1.2.3 样本采集 戊巴比妥钠(30mg/kg)麻醉,动物深昏迷状态下打开腹腔,截取乙状结肠近直肠2cm的组织,PBS(10×)清洗,部分置于4%多聚甲醛,4℃冰箱固定过夜,部分立即置于液氮速冻后转-80℃冰箱备用。
1.2.4 实时定量PCR检测 TRIzol法提取结肠RNA,反转录成cDNA后进行实时定量PCR,mGluR4、mGluR7、mGluR8、GAPDH上下游引物见表1。实时定量PCR反应总体系为10μl,SYBR Green Master Mix 5μl,mGluR4、7、8上下游引物各1μl,dd H2O 1μl,模板cDNA 1μl,反应条件为95℃ 10min,95℃ 15s,60℃ 1min,40个循环,温度变化速率为20℃/s;然后95℃ 15s,60℃ 15s,以0.1℃/s的速率升温至95℃ 15s。每个样本做3个副孔,并做空白对照(以双蒸水代替cDNA模板)。以GAPDH作为内参,采用相对定量2-ΔΔCt表示基因表达的差异。

表1 RT-PCR所用的引物序列
1.2.5 Western印迹法 提取结肠样本组织的总蛋白,定量后确定每孔样品上样量50μg,行聚丙烯酰胺凝胶电泳,通过湿法转印将蛋白转移至NC膜,后5%脱脂奶粉封闭1h,特异性mGluR4,mGluR7,mGluR8抗体1∶1000稀释后4℃孵育过夜,TBST漂洗3次(共30min),荧光二抗(1∶2000)稀释后孵育1h,TBST漂洗3次(共30min),β-actin作为内参蛋白同时检测。
1.2.6 免疫组化 切片常规烤片,脱蜡,进行DAB染色。具体步骤如下: 3% H2O2室温静置孵育10min;置于柠檬酸钠溶液100℃热修复抗原20min;5滴封闭液(加正常山羊血清)室温下静置20~30min,甩去多余液体,不洗;滴加一抗(GluR4、7、8均为1∶500)室温静置2h,阴性对照以BSA代替一抗,滴加二抗辣根过氧化物酶标记抗体(1∶1000),20~37℃静置1h;滴加SABC,20~37℃ 静置20min;滴加DAB显色剂,显微镜下观察控制反应时间。以上步骤间均用0.01mol/L PBS(pH 7.2)缓冲液洗涤5min×3次。苏木精复染,常规脱水,透明,封片。结果分析: 胞浆或者包膜为淡黄色、棕黄色或褐色为阳性标记。
1.3 统计学处理
2 结 果
2.1 内脏痛觉敏感性测定
2.1.1 不同压力CRD刺激对NMS组和NC组大鼠AWR评分的影响 20、40、60、80mmHg CRD刺激时,NMS组AWR评分为(0.72±0.29)、(2.56±0.36)、(3.44±0.19)、(3.95±0.06)分,均高于NC组的(0.27±0.10)、(1.78±0.21)、(2.22±0.16)、(2.50±0.22),差异均有统计学意义(P<0.05)。
2.1.2 不同压力CRD刺激对NMS组和NC组大鼠EMG的影响 结果显示: 以基线为基准,不同压力CRD刺激下NMS组腹壁肌电活动较NC组明显增强,见图1。20、40、60、80mmHg CRD刺激时,NMS组△AUC为(0.03±0.41)、(1.38±0.82)、(6.60±1.05)、(21.76±3.76),低于NC组的(2.09±0.48)、(21.11±2.68)、(78.81±13.62)、(162.54±28.53),差异均有统计学意义(P<0.05)。

图1 腹壁肌电活动图Fig.1 Electromyogram activity
2.2 第Ⅲ组mGluR在内脏高敏感性大鼠结肠中的表达
mRNA的相对表达量显示: NMS组大鼠结肠上mGluR4,mGluR7,mGluR8 mRNA的相对表达量(1.92±0.52、3.13±0.46、3.71±0.40)较NC组(1±0.24、1±0.18、1±0.32)明显增加,差异均有统计学意义(P<0.01、P<0.05、P<0.01)。Western印迹法结果显示: NMS组大鼠结肠上mGluR4、mGluR7、mGluR8蛋白表达量(689607±135221、2623910±423215、2932104±110739)较NC组(461357±83622、1313684±313093、1555675±315704)明显增加,差异均有统计学意义(P<0.05、P<0.01、P<0.01),见图2。NMS组大鼠结肠黏膜上mGluR4、mGluR7、mGluR8的阳性表达较NC组增多,尤以mGluR7、mGluR8显著,见图3~5。
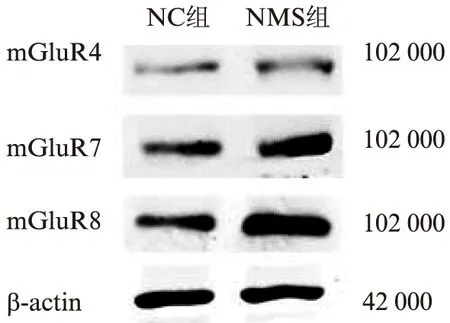
图2 大鼠结肠第Ⅲ组mGluR蛋白表达Fig.2 Expression of group Ⅲ mGluR proteins
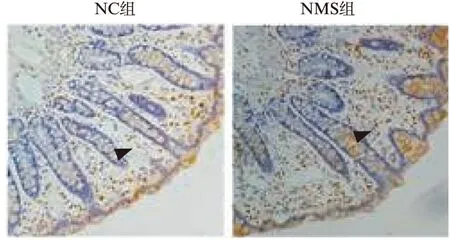
图3 大鼠结肠mGluR4的表达Fig.3 Expression of mGluR4 in colon(×200)

图4 大鼠结肠mGluR7的表达Fig.4 Expression of mGluR7 in colon(×200)

图5 大鼠结肠mGluR8的表达Fig.5 Expression of mGluR4 in colon(×200)
3 讨 论
亲代谢型谷氨酸受体属于G蛋白耦联受体(GPCRs)超家族中第3家族成员,激活后通过产生第二信使而发挥其生物学效应。其可分为8个不同亚型: mGluR1~mGluR8,根据氨基酸序列的同源性及其药理学特征和信号转导机制的不同,可将其分为3组,Ⅰ组: mGluR1、mGluR5;Ⅱ组: mGluR2、mGluR3;Ⅲ组: mGluR4、mGluR6~mGluR8[4]。Ⅲ组mGluR主要位于突触前与Gi蛋白耦联,通过抑制腺苷酸环化酶的活性,从而抑制cAMP和PKA的生成,表现为对谷氨酸的负反馈调节[8]。Ⅰ组和Ⅱ组mGluR在各种神经病理学疾病中已研究得比较透彻,Ⅲ组mGluR研究最少。
在胃肠道功能中,使用第Ⅱ组和第Ⅲ组mGluR的激动剂可抑制胃肠道迷走神经传入功能方面的敏感性,而第Ⅰ组mGluR的激动剂无此作用;Ⅰ组中mGluR5能拮抗胃食管反流病下食管下括约肌(low esophageal sphincter, LES)的一过性松弛[9];第Ⅲ组mGluR4激动剂L-AP4可抑制括约肌松弛。谷氨酸也与十二指肠黏膜的保护机制有关[10],通过免疫组化已在人体结肠上皮细胞内发现mGlu4受体。近年来,研究发现小鼠结肠黏膜表达mGluR7的mRNA及蛋白,且选择性mGluR7激动剂AMN082在一应激所致的排便中增加粪便中含水量;另有研究[3]发现mGluR8对结肠收缩有作用。
第Ⅲ组mGluR在调节痛觉方面的作用存在争议,并且在IBS中内脏高敏性研究甚少。实验[11]证明,mGluR7选择性激动剂AMN082能抑制疼痛引起的炎症和切口痛引起的敏感性。在本实验中,综合AWR评分及EMG结果,NMS模型在CRD刺激下内脏高敏感性显著增高,提示造模成功,NMS模型能较好地模拟早期精神因素对于IBS的影响,造成内脏高敏感性,AWR评分和EMG从两方面验证了该模型的有效性;NMS模型中第Ⅲ组mGluR的mRNA水平、蛋白水平及免疫组化与对照组相比明显升高,说明第Ⅲ组mGluR与IBS的内脏高敏性方面可能具有一定的相关性。内脏感觉信号由内脏感觉传入神经,经脊髓背根神经元传至大脑皮层特定的内脏感觉区域,该区域主要分布在大脑皮层第二感觉相关区域和运动辅助区域,其神经元兴奋性升高造成了内脏高敏[1]。在本实验中,第Ⅲ组mGluR表达升高,改变了谷氨酸的释放,使感觉传入产生异常,可能参与中枢痛觉信号的传递,造成内脏高敏感,具体机制有待进一步研究。近年来,变构调节剂的大量研发,为Ⅲ组mGluR的研究提供了平台[6],可选用第Ⅲ组mGluR拮抗剂MOSP[12]下调Ⅲ组mGluR的表达,观察内脏高敏性的变化,进一步探讨Ⅲ组mGluR在IBS内脏高敏性方面的机制。
总而言之,第Ⅲ组mGluR在NMS模型中表达增加,证明了第Ⅲ组mGluR与IBS的内脏高敏性方面有一定联系,为将来的IBS的机制研究提供了一些方向,具体机制有待进一步实验证明。
[1] 周小平,李学良.肠易激综合征内脏高敏感的研究进展[J].胃肠病学,2014,19(2): 117-120.
[2] 孙鸿燕,董文斌,姜林,等.母婴分离对新生鼠成年后内脏疼痛敏感性影响及机制研究[J].中华妇幼临床医学杂志,2014,10(1): 26-28.
[3] O’Connor RM, Pusceddu MM, O’Leary OF, et al. Hippocampal group Ⅲ mGlu receptor mRNA levels are not altered in specific mouse models of stress, depression and antidepressant action[J]. Pharmacol Biochem Behav, 2013,103(3): 561-567.
[4] Julio-Pieper M, Hyland N, Bravo J, et al. A novel role for the metabotropic glutamate receptor-7: modulation of faecal water content and colonic electrolyte transport in the mouse[J]. Br J Pharmacol, 2010,160(2): 367-375.
[5] Chung EK, Zhang X, Li Z, et al. Neonatal maternal separation enhances central sensitivity to noxious colorectal distention in rat[J]. Brain Res, 2007,1153: 68-77.
[6] 朱力阳,彭成,谢晓芳,等.化学刺激引起的两种大鼠内脏高敏感性模型的建立[J].中国药理学通报,2010,26(2): 267-270.
[7] van den Wijngaard RM, Stanisor OI, van Diest SA, et al. Susceptibility to stress induced visceral hypersen-sitivity in maternally separated rats is transferred across generation[J]. Neurogastroenterol Motil, 2013,25(12): e780-e790.
[8] Blackshaw LA, Page AJ, Young RL. Metabotropic glutamate receptors as novel therapeutic targets on visceral sensory pathways[J]. Front Neurosci, 2011,5: 1-7.
[9] Frisby CL, Mattsson JP, Jensen JM, et al. Inhibition of transient lower esophageal sphincter relaxation and gastroesophageal reux by metabotropic glutamate receptor ligands[J]. Gastroenterology, 2005,129(3): 995-1004.
[10] Akiba Y, Watanabe C, Mizumori M, et al. Luminal l-glutamate enhances duodenal mucosal defense mechanisms via multiple glutamate receptors in rats[J]. Am J Physiol Gastrointest Liver Physiol, 2009,297(4): G781-G791.
[11] Dolana S, Gunnc MD, Biddlestoned L, et al. The selective metabotropic glutamate receptor 7 allosteric agonist AMN082 inhibits inflammatory pain-induced and incision-induced hypersensitivity in rat[J]. Behav Pharmacol, 2009,20: 596-604.
[12] Swanson CJ, Bures M, Johnson MP, et al. Metabotropic glutamate receptors as novel targets for anxiety and stress disorders[J]. Nat Rev Drug Discov, 2005,4(2): 131-144.
Expression of group Ⅲ metabotropic glutamate receptors in the intestine of visceral hypersensitivity rats
SHAOLi-mei1,2,LIUYan-bing2,XIAOJun-hua2,LIUFei2
(1. Medical College, Tongji University, Shanghai 200092, China;2. Dept. of Gastroenterology, East Hospital, Tongji University, Shanghai 200120, China)
Objective To study the expression of group Ⅲ metabotropic glutamate receptors(Ⅲ mGluRs) in intestine of visceral hypersensitivity rats. Methods Twelve male neonate SD rats were randomly assigned into NMS group and NC group, the neonatal maternal separation model was induced in NMS group. The scores of abdominal withdrawal reflex(AWR) and electromyography(EMG) by colorectal distention(CRD) were used to test the model. The expression of Ⅲ mGluRs mRNA and proteins in intestine of visceral hypersensitivity rat was observed with Real time PCR, Western blot and immunohistochemistry, respectively. Results The scores of AWR and EMG activity in NMS group were higher than those in NC group(P<0.01 andP<0.05). The mRNA and protein expressions of mGluR4, mGluR7 and mGluR8 in NMS group were significantly higher than those in NC group(P<0.01 orP<0.05); the positive rates of mGluR4, mGluR7 and mGluR8 in NMS group were significantly higher than those in NC group. Conclusion The expression of Ⅲ group metabotropic glutamate receptors in the intestine of visceral hypersensitivity rats is significantly up-regulated, indicating that episode of irritable bowel syndrome is related to Ⅲ group metabotropic glutamate receptors.
irritable bowel syndrome; visceral hypersensitivity; Ⅲ group mGluR; rat
10.16118/j.1008-0392.2016.05.004
2016-04-11
邵利梅(1990—),女,硕士研究生.E-mail: 18267952034@163.com
刘 菲.E-mail: 13301921052@163.com
R 574.62
A
1008-0392(2016)05-0020-05

