17个品种芒果后熟过程中果皮解剖结构比较分析
张娥珍 廖芬 阳仁桂 何全光 黄梅华 辛明 黄振勇
摘 要 对17个品种的芒果果皮进行细胞学比较研究,结果表明:不同品种不同成熟度芒果的果皮细胞结构差异明显,随着成熟度增加,果皮中角质层厚度变化不明显,但细胞壁会变薄,内溶物明显减少;果皮中分布有大量的分泌腔和维管束,其数量因品种和成熟度而异;芒果果皮中均观察到有淀粉粒的存在,在完全成熟时,大部分品种的淀粉粒会完全分解,少部分品种还有少量残存。研究结果可为芒果贮藏保鲜、加工、品种选育提供理论参考价值。
关键词 芒果;果皮;解剖结构;贮运;后熟
中图分类号 TS 255.2 文献标识码 A
芒果(Mangifera indica L.)是一种深受大众喜爱,营养和商品价值高的热带水果[1-2],世界上芒果栽培和产量最多的国家主要有10个,分别是印度India(37.9%), 中国China(12.9%),泰国Thailand(6.3%), 墨西哥Mexico(5.9%), 印度尼西亚Indonesia(5.2%), 巴基斯坦Pakistan(5.9%), 巴西Brazil(3.5%), 菲律宾Philippines(3.5%), 尼日利亚Nigeria(2.6%)和埃及 Egypt(1.3%)[3]。影响芒果果实品质的因素多種多样,包括品种、栽培气候和条件、保鲜处理技术、贮运条件等[4]。
水果成熟是一系列复杂生理、生化反应的结果,很多化学反应的结果会表现在果实细胞结构的变化上[5]。果皮是果实最外一层保护组织,果皮在维持果实硬度、保持水分平衡、抵抗外界不良条件的侵害、保持果实外表美观等方面有着重要作用,果皮形态结构的变化会直接影响果实的外观品质和商品价值。解剖技术是一种可以清晰观察到果实细胞结构变化的非常有用的技术,Natale等[6]在番石榴研究上发现,钙处理对维持细胞结构有良好作用。魏钦平[7]对不同生态区苹果的果皮解剖结构进行研究发现,气候对果皮结构有明显的影响,干燥地区苹果角质膜厚,机械组织发达,细胞壁厚且层数多,低纬度高海拔地区的苹果角质厚,细胞的侧壁厚。陶世蓉[8]研究表明梨果实的贮藏品质与表皮细胞角质、表皮细胞的栓化以及石细胞有关。李宏建[9]研究表明苹果果皮细胞层数及细胞的长宽比与硬度呈负相关,角质层厚度与失重率呈负相关。Agata Konarska[10]比较了两个苹果品种贮藏前后果皮结构差异,贮藏前后角质层、细胞壁、淀粉粒均有不同变化。芒果方面,Evangelista[11]研究使用钙对芒果品种Tommy Atkin果皮细胞结构的影响,发现钙处理后果实中层细胞在贮运过程没有明显的降解或破损。
目前对不同品种的芒果果皮细胞结构比较研究报道的还较少,本研究的目的主要是通过对不同品种芒果果皮细胞结构进行比较分析,了解不同品种芒果果皮细胞结构差异以及随着成熟度变化的规律,分析其可能与芒果贮运保鲜、加工技术的关系。研究结果可为芒果贮藏保鲜、加工以及品种选育提供理论参考价值。
1 材料与方法
1.1 材料
1.1.1 植物材料 17个品种芒果分别是:金煌芒、红金龙、红贵妃、红象牙、新世纪、凯特芒、扁芒、紫花芒、桂热120、桂热10、桂热82、桂香、桂七、杉林、玉文、美国红芒和农院5号。来源于广西和海南热作所种质苗圃,采收期参照商品果成熟度采收,八成熟时采摘。
1.1.2 实验试剂与仪器 主要实验试剂:无水乙醇(分析纯,天津市百纳化工有限公司),乙酸(分析纯,天津市百纳化工有限公司),甲醛(分析醇,天津市百纳化工有限公司),50 ℃~52 ℃,54 ℃~56 ℃,58 ℃~60 ℃切片石蜡(上海标本模型厂),TO生物制片透明剂(分析纯,广西岑溪松香厂),碘(分析纯,上海展云化工有限公司),碘化钾(分析纯,上海展云化工有限公司),中性树胶(上海标本模型厂)。
主要实验仪器:烘箱(南京旭东干燥设备厂),Leica自动切片机切片(德国Leica RM2235), 显微镜(日本Olympus BX53)。
1.2 实验方法
1.2.1 芒果催熟 芒果果实3~6个左右,放置在纸箱中,温度(25±1)℃、湿度60%下自然催熟,以刚采收时为未成熟,果皮70%~80%黄时为半熟,整个果实的果皮完全黄、果肉变软时为完全成熟。
1.2.2 芒果取样 在芒果的3个成熟阶段分别采样,切取果实中部果皮材料,修成0.5 cm×0.5 cm×1.0 cm大小的方块,经FAA固定液(70%乙醇 ∶ 乙酸 ∶ 乙醛=90 ∶ 5 ∶ 5)固定,负压处理20 min后固定48 h,用70%乙醇充分洗去FAA,样品用75%乙醇保存在4 ℃冰箱中待进一步观察。
1.2.3 解剖观察 材料参照李正理[12]常规石蜡方法制片,Leica自动切片机切片,切片厚度10~12 μm,石蜡片以梯度浓度乙醇复水后碘-碘化钾染淀粉,番红-固绿对染,再经梯度浓度乙醇脱水,TO透明剂透明,中性树胶封片后,显微镜下观察芒果表皮细胞结构特征。
1.2.4 果皮厚度测量、分泌腔和维管束数量计算 果皮的厚度值由Leica显微镜测量系统进行测定(mm)。以5×物镜视野下,计算每个视野范围内分泌腔和维管束的数量,每个品种每个成熟度共观察统计30~40个视野,数量按个/cm2来表示。
1.3 数据统计分析
采用EXCEL2007和SPSS 19.0软件进行数据统计分析。
2 结果与分析
2.1 芒果果皮细胞结构基本特征描述
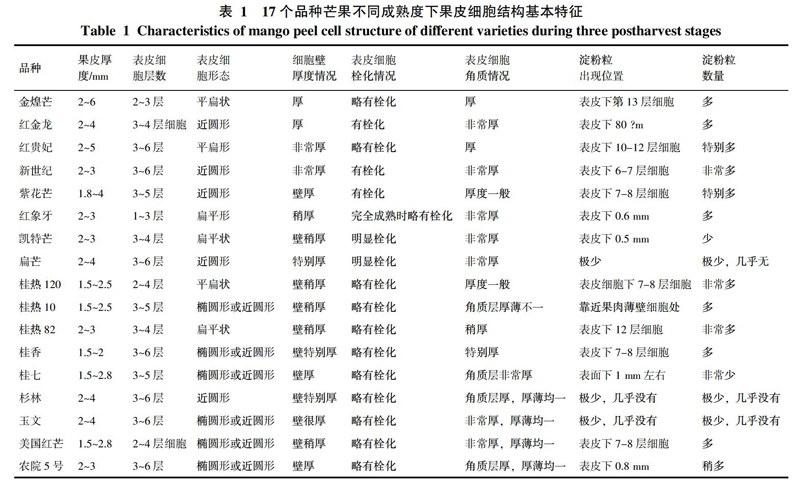
各品种芒果果皮细胞结构基本特征详见表1。芒果果皮厚度在1.5~5.0 mm左右,果皮较厚的品种有金煌芒、红贵妃、红金龙、紫花芒,果皮稍薄一些的品种有桂热120、桂热82、桂热10、桂七、桂香和美国红芒。
果皮主要由外表皮细胞层、中层果皮细胞层和靠近果肉薄壁细胞的内层果皮细胞层组成(见图版-1)。外表皮层由1~6层椭圆形或近圆形或扁平形的厚壁细胞组成,排列紧密,有些品种最外几层表皮细胞壁厚,如新世纪、扁芒、玉文、桂香(见图版-2~5)。最外一层表皮细胞或有栓化,有些品种最外一层表皮细胞完全栓化,如扁芒(见图版-3)。随着成熟度增加,有些品种栓化程度会加剧,如凯特芒(见图版-6)。在最外一层表皮细胞外,均包被着一层厚厚的角质层,角质层厚度及平整度因品种而异,随着成熟度增加,角质层厚度无明显变化。有些品种的角质层特别厚,如红金龙、新世纪、红象牙、凯特芒、扁芒、桂香、桂七、玉文、美国红芒,厚度与最外一层表皮细胞相当(见图版-2~10)。
中层果皮细胞为椭圆形或近圆形的厚壁细胞层组成,厚度在1.0~4.0 mm之间,分泌腔和维管束主要分布在这层细胞中。内层果皮细胞是与果肉薄壁细胞相连的几层细胞,该层细胞的细胞壁稍变薄,大小也比中层表皮细胞稍大,与果肉细胞层之间有明显几层排列稍整齐的细胞分隔,芒果果实在接近完全成熟时,内层果皮细胞的细胞壁会降解变薄。随着成熟度增加,各表皮层细胞壁会变薄,内溶物减少,淀粉粒降解变少或完全消失,分泌腔和维管束数量也会发生变化(见图版-11~12)。
17个品种的芒果果皮细胞中观察到有淀粉粒分布,红贵妃、桂热120、桂热82淀粉粒数量多(见图版-14~16),杉林、玉文、扁芒和桂七数量少。在非常靠近表皮的地方就开始有淀粉粒分布的品种有新世纪、紫花芒和桂香,一般在表皮下6~7层就开始有分布。随着成熟度增加,淀粉很快水解消失,但也有一些品种到完全成熟时,果皮中还可观察到少量的淀粉粒,如新世纪、紫花芒、桂热120、桂热10和桂热82。不同品种果皮中淀粉粒大小也不相同,扁芒的淀粉颗粒特别小,而紫花芒、桂热120和桂热10淀粉颗粒较大,且大小较均一。
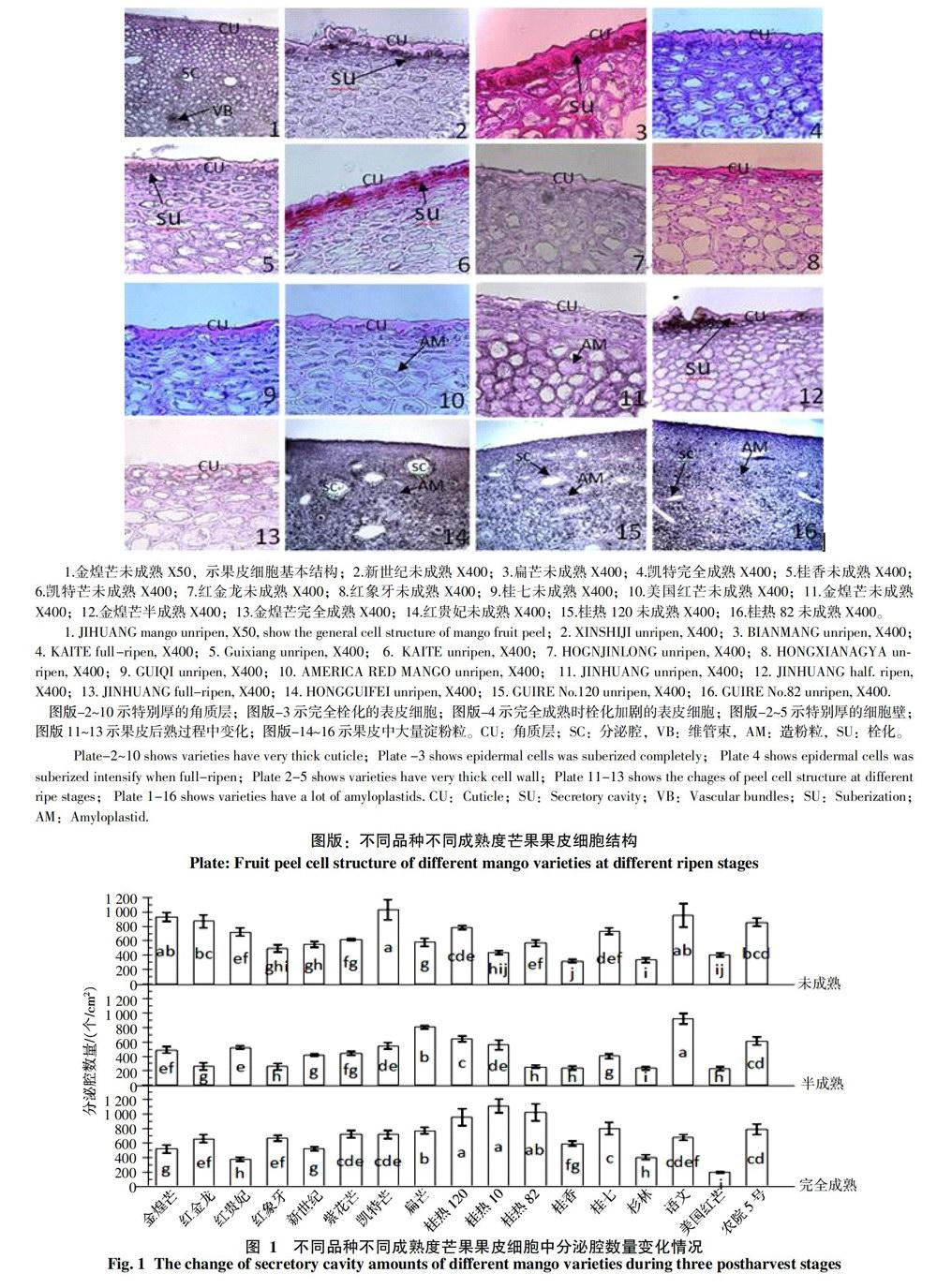
2.2 不同品种芒果果皮细胞层中分泌腔分布情况
芒果果皮中分布有大量的分泌腔,数量在192.33~1 112.23个/cm2之间。分泌腔的数量统计见图1,不同品种不同成熟度的芒果果皮,分泌腔的数量有明显差异(p<0.5)。未成熟时以金煌芒(932.33个/cm2), 凯特芒(1 029.49个/cm2)和玉文(947.32个/cm2)3个品种最高,杉林最少(334.12个/cm2)。半熟时以玉文(920.27个/cm2)和扁芒(803.26个/cm2)较高,美国红芒(229.35个/cm2)和红象牙(259.79个/cm2)最少。完全成熟时以桂热120(958.48个/cm2),桂热10(1 112.23个/cm2)和桂热82(1 026.23个/cm2)较高,美国红芒最少(192.33个/cm2)。随成熟度增加,分泌腔数量先减少,后增加,半成熟时数量最少。但扁芒和桂热10则会随成熟度而一直增加,增加幅度在26.58% 以上。大部分品种分泌腔数量完全成熟时均比未成熟时多,但金煌芒、红贵妃、凯特芒和美国红芒比未成熟时减少了30.33%以上。半成熟期分泌腔数量减少可能与细胞成熟时细胞解体有关,而完全成熟时,因细胞的不断解体,果皮细胞层数变少,从而使单位面积分泌腔的数量又有所增加。
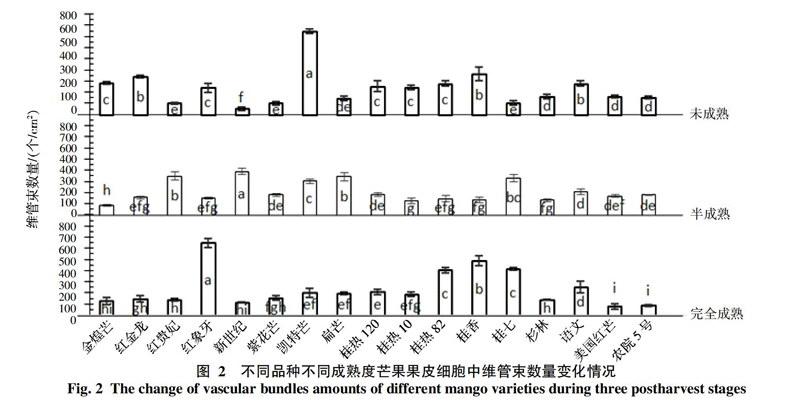
2.3 不同品种芒果果皮细胞层中维管束分布情况
不同品种不同成熟度的芒果果皮中维管束数量见图2,维管束数量和大小也会因品种而异,数量一般在50.51~748.88个/cm2之间。未成熟时维管束多的品种有红金龙(337.44个/cm2),凯特(748.88个/cm2)和桂香(365.21个/cm2),最少的是新世纪(50.51个/cm2)。半成熟时数量多的主要有新世纪(392.38个/cm2),红贵妃(351.71个/cm2),扁芒(344.77个/cm2)和桂七(331.12个/cm2),最少的是金煌芒(88.90个/cm2)。完全成熟时数量多的有红象牙(647.23个/cm2),桂香(486.75个/cm2),桂热82(404.87个/cm2)和桂七(414.26个/cm2),最少的是美国红芒(78.87个/cm2)和农院5号(85.87个/cm2)。红贵妃,新世纪,紫花芒,扁芒,桂七等几个品种的维管束数量会随着成熟度增加,增加幅度在35.64~676.7%,其他品种会相应减少,减少幅度在8.78~73.22%之间。
3 讨论
芒果果皮细胞结构因品种和成熟度有较明显的差异。在本研究中,17个品种的芒果果皮外均被有一层厚厚的角质层,李宏建[9]、陶世蓉[8]的研究表明,角质层厚有助于保持果实水分散失,减少水果在贮运过程的失重率和失水率。角质层还会延缓气体交流,降低果实的呼吸,防止病害侵入,从而提高了水果的耐贮性,延长果实货架期。本研究中发现,红金龙、新世纪、红象牙、凯特芒、扁芒和桂七的角质层特别厚,从解剖学角度来说,这些品种的耐贮性会相对其他另6个品种更好。角质层的平整度会影响果实外观光泽度,魏钦平[7]和Agata Konarska[10]对苹果表皮角质层研究表明,角质层平整的品种,外观也比较光滑漂亮。在本研究中,杉林、玉文、美国红芒的角质层较平整,外观比其他品种较为光亮。
大部分品种的芒果表皮细胞均观察到不同程度的栓化,特别是扁芒。栓化可以提高细胞的机械强度,也提高了表皮细胞的抗病、抗虫性能。有些芒果品种外表皮细胞的细胞壁特别硬且结构致密,可以提高果实的坚硬度,抗机械挤压能力强。在贮运过程中可以减少堆叠造成的损伤。维管束是机械组织,有较强的抗压性,数量多对提高果皮坚硬度和抗压能力非常有利。常金梅[13]的研究也表明,細胞结构紧密、厚壁细胞层数多的芒果品种较抗病。
果皮中的分泌腔是分泌通道,数量太多,孔径大,分泌乳汁多,在加工过程中会增加芒果去皮工序的操作难度,所以加工品种,最好选择分泌腔数量少的品种,如美国红芒,杉林,红贵妃等。淀粉粒在所有品种的果皮中均有发现,淀粉粒被认为是果皮中碳水化合物的一种暂时贮存形式,在完全成熟时淀粉基本上分降解转化成其他物质[14]。淀粉也被认为与抗寒性相关,淀粉粒多的品种更耐低温贮藏[15]。在本研究中,红贵妃、紫花芒、新世纪、桂热120、桂热82淀粉粒特别多,从解剖学的角度来看,这些品种的耐寒性会更好一些。但观察也发现有些品种如扁芒、杉林和语文淀粉特别少。
本研究主要从解剖学和细胞基础的角度,分析了17个芒果品种在后熟过程的细胞变化,这些细胞结构特征与芒果的品质及贮藏特性之间的关联性还需要继续进行进行品质分析和生理指标的测定,这方面也是今后需要继续深入研究的内容,以期为芒果品种资源、贮藏保鲜、加工利用特性方面等研究提供更多的数据补充。
参考文献
[1] Periyar selvam sellamutu, Gabriela ines denoya, Dharini sivakumar, et al. Comparison of the contents of bioactive compounds and quality parameters in selected mango cultivars[J]. Journal of Food Quality, 2013, 26: 394-402.
[2] Susy Frey Sabato, Josenilda Maria da Silv, Juliana Nunes da Cruz, et al. Study of physical-chemical and sensorial properties of irradiated Tommy Atkins mangoes(Mangifera indica L.)in an international consignment[J]. Food Control, 2009, 20: 284-288.
[3] O A Caparino, J Tang, C I Nindo, et al. Effect of drying methods on the physical properties and microstructures of mango(Philippine‘Carabao var.)powder[J]. Journal of Food Engineering, 2012, 111: 135-148.
[4] M Silva, HeldioP Villar, Rejane M M. Pimentel. Structure of the cell wall of mango after application of ionizing radiatifon Josenilda[J]. Radiation Physics and Chemistry, 2012, 81: 1 770-1 777.
[5] Marc Lahaye, Marie Francoise Devaux, Mervin Poole, et al. Pericarp tissue microstructure and cell wall polysaccharide chemistry are differently affected in lines of tomato with contrasted firmness[J]. Postharvest Biology and Technology, 2013, 76: 83-90.
[6] Natale, W Prado, R M Moro, et al. Anatomical modifications in the cell wall of guava as influenced by calcium[J]. Agropec Bras 2005, 40: 1 239-1 242.
[7] 魏钦平, 叶宝兴, 张继祥, 等. 不同生态区富士苹果果皮解剖结构的特征与差异[J]. 果树学报, 2001, 18(4): 243-245.
[8] 陶世蓉. 梨果实结构与耐贮性及品质关系的研究[J]. 西北植物学报, 2000, 20(4): 544-548.
[9] 李宏建, 刘 志, 王 宏, 等.苹果果实组织结构与果实失重率和硬度变化的关系[J]. 果树学报, 2013, 30(5): 753-758.
[10] Agata Konarska. The structure of the fruit peel in two varieties of Malus domestica Borkh. (Rosaceae) before and after storage[J]. Protoplasma, 2013, 250: 701-714.
[11] Evangelista, R M ChitarrA, A B Chitarra, et al. Mudancas naultraestrutura daparede cellular demangas ‘TommyAtkins tratadascomcloretode ca, lcio napre, colheita[J]. Rev Bras Frutic, 2002, 24: 254-257.
[12] 李正理. 植物组织制片[J]. 山東农业科学, 1998(5): 30-31.
[13] 常金梅, 张鲁斌, 柳 凤, 等. 芒果果实抗病性差异及其与果皮结构相关性初探[J]. 热带作物学报, 2012(11): 2 040-2 043.
[14] 郑国琦, 刘根红, 张 磊, 等.宁夏枸杞果实发育过程中淀粉代谢和质体超微结构研究[J]. 西北植物学报, 2014(9): 1 782-1 788.
[15] 黄 旭, 王安邦, 苗红霞, 等.香蕉辐射诱变抗寒株系果实中淀粉和糖含量的变化[J]. 热带生物学报, 2015(3): 269-272.

