水热预水解分离相思木半纤维素及其组分与结构分析
朱宁,石海强,,曹楠,熊学东,牛梅红,平清伟(大连工业大学轻工与化学工程学院,辽宁 大连 6034;华南理工大学制浆造纸工程国家重点实验室,广东 广州 50640)
水热预水解分离相思木半纤维素及其组分与结构分析
朱宁1,石海强1,2,曹楠1,熊学东1,牛梅红1,平清伟1
(1大连工业大学轻工与化学工程学院,辽宁 大连 116034;2华南理工大学制浆造纸工程国家重点实验室,广东 广州 510640)
摘要:通过水热预水解法处理相思木制得预水解液,采用乙醇沉淀回收预水解液中的半纤维素,通过条件实验优化了最佳回收半纤维素的预水解条件,然后对回收的半纤维素进行热稳定性、成分和结构分析。结果发现,获得最大半纤维素回收率的预水解条件为170℃/20min,原料中碳水化合物回收率为3.93%,回收的半纤维素中木糖为主要成分占75.56%,葡萄糖占10.71%,半乳糖占7.80%。离子色谱分析表明160℃/40min, 170℃/15min、170℃/25min 和180℃/15min水解条件下的回收半纤维素组分与170℃/20min时的回收半纤维素化学组分相同,但含量上略有差别;热重分析表明水解温度提高和时间延长使回收半纤维素热稳定性降低;核磁共振和红外光谱分析结果表明回收半纤维素的聚木糖主链上残留有乙酰基、阿拉伯糖和半乳糖连接。
关键词:生物质;水解;半纤维素;分离;水热
2015-12-07收到初稿,2015-12-22收到修改稿。
联系人:石海强,牛梅红。第一作者:朱宁(1990—),男,硕士研究生。
Received date: 2015-12-07.
Foundation item: supported by the National Natural Science Foundation of China (31470603), the Natural Science Foundation of Liaoning Province (2015020592), the Liaoning BaiQianWan Talents Program (2014921064) and the Open Foundation of State Key Laboratory of Pulp and Paper Engineering (201449).
引 言
半纤维素是植物纤维细胞壁的主要成分之一,是由多种类型的五碳糖和六碳糖(木糖、阿拉伯糖、半乳糖、葡萄糖、甘露糖等) 组成的非纤维素天然高分子碳水化合物,约占植物纤维物质总量30%左右,植物纤维种属不同其含量有所差异[1-2]。目前在硫酸盐法化学制浆中,半纤维素随制浆黑液中的木素一起经浓缩后送碱回收炉燃烧回收热能。然而由于其热值较低,仅为木素热值的1/2,热回收利用率低,造成资源浪费[3]。近年来,由于环保和木质纤维资源成本提高的问题,制浆产业正在寻求新的利润增长点,在木质纤维制浆之前,进行半纤维素预提取并进一步转化为生物燃料和其他高附加值化工产品,这种基于制浆产业的生物质精炼概念引起国内外的广泛关注[4]。
在众多半纤维素分离提取技术中,自催化水解技术不需额外化学品添加,在环保和设备维护成本方面具有优势[5-7]。高温压力环境下,在水的自电离氢质子和半纤维素乙酰基脱除形成的乙酸作用下,半纤维素和木质纤维组织结构中其他成分连接键断裂,半纤维素长链进一步断裂形成低聚糖和单糖[8]。富含半纤维素衍生物的水解液,经二次水解、浓缩和脱毒处理后可用于微生物发酵生产生物乙醇。自水解提取半纤维素可获得90%的聚糖组分[9],如能将其从水解液中以固体形式分离出来,进一步加工转化,可广泛用于食品用保水剂、增稠剂、乳化剂、寡糖保健品、水凝胶和薄膜形成剂等高附加值产品生产中。
本文以速生制浆用材相思木为原料,研究了水热预水解技术对半纤维素提取液中寡糖成分与含量的影响,采用真空低温浓缩结合乙醇沉淀方法,分离制备半纤维素,研究预水解条件对水解液中寡糖沉淀得率的影响,采用离子色谱和紫外光谱分析了半纤维素的成分和木素含量,最后采用红外光谱、核磁共振和热重分析对半纤维素进行了结构表征。
1 实验材料与方法
1.1实验原料
实验使用的相思木木片取自亚太森博浆纸有限公司,产地越南,贮存期6个月左右。木片化学成分为:葡萄糖,42.96%;木糖,19.90%;甘露糖,3.22%;半乳糖,0.96%;阿拉伯糖,0.73%(碳水化合物总计67.77%);Klason木素,18.64%;酸溶木素,2.22%;苯醇抽提物,12.33%;灰分,0.44%。
1.2主要试剂与仪器
试剂:无水乙醇(沉淀回收半纤维素用)和硫酸(水解液补充水解用),分析纯级,天津科密欧化学试剂有限公司;溴化钾,光谱级,国药集团化学试剂有限公司;木糖、葡萄糖、阿拉伯糖、甘露糖、半乳糖标准物,色谱级,Sigma-Aldrich;屈臣氏纯净水(离子色谱分析用)。
仪器:热重分析仪(SDT Q600,美国TA仪器公司),旋转蒸发器(RV10,德国IKA公司),低速台式离心机(PT5-1,北京时代北利离心机有限公司),冷冻干燥仪(7740070,美国LABCONCO公司),紫外分光光度计(Cary300,美国瓦里安公司),红外光谱仪(Frontier FT-IR,美国珀金埃尔默公司),智能油浴加热器(ZKYY-10L,杭州杰尔实验仪器公司),离子色谱仪(Dionex-5000,美国戴安公司),核磁共振仪(Bruker Advance Ⅲ 400,德国布鲁克公司)。
1.3实验方法
1.3.1木片的水热预水解实验取绝干木片60 g置于500ml压力反应釜中,液比1:4,密封后放入智能油浴锅中,保温温度分别为160、170、180℃,保温时间为0~140 min(本实验旨在探究半纤维素乙醇沉淀的最佳预水解条件,水解45min后,不同水解温度下都达到最大值,因此本文只列举水解至45 min的数据)。收集水解液进行糖的测定和进行乙醇沉淀回收半纤维素。
1.3.2水解液中半纤维素的分离回收取100 ml水解液,经真空旋转蒸发浓缩至20 ml(40℃,0.1 MPa),将浓缩液按体积比1:9加入无水乙醇沉淀半纤维素20 min,将混合物离心分离10 min后(4000 r·min−1),倒掉上层液,将离心管放入冰箱冷冻6 h后,转移至冷冻干燥仪冻干24 h,得到白色粉末状半纤维素,称重按式(1)计算回收率(对原料碳水化合物)。
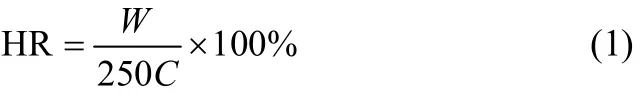
式中,HR为半纤维素回收率,%;W为沉淀半纤维素得率,g·L−1;C为原料碳水化合物含量,67.77%;250为按液比计算1 L预水解液的木片质量,g。
1.3.3水解液中聚糖及乙醇沉淀半纤维素糖类组分分析水解液中聚糖组分及含量采用戴安离子色谱仪[ED5000 电化学检测器,分析柱为CarboPacTM PA20(150 mm×3 mm)]分析,分析条件为:保护柱为CarboPacTM PA20(30 mm×3 mm),柱温30℃;洗脱液为0.2 mol·L−1NaOH溶液,流速1 ml·min−1。取适量的水解液,在质量分数4%的硫酸溶液中,121℃下补充酸解处理1 h,酸解液稀释一定倍数,过0.45 μm滤膜后进行糖组分与含量分析,补充水解前后糖含量的增加值为水解液中聚糖含量[10-11]。称取适量乙醇沉淀半纤维素样品,在质量分数4%的硫酸溶液中,121℃下酸解1 h,酸解液稀释一定倍数,过0.45 μm滤膜后进行糖组分与含量分析。糖组分与含量测定的标准曲线制定:将色谱级葡萄糖、木糖、阿拉伯糖、甘露糖和半乳糖配制浓度10 μg·L−1的标准糖混合液进行分析确定。
1.3.4乙醇沉淀半纤维素中木素分析半纤维素的酸溶木素含量测定参见TAPPI UM250。称取适量的半纤维素样品,在4%硫酸溶液和121℃下水解1 h,0.45 μm滤膜过滤酸解液,将滤液稀释适当倍数,以4% H2SO4溶液为参比液,在205 nm处测定溶液吸光度值,酸溶木素含量按式(2)计算[2]
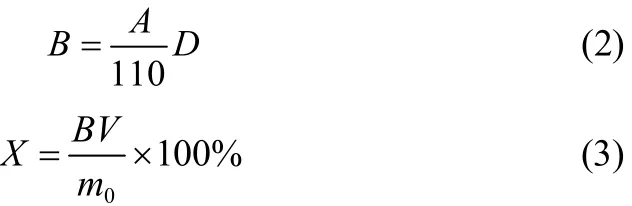
式中,X为回收半纤维素中木素含量,%;A为吸光度值;D为滤液稀释倍数;110为吸光系数,L·(g·cm)−1;B为滤液中酸溶木素的含量,g·L−1; V为滤液的总体积,L;m0为绝干试样质量,g。
1.3.5乙醇沉淀半纤维素的表征红外光谱分析:170℃/20 min、160℃/40 min、180℃/15 min、170℃/15min和170℃/25min的样品进行红外光谱分析(Perkin Elmer Frontier FT-IR),样品经干燥研磨后以质量分数1%的KBr压片,傅里叶红外光谱仪对半纤维素进行红外光谱分析,波数扫描范围为4000~400cm−1。
热重分析[12]:样品进行热稳定性分析(SDT Q600,TA instruments,DE),10 mg左右的样品升温到105℃保温10 mim去除水分,然后在氮气环境下以10℃·min−1速率升温到600℃,记录样品热失重行为。
核磁共振分析[13]:170℃/20 min样品进行核磁共振分析(Bruker Advance Ⅲ 400),30 mg样品溶解在1.0 ml D2O中,以四甲基硅烷为内标在400 MHz,25℃环境下进行1H谱分析。60 mg样品溶解在1.0 ml D2O中以四甲基硅烷为内标在100.6 MHz,25℃环境下扫描30000次进行13C谱分析。
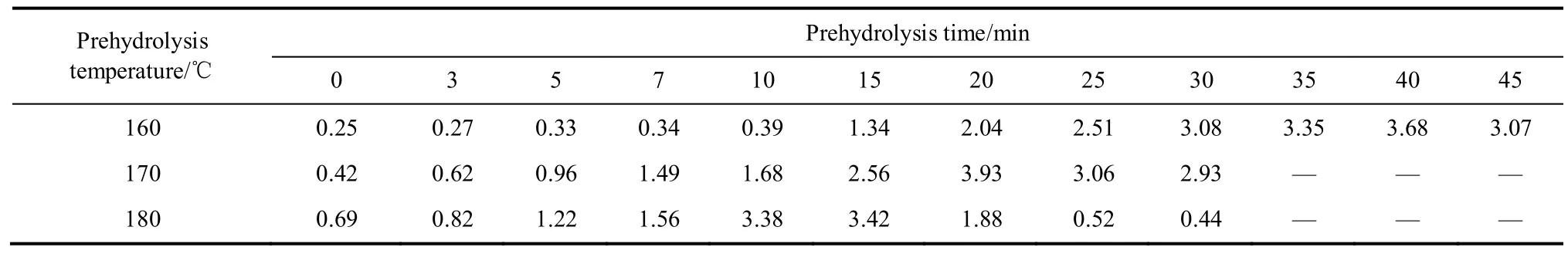
表1 不同水解条件下乙醇沉淀半纤维素的回收率(对木片碳水化合物)Table 1 Recovery rate of hemicelluloses obtained at various prehydrolysis conditions (against content of carbohydrate of wood chip)/%
2 结果与讨论
2.1预水解条件对乙醇沉淀半纤维素回收率的影响
由表1可知,水解温度对乙醇沉淀半纤维素回收率影响显著。水解温度为160℃时,半纤维素的回收率随保温时间的延长逐渐增加,在0~10 min内,半纤维素的回收率较低且增加速率缓慢,这可能是因为在较低水解温度下,较短的水解时间难以破坏木质纤维组织结构,半纤维素的解聚和溶出有限所致。随着水解时间的进一步增加,15 min以后,半纤维素的回收率明显增加,且增加速率较快,在40 min时回收率达到最大值3.68%,保温时间进一步延长,回收率开始下降,此时可能发生了聚糖的解聚。水解温度为170℃时,半纤维素的回收率随保温时间的延长速率增加比较明显,保温至20 min时达到最大值3.93%,与160℃水解40 min时的最大回收率比较接近,但保温时间却缩短了15 min。水解温度为180℃时,获得最大回收率的水解时间进一步缩短为15 min,但回收率降低为3.42%。且当水解时间超过20 min后,半纤维素回收率迅速降低。水解温度不但对半纤维素最大回收率产生影响,同时也影响最大回收率所需要的水解时间,提高温度,可缩短获得最大半纤维素回收率的水解时间。
2.2预水解条件对水解液中聚糖含量的影响
从表2中可以看出,相思木水解液中主要聚糖成分为聚木糖,还含有少量的聚阿拉伯糖、聚半乳糖和聚甘露糖,少量聚葡萄糖说明水解过程中,可能纤维素也发生一定的解离和溶出,但程度较低,这主要是由于纤维素的高分子量和晶态结构[14-15],也可能是来源于阔叶木半纤维素中的聚葡萄糖甘露糖[2]。在相同水解温度下(170℃),聚木糖浓度和总聚糖浓度随水解时间(15~25 min)的延长而增加,与表1数据比较可知,乙醇沉淀半纤维素回收率并未随着水解液中聚糖含量的升高而持续提高,在170℃水解25 min时聚木糖和总聚糖浓度均高于170℃水解20 min的数值,但水解20 min时的乙醇沉淀半纤维素回收率为3.93%,大于25 min时的3.06%。180℃,水解15 min时聚木糖和总聚糖含量分别达到13.55 g·L−1和18.93 g·L−1,但乙醇沉淀半纤维素回收率为3.42%,低于160℃/40 min和170℃/25 min水解液的回收率。说明水解液聚糖浓度提高并不意味半纤维素回收率提高,这可能与水解液聚糖平均聚合度有关,温度升高,水解液中虽然聚糖浓度高,但其平均聚合度降低。
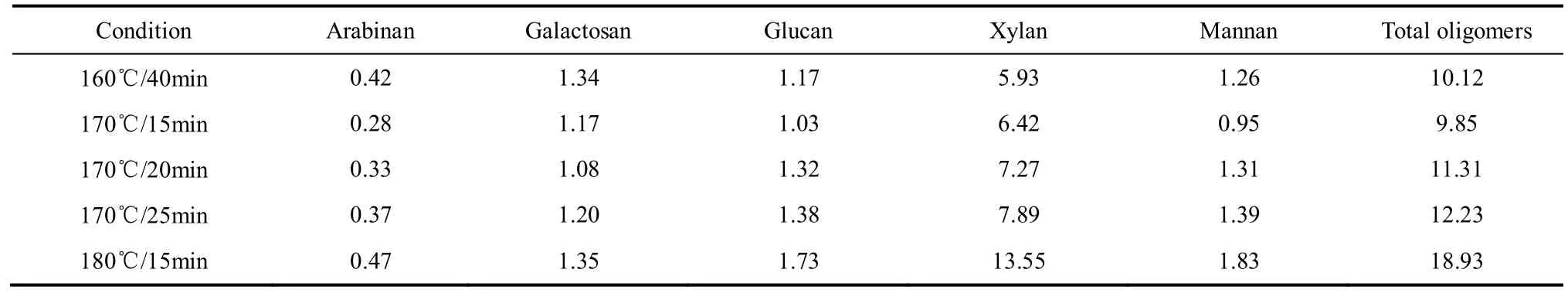
表2 不同预水解条件下水解液中各聚糖的含量Table 2 Content of oligomers in prehydrolysate obtained at various prehydrolysis conditions/g·L−1
2.3不同预水解条件下回收半纤维素组分与含量
由表3可知,乙醇回收半纤维素主要由木糖、葡萄糖、半乳糖和少量甘露糖、阿拉伯糖组成。不同水解条件下回收半纤维素的糖类物质组成比较接近,其中木糖的含量最高,占72.56%~75.76%,其次为葡萄糖,占9.78%~12.03%,半乳糖含量略低于葡萄糖,占7.24%~10.0%,主要是来自聚木糖主链上连接的半乳糖侧链[16]。少量阿拉伯糖存在,可能是由于聚木糖骨架的侧链上仍保留有部分阿拉伯糖连接[17]。回收半纤维素中检测到少量酸溶性木素,占物质组成0.96%~2.31%,这可能是来自阔叶木聚木糖和聚葡萄糖甘露糖主链上以α-醚键、酯键和缩醛键连接木素单元的木素-碳水化合物复合体(lignin carbohydrate compound,LCC),Chen等[18]研究报道,混合阔叶木160℃水解40min后,LCC木素连接键会发生比较缓慢的断裂。
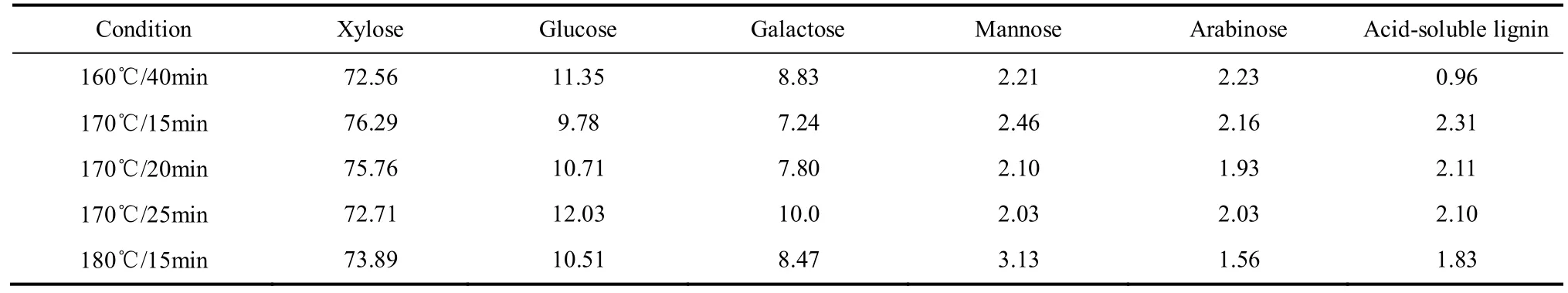
表3 不同预水解条件下回收半纤维素各组分与含量Table 3 Composition and content of recovered hemicellulose obtained at various prehydrolysis conditions/%
2.4回收半纤维素的红外光谱分析
160、170和180℃水解温度下,回收率最大的半纤维素样品及170℃时回收率最大值附近的半纤维素样品红外光谱分析如图1所示。不同水解条件下,乙醇沉淀回收半纤维素的红外光谱特性没有显著差异,其中3420 cm−1处吸收峰为O H的伸缩振动,2917 cm−1处的吸收峰为甲基和亚甲基C H的伸缩振动,1735 cm−1处的吸收峰为非共轭C O或乙酰酯键的伸缩振动[19],说明回收半纤维素链结构中仍保留有乙酰基存在。1378 cm−1和1420 cm−1附近吸收主要来自C H和C O的弯曲或伸展振动。1610~1620 cm−1处可能为半纤维素中的吸附水[20]。1048 cm−1处的强吸收归属于聚木糖上的C O,C C或C OH的伸展振动,897 cm−1处的轻微吸收峰主要为半纤维素结构中的(1→4)β-糖苷键,说明回收半纤维素的聚合状态。1515 cm−1处的弱吸收是典型的木素芳香特征振动,证明回收半纤维素中存在有少量的LCC。
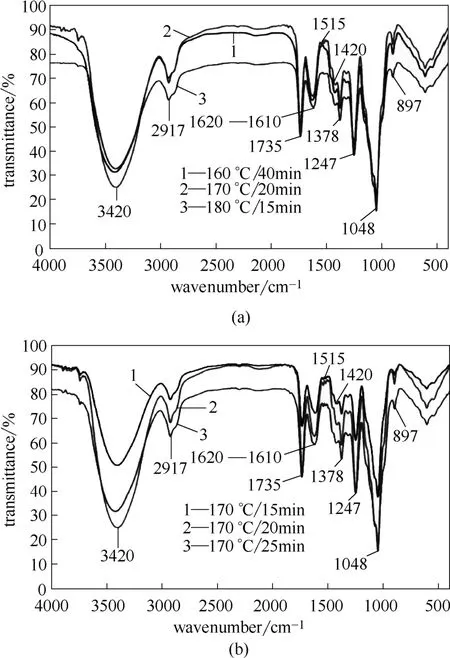
图1 不同预水解条件下回收半纤维素的红外光谱Fig.1 FT-IR spectras of hemicellulose sample obtained at various prehydrolysis conditions
2.5回收半纤维素的热重分析
不同水解温度下,回收率最大的3个样品160℃/40min、170℃/20min和180℃/15min,及170℃下,回收率最大值附近的半纤维素样品的热重曲线(TG)及微分曲线(DTG)如图2所示。40~100℃之间的热重损失是由于半纤维素样品中的水分蒸发所致。半纤维素的主要失重温度区间在180~350℃之间,符合半纤维素的热解特征[21]。300℃时样品的热失重率达到60%,最大的失重速率发生在210~220℃范围内,具体数据如表4所示,与碱抽提半纤维素相比,出现最大失重速率的温度明显提前[22]。
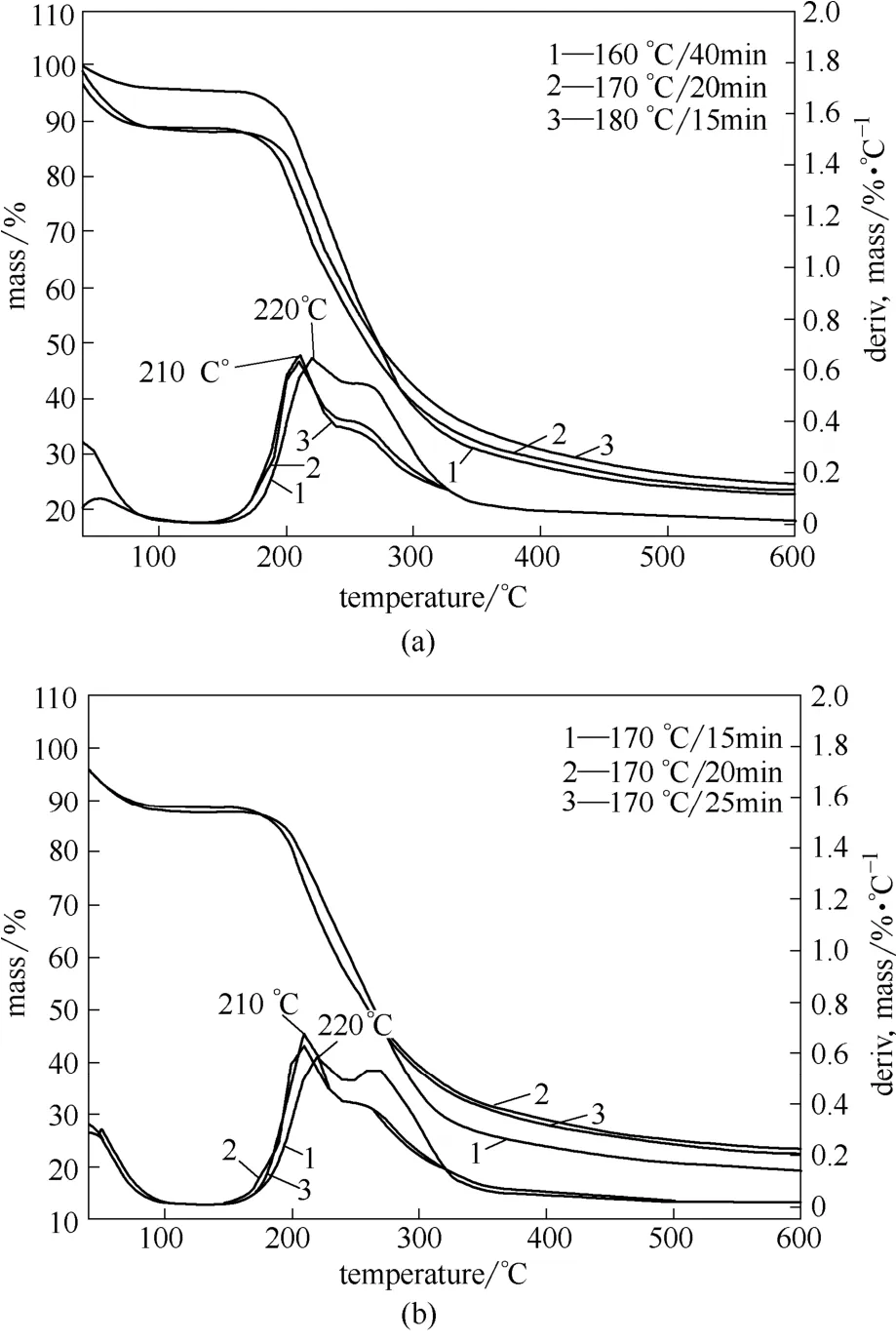
图2 不同水解条件下回收半纤维素的热重分析Fig.2 TGA/DTG curves of hemicellulose sample obtained at various prehydrolysis conditions
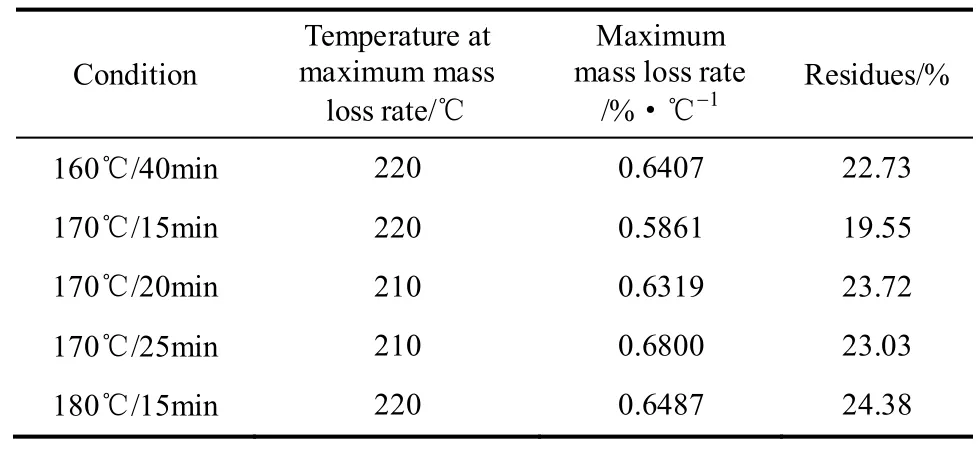
表4 不同预水解条件下半纤维素的热解数据Table 4 TGA data of recovered hemicelluloses obtained at various prehydrolysis conditions
由表4数据可知,回收半纤维素的最大的失重速率发生在210~220℃范围内。在170℃时,预水解时间从15 min提高到20 min后,半纤维素的最大失重速率所对应的温度由220℃降低到210℃,继续从20 min提高到25 min后,半纤维素的最大失重速率所对应的温度保持不变,但最大失重速率由0.6319%·℃−1增加为0.6800%·℃−1。180℃/15 min回收半纤维素的最大失重温度与170℃/15min相同,但最大失重速率提高,由0.5861%·℃−1增至0.6487%·℃−1。160℃/40 min回收半纤维素的最大失重温度为220℃,最大失重速率与170℃/20 min相近。随着水解温度提高和时间的延长,回收半纤维素的热稳定性总体呈现降低趋势。
2.6回收半纤维素的核磁共振光谱分析
本实验条件下,回收率最大的半纤维素样品170℃/20min的13C NMR分析如图3所示。
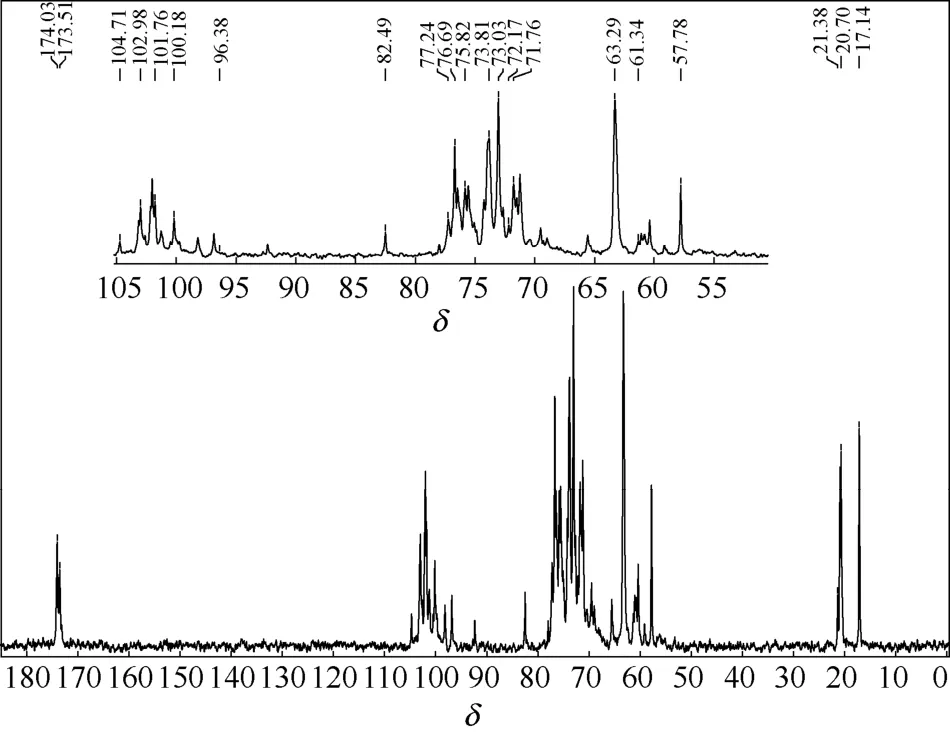
图3 170℃/20 min预水解条件下回收半纤维素的13C NMR谱图Fig.313C NMR spectra of hemicellulose sample obtained at prehydrolysis condition of 170℃/20min
δ值为101.76、76.69、73.81、73.03及63.29 的5个强信号峰归属于(1→4)-β-D-吡喃木糖(β-D-xylp)单元上的C-1、C-4、C-3、C-2、C-5,说明回收半纤维素中存在木糖,δ值为104.71、82.49、77.24、75.82及57.78处的信号峰归属于β-D-木糖主链侧链上残留阿拉伯糖基上的C-1、C-4、C-3、C-2、C-5。δ值为72.17与71.76处的两个信号峰源于残留的葡萄糖醛酸上的C-3和C-2,δ值为60.80 与103.14处的2个信号峰归属于β-聚葡聚糖上的C-6和C-3[23-24]。δ值174.01处归属于C-6甲基糖醛酸的羰基。δ值为102.98、74.24及61.34的3个信号峰归属于D-吡喃甘露糖(D-Manp)的C-1、C-3、C-6。δ值为100.18的信号峰归属于吡喃半乳糖(Glap)的C-1。在低场δ值为173.51处以及高场δ值为20.70处有较强的吸收峰,这分别归属于乙酰基的C O和CH3,表明半纤维素中含有乙酰基[16]。

图4 170℃/20 min预水解条件下回收半纤维素的1H NMR 谱图Fig.4 1H NMR spectra of hemicellulose sample obtained at prehydrolysis condition of 170℃/20min
图4是170℃/20 min回收半纤维素1H NMR谱图。δ在1.19~1.22之间的强信号峰是由半纤维素上乙酰基的甲基质子所产生。δ值在2.08(自由态)~2.25(键合态)间的共振峰表明聚木糖主链上链接有乙酰基[13]。1H NMR谱图与以4-O-甲基葡萄糖醛酸聚木糖为主的阔叶木半纤维素的研究结果一致[24]。δ值在4.42~5.60处的信号归属于β-异头氢质子,5.02~5.31处的信号则归属于α-异头氢质子。4.99~5.02处信号归属于带残余的末端阿拉伯呋喃糖的异头氢质子信号[14]。在5.10与5.04处的信号峰分别归属于聚木糖和葡萄糖醛酸末端还原基的异头氢质子[24]。4.48~4.51处信号归属于(1→4)-β-D-吡喃聚木糖(Xylp)。5.21处信号归属于α-D-吡喃聚甘露糖,4.57~4.62处则归属于β-D-吡喃聚木糖或β-D-吡喃聚半乳糖。
3 结 论
通过水热预水解分离相思木半纤维素,最佳乙醇沉淀回收半纤维素的预水解条件为170℃/20 min,回收率为原料碳水化合物的3.93%,回收半纤维素主要组分为木糖占75.56%,葡萄糖占10.71%,半乳糖占7.80%,以及少量甘露糖和阿拉伯糖,还含有2.10%的木素。160℃/40 min、170℃/15 min、170℃/25 min和180℃/15 min水解条件下的回收半纤维素与170℃/20 min时的回收半纤维素化学组分相同,但在含量上有所差别。水解温度提高和时间延长导致回收半纤维素热稳定性降低。回收半纤维素的聚木糖主链上残留有乙酰基、阿拉伯糖和半乳糖连接。回收制得的半纤维素可用于开发食品功能助剂和其他保健产品。
References
[1]EI-ASHMAWY A E, MOBARAK F, EI-KALIOBI S. Hemicelluloses as additives in papermaking [J]. Cellulose Chemical Technology,1976, 10: 637-643.
[2]杨淑蕙. 邱玉桂, 谭国民, 等.植物纤维化学 [M]. 3版.北京: 中国轻工业出版社, 2010: 214. YANG S H, QIU Y G, TAN G M, et al. Plant Fiber Chemistry [M]. 3th ed. Beijing:China Light Industry Press, 2010: 214.
[3]TUNC M S, VAN HEININGEN A. Hydrothermal dissolution of mixed southern hardwoods [J]. Holzforschung, 2008, 62: 539-545.
[4]VAN HEININGEN A. Converting a Kraft pulp mill into an integrated forest biorefinery [J]. Pulp Paper Canada, 2006, 107: 38-43.
[5]吕健, 詹怀宇, 胡会超, 等. 热水预抽提后竹子的纤维素酶解 [J].化工学报, 2010, 61 (10): 2667-2672. LÜ J, ZHAN H Y, HU H C, et al. Hydrolysis of bamboo pre-extracted with hot water by enzyme [J]. CIESC Journal, 2010, 61 (10): 2667-2672.
[6]赵旭红, 石海强, 张健, 等. 紫外光谱定量测定木质纤维预水解液中溶解性木素和糠醛含量 [J]. 化工学报,2015, 66 (6): 2295-2302. DOI: 10.11949/j.issn.0438-1157.20150012. ZHAO X H, SHI H Q, ZHANG J, et al. Determination of soluble lignin and furfural in lignocellulosic pre-hydrolysis liquid by UV spectroscopy [J]. CIESC Journal, 2015, 66(6): 2295-2302. DOI: 10.11949/j.issn.0438-1157.20150012.
[7]KIM Y, MOSIER N S, LADISCH M R E. Enzymatic digestion of liquid hot water pretreated hybrid poplar [J]. Biotechnology Progress, 2009, 25 (2): 340-348.
[8]VÁZQUEZ M J, GARROTE G, ALONSO J, et al. Refining of autohydrolysis liquors for manufacturing xylooligosaccharides: evaluation of operational strategies [J]. Bioresour. Technol., 2005, 96: 889-896.
[9]SUKHBAATAR B, HASSAN E B, KIM M, et al. Optimization of hot-compressed water pretreatment of bagasse andcharacterization of extracted hemicelluloses [J]. Carbohydrate Polymers, 2014, 101: 196-202.
[10]DAVIS M W. A rapid modified method for compositional carbohydrate analysis of lignocellulosics by high pH anion exchange chromatography with pulsed amperometric detection (HPAEC/PAD) [J]. J. Wood Chem. Technol., 1998, 18: 235-252.
[11]崔金龙, 李海明, 毕佳捷. 离子色谱在造纸原料碳水化合物分析中的应用 [J]. 大连工业大学学报, 2013, 32 (6): 432-436. CUI J L, LI H M, BI J J. Analysis of carbohydrates in paper-making materials by ion chromatography [J]. Journal of Dalian Polytechnic University, 2013, 32 (6): 432-436.
[12]SHI H Q, FATEHI P, XIAO H N, et al. A process for isolating lignin of pre-hydrolysis liquor of kraft pulping process based on surfactant and calcium oxide treatments [J]. Biochemical Engineering Journal, 2012, 68: 19-24.
[13]PENG H, WANG N, HU Z R, et al. Physicochemical characterization of hemicelluloses from bamboo(Phyllostachys pubescens mazel) stem [J]. Industrial Crops and Products, 2012, 37: 41-50.
[14]MITTAL A, SCOTT G M, AMIDON T E, et al. Quantitative analysis of sugars in wood hydrolyzates with1H NMR during the autohydrolysis of hardwoods [J]. Bioresour. Technol., 2009, 100: 6398-6406.
[15]PENG F, JIA N, BIAN J, et al. Isolation and fractionation of hemicelluloses from SALLX PSAMMOPHLIA [J]. Cellulose Chem. Technol., 2012, 46 (3/4): 177-184.
[16]NABARLATZ D, EBRINGEROV A, MONTANÉ D. Autohydrolysis of agricultural by-products for the production of xylo-oligosaccharides [J]. Carbohydr. Polym., 2007, 69: 20-28.
[17]PENG F, BIAN J, PENG P, et al. Fractional separation and structural features of hemicelluloses from sweet sorghum leaves [J]. BioResources, 2012, 7 (4): 4744-4759.
[18]CHEN X W, LAWOKO M, VAN HEININGEN A. Kinetics and mechanism of autohydrolysis of hardwoods [J]. Bioresour. Technol., 2010, 101: 7812-7819.
[19]SUN X F, SUN R C, FOWLER P, et al. Extraction and characterization of original lignin and hemicelluloses from wheat straw [J]. J. Agric. Food Chem., 2005, 53: 860-870.
[20]KACURAKOVA M, BELTON P S, WILSON R H. Hydration properties of xylan-type structures: an FTIR study of xylo-oligosaccharides [J]. Journal of the Science of Food and Agriculture, 1998, 77: 38-44.
[21]XU F, LIU C F, GENG Z C, et al. Characterisation of degraded organosolv hemicelluloses from wheat straw [J]. Polym. Degrad. Stab., 2006, 91: 1880-1886.
[22]程合丽, 詹怀宇, 李云兵, 等. 玉米秆半纤维素的碱法提取与表征[J]. 中国造纸学报, 2011, 26 (3): 26-29. CHENG H L, ZHAN H Y, LI Y B, et al. Isolation and characterization of corn stover hemicellulose [J]. Transactions of China Pulp and Paper, 2011, 26(3): 26-29.
[23]SUN R C, FANG J M, TOMKINSON J, et al. Fractional isolation, physico-chemical characterization and homogeneous esterification of hemicelluloses from fast-growing poplar wood [J]. Carbohydr. Polym., 2001, 44: 29-39.
[24]MATULOVA M, NOUAILLE R, CAPEK P, et al. Degradation of weat straw by Fibrobacter succinogenes S85: a liquid-and solid-state nuclear magnetic resonance study [J]. Appl. Environ. Microbiol., 2005, 3: 1247-1253.
Isolation of hemicelluloses from acacia wood with hydrothermal prehydrolysis and its characterization of structure and component
ZHU Ning1, SHI Haiqiang1,2, CAO Nan1, XIONG Xuedong1, NIU Meihong1, PING Qingwei1
(1School of Light Industry & Chemical Engineering, Dalian Polytechnic University, Dalian 116034, Liaoning, China;
2State Key Laboratory of Pulp and Paper Engineering, South China University of Technology, Guangzhou 510640, Guangdong, China)
Abstract:Hydrothermal prehydrolysis of acacia wood was conducted at various conditions and the hemicelluloses dissolved in prehydrolysate was recovered by ethanol precipitation. Conditions test design was used to optimize the pre-hydrolysis conditions for the maximum hemicelluloses recovery rate as solid phase. Then, the composition, thermal stability and structural characterization were analyzed on the recovered hemicelluloses. The optimum pre-hydrolysis temperature and time were determined to be 170℃ and 20 min, respectively. Recovery rate of 3.93% against carbohydrate content of wood chip was obtained under the optimum conditions and main composition was xylose, accounting for 75.56% in mass, and 10.71% of glucose and 7.80% of galactose were also found. The recovered hemicelluloses at 160℃/40 min, 170℃/15 min,170℃/25 min and 180℃/15 min showed a same composition with the result of 170℃/20 min but a little bit difference in the content by the analysis of ion chromatography. The thermo gravimetric analysis indicated that thermal stability of recovered hemicelluloses decreased along with the improvement of prehydrolysis temperature and extension of prehydrolysis time. Linkageof acetyl group, arabinose and galactose was found on the xylan chain by the analysis of nuclear magnetic resonance and Fourier transform infrared spectroscopy.
Key words:biomass; hydrolysis; hemicelluloses; separation; hydrothermal
中图分类号:TQ 353.1+4;TS 71+1
文献标志码:A
文章编号:0438—1157(2016)06—2605—07
DOI:10.11949/j.issn.0438-1157.20151842
基金项目:国家自然科学基金项目(31470603);辽宁省自然科学基金项目(2015020592);辽宁省“百千万人才工程”培养项目(2014921064);制浆选纸工程国家重点实验室项目(201449)。
Corresponding author:SHI Haiqiang, shihq@dlpu.edu.cn;NIU Meihong, niumh@dlpu.edu.cn

