补阳还五汤对脑缺血再灌注损伤大鼠GSK3β mRNA的影响
赖日明,朱原,郑丽娴,张继平
(1.广州市增城区中医院,广东广州 510000;2.南方医科大学中医药学院,广东广州 510515;3.南方医科大学附属佛山医院,广东佛山 528000)
补阳还五汤对脑缺血再灌注损伤大鼠GSK3β mRNA的影响
赖日明1,朱原2,郑丽娴2,张继平3
(1.广州市增城区中医院,广东广州510000;2.南方医科大学中医药学院,广东广州510515;3.南方医科大学附属佛山医院,广东佛山528000)
摘要:【目的】探讨补阳还五汤对脑缺血再灌注大鼠糖原合成酶激酶-3β(GSK3β)mRNA表达与CD63的影响。【方法】将SPF级雄性SD大鼠60只随机分为假手术组,模型组,氢氯吡格雷组,补阳还五汤高、低剂量组,每组12只。氢氯吡格雷组灌胃给予氢氯吡格雷水溶液6.8 mg·kg-1·d-1,补阳还五汤高、低剂量组分别给予补阳还五汤水溶液26、6.5 g·kg-1·d-1,其余各组给予生理盐水;连续给药14 d后,采用右侧大脑中动脉线栓法复制大鼠急性局灶性脑缺血再灌注模型;测定各组大鼠血浆CD63含量与海马组织GSK3β mRNA表达情况。【结果】与假手术组比较,模型组大鼠脑梗死体积显著增加(P< 0.05),与模型组比较,补阳还五汤组与氢氯吡格雷组均能显著减少脑梗死体积(P<0.05);与假手术组比较,模型组海马组织GSK3β mRNA表达与血浆中CD63表达均显著升高(P<0.05);与模型组比较,补阳还五汤高、低剂量组与氢氯吡格雷组均能显著抑制海马组织GSK3β mRNA表达与血浆中CD63表达(P<0.05),而补阳还五汤高剂量组抑制作用更明显。【结论】补阳还五汤对脑缺血再灌注大鼠的保护作用可能与下调GSK3β mRNA过表达及抑制CD63表达有关。
关键词:补阳还五汤/药理学;脑缺血/中药疗法;基因表达调控;血小板活化;GSK3β mRNA;CD63;疾病模型,动物;大鼠
糖原合成酶激酶-3β(GSK3β)是一种广泛存在于中枢神经系统的丝/苏氨酸磷酸激酶,在细胞增殖分化、凋亡、炎症及血小板活化过程中具有重要作用[1]。有研究[4-6]证实,GSK3β在缺血性脑血管疾病、血小板活化进程中亦具有重要作用[2-3]。本课题组前期研究发现,补阳还五汤具有抗血小板与抗脑缺血等多重作用。本研究通过复制急性局灶性脑缺血模型,在检测大鼠海马组织中GSK3β mRNA表达的同时,测定大鼠血浆中血小板活化特异性指标CD63含量的变化,观察补阳还五汤预处理对脑梗死体积、GSK3β mRNA及CD63的影响,探讨补阳还五汤对脑缺血再灌注损伤的保护作用与磷脂酰肌醇3激酶/蛋白激酶B(PI3K/Akt)信号通路及血小板活化的关系,现报道如下。
1 材料与方法
1.1动物SPF级雄性SD大鼠60只,体质量250~300 g,由广东省医学实验动物中心提供,合格证号:SCXK(粤)2013-0002;动物实验设施由广东药学院实验动物中心提供,动物实验设施合格证号为:SYXK(粤)2012-0125。
1.2药物与制剂补阳还五汤颗粒剂水溶液按照《医林改错》所载的药味用量进行制备。处方为:生黄芪120 g,当归尾6 g,赤芍4.5 g,地龙、桃仁、红花、川芎各3 g(黄芪颗粒剂,批号:311001T;当归颗粒剂,批号:1307117;赤芍颗粒剂,批号:309081T;地龙颗粒剂,批号:1308206;川芎颗粒剂,批号:1308137;桃仁颗粒剂,批号:309127T;红花颗粒剂,批号:1307190),取相当于饮片等量的各味药颗粒剂(由广东一方制药有限公司提供)混合后,用100℃蒸馏水配制成补阳还五汤水溶液置于4℃冰箱冷藏备用,用前混匀;硫酸氢氯吡格雷片(赛诺菲制药有限公司,批号:2A782)。
1.3仪器与试剂LAUDA Aqualine恒温水浴箱(德国Lauda公司);ABI 7500型荧光定量PCR仪(美国ABI公司);Hema9600型基因扩增仪(珠海黑马医学仪器有限公司);1524R型低温冷冻离心机(珠海黑马医学仪器有限公司);JS-power300电泳仪与培清JS-780全自动凝胶成像分析仪(上海培清科技有限公司);K2800紫外核酸分析仪(北京凯奥科技有限公司);Trizol(美国Invitrogen公司,批号:10296 -010);三甲基十六烷基溴化铵(CTAB)(美国BBI公司,批号:CB0108);焦碳酸二乙酯(DEPC)(美国Sigma公司,批号:472565);琼脂糖(美国Hydragene公司,批号:R9012TAB);CD63试剂盒(华美生物公司,批号:CSB -E14117r);SYBRPremix Ex TaqTM日本TAKARA公司,批号:DRR420A),Reverse Transcriptase莫洛尼氏鼠白血病毒(M-MLV)试剂盒(日本TAKARA公司,批号:D2639A);其余所需试剂由广州化学制剂总厂提供。
1.4动物分组使用随机数字表法将大鼠随机分成5组,每组12只。即假手术组,模型组(均生理盐水灌胃),氢氯吡格雷组(剂量为6.8 mg·kg-1·d-1),补阳还五汤高剂量组、低剂量组(中药高、低剂量组;剂量分别为26,6.5 g·kg-1·d-1),以上各组所用剂量均参照课题组前期实验[4],即参照动物与人体等效换算标准换算;适应性饲养1周后,再给予相应的药物(即高剂量组以2.6 g/mL,低剂量以0.65 g/mL补阳还五汤水溶液灌胃,氢氯吡格雷组以0.68 mg/mL氢氯吡格雷水溶液灌胃,其他组按100 g/mL生理盐水灌胃给药),每天2次,连续2周。
1.5局灶性脑缺血再灌注模型制作大鼠造模参照Longa[7]报道的方法,采用大鼠右侧大脑中动脉线栓法(MCAO)复制局灶性脑缺血模型。大鼠以100 mg/L水合氯醛(3 mL/kg)腹腔注射麻醉后,将大鼠固定于手术操作台上,消毒后其余步骤参照文献[8]进行。假性手术组用仅作皮肤切开和血管剥离,不做栓线处理,其余操作同其他组。
1.6观察指标
1.6.1红四氮唑(TTC)染色测脑梗死体积每组取4只大鼠,以100 mg/L水合氯醛麻醉后,断头取大脑,置于-20℃冷冻20 min后,将脑组织切成2 mm薄的脑片放入20 g/L TTC溶液,37℃水浴锅温孵30 min后放入体积分数10%甲醛溶液,15 min后取出脑组织;数码相机对脑片进行照相后,采用Image-Pro软件计算脑梗死体积(即梗死面积乘以脑片厚度)。
1.6.2酶联免疫吸附法检测血浆CD63含量眼球摘除取血约2 mL置于真空肝素钠抗凝管中,4℃、3 000 r/min,离心30 min,吸取血浆,放置于-20℃冰箱,备测。采用酶联免疫定量检测技术检测大鼠血浆CD63的含量;操作过程均严格按照试剂说明书进行。
1.6.3实时荧光定量聚合酶链式反应(RT-qPCR)测定海马组织GSK3β mRNA表达大鼠经100 mg/L水合氯醛腹腔注射麻醉(3 mL/kg),生理盐水灌洗,以40 g/L多聚甲醛固定后迅速取脑组织,分离海马,用RNA later溶液预处理海马组织。Trizol法进行总RNA提取海马组织总RNA,引物设计与合成由广州贝奥吉因生物科技有限公司完成,GSK3β上游引物序列:5’-GGACAGTGGTGTGGAT CAGT-3’,GSK3β下游引物序列:5’-CCGAAAGA CCTTCGTCCAA-3’;GADPH内参上游引物序列:5’-AGACAGCCGCATCTTCTTGT-3’;GADPH内参下游引物序列:5’-TGATGGCAACAA TGTCCACT-3’。使用RNase-free的DNaseⅠ配置反应液,37℃消化30 min,65℃灭活10 min RNA去除基因组,检测纯度提示:28S、18S电泳条带边缘清晰,5S条带边缘欠清晰,28S与18S条带比值介于1.8~2.0之间,说明RNA未降解(见图1)。反转录:在PCR管中加入模板RNA、引物混合物,70℃保温10 min后迅速在冰上冷却2 min,按说明书在该管中加入相应试剂后42℃保温60 min;72℃保温15 min;-20℃保存备用。定量:cDNA稀释3倍,使用7500 software 95℃、30 s;95℃、3 s,60℃、34 s收集荧光信号,45个循环;反应结束后,确认Real-time PCR的扩增曲线和熔解曲线(见图2、图3),由电脑自动分析并计算出反应体系中待测样本cDNA达到设定阈值的循环数(cycle count,Ct)。实验中各个样本均做2个复孔。以假手术组做对照,使用2-△△Ct值计算mRNA相对表达情况。
图1 RNA电泳图Figure 1 RNA electrophoresis results

图2 PCR扩增曲线Figure 2 Amplification plot of GSK3β and GADPH
1.7统计方法采用SPSS 19.0统计软件进行数据的统计分析。结果以均数±标准差(±s)表示,计量资料比较采用单因素方差分析,组间比较采用LSD-T检验;等级资料比较采用Kruskal-Wallis检验。以P<0.05为差异有统计学意义。
图3 PCR熔解曲线Figure 3 Melting curve of GSK3β and GADPH
2 结果
2.1各组对脑梗死体积的影响表1结果显示:模型组大鼠脑梗死体积较假手术组显著增加(P<0.05);与模型组比较,中药组与氢氯吡格雷组均能显著减少脑梗死体积(P<0.05),其中以中药高剂量组效果更好。
2.2各组对血浆CD63含量的影响表1结果显示:与假手术组比较,模型组血浆中CD63表达显著升高(P<0.05);与模型组比较,中药组与氢氯吡格雷组均能显著抑制血浆中CD63表达(P<0.05),表明补阳还五汤能显著抑制血小板活化,其效果与氢氯吡格雷比较无显著性差异。
表1 各组对脑梗死体积、CD63的影响Table 1 Comparison of infarction volume and CD63 expression in various groups (±s)
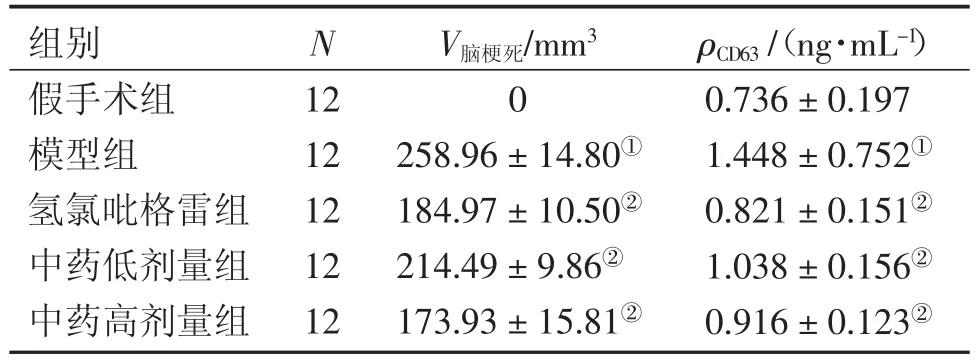
表1 各组对脑梗死体积、CD63的影响Table 1 Comparison of infarction volume and CD63 expression in various groups (±s)
①P<0.05,与假手术组比较;②P<0.05,与模型组比较
组别假手术组模型组氢氯吡格雷组中药低剂量组中药高剂量组N 12 12 12 12 12 V脑梗死/mm30 258.96±14.80①184.97±10.50②214.49±9.86②173.93±15.81②ρCD63/(ng·mL-1)0.736±0.197 1.448±0.752①0.821±0.151②1.038±0.156②0.916±0.123②
2.3各组对海马组织中GSK3β mRNA表达的影响表2结果显示:模型组GSK3β mRNA表达较假手术组显著升高(P<0.05);与模型组比较,中药组与氢氯吡格雷组均能显著下调GSK3β mRNA的病理性过表达(P<0.05),其中以中药高剂量组调节作用明显。
表2 各组对海马组织中GSK3β mRNA表达的影响Table 2 Comparison of GSK3β mRNA expression in various groups (±s,n2-△△Ct)

表2 各组对海马组织中GSK3β mRNA表达的影响Table 2 Comparison of GSK3β mRNA expression in various groups (±s,n2-△△Ct)
①P<0.05,与假手术组比较;②P<0.05,与模型组比较
组别假手术组模型组氢氯吡格雷组中药低剂量组中药高剂量组N 12 12 12 12 12 GSK3β mRNA 1.027±0.286 6.689±1.113①3.746±0.599②3.378±0.629②1.810±0.457②
3 讨论
补阳还五汤出自《医林改错》,在血栓性疾病防治中应用广泛。前期研究[4-6]发现:补阳还五汤具有改善血液流变、抗血栓、抗脑缺血及再灌注损伤等作用,并认为其机制可能与调节蛋白激酶B (Akt)信号通路有关;此外,本课题组研究还发现补阳还五汤预处理能显著改善大鼠神经功能评分,并下调人第10号染色体缺失的磷酸酶及张力蛋白同源的基因(PTEN基因)过表达及抑制CD62P的表达,认为补阳还五汤对脑缺血再灌注损伤的保护作用可能与下调PTEN基因过表达与抑制CD62P表达有关[9];而Chen[10]关于补阳还五汤对脑缺血小鼠的多重蛋白组学作用的分析发现,补阳还五汤能抑制GSK与Tau蛋白活性,但其对GSK3β的影响仍待进一步阐明。GSK3β是一种丝/苏氨酸磷酸激酶,不仅可通过调节Akt信号细胞凋亡,还可通过调节核因子-κB(NF-κB)、toll样受体(TLR)参与炎症反应[1,11];本研究结果显示:补阳还五汤能下调海马组织中GSK3β mRNA的病理性过表达,认为其可能通过下调GSK3β表达干预不同信号通路进而起到抗凋亡、抗炎、抗脑缺血的作用。
此外,GSK3β在血小板活化进程中亦有重要作用,多项研究表明:GSK3β可调节血小板活化进程[11-13]。血小板活化是复杂的过程,血小板的活化除了参与溶栓与凝血的正常生理功能外,还可能与肿瘤血管新生、疼痛等进程有关,研究认为血小板可通过CD62P等血小板膜糖蛋白与白细胞反应参与炎症反应进程[14]。此外,CD62P、CD63在脑缺血疾病进展中亦具有一定作用[15-16]。综上所述,GSK3β在血小板活化、细胞凋亡、抗炎、抗脑缺血作用中有重要作用,其可通过干预不同信号通路发挥作用,而CD63作为血小板膜糖蛋白,在血小板活化及脑缺血中亦具有重要意义[10-15]。因此,本研究在前期研究基础上检测脑梗死体积、GSK3β mRNA及CD63表达情况,结果提示补阳还五汤能显著减少脑梗死体积,其机制可能与抑制GSK3β mRNA及CD63表达有关。此外,本研究发现补阳还五汤能下调过表达的GSK3β基因和抑制CD63分子的表达,与本课题组前期研究补阳还五汤具有抗血小板作用并可能通过干预Akt信号通路发挥抗脑缺血再灌注损伤的作用相吻合[4-5];与补阳还五汤下调PTEN基因过表达与抑制CD62P表达的结果亦相吻合;虽然本课题组发现补阳还五汤能通过调节PI3K/AKT信号通路发挥神经保护作用;但PI3K/Akt作为体内重要的通路之一,亦可能通过Akt下游信号干预NF-κB炎性信号通路发挥作用;因此,其神经保护作用是否仍与调节NF-κB信号通路干预炎症通路,减轻脑细胞炎性损害有关,仍待进一步研究。未来将通过Western-blot进一步观察补阳还五汤对GSK3β及其他相关蛋白的表达以进一步验证本研究的结论。此外,补阳还五汤能抑制CD63分子表达而抑制血小板活化,与目前抑制GSK3β可促进血小板活化的结果有一定差异,其可能与补阳还五汤的多种成分有关,提示补阳还五汤可能通过多靶点调控实现其抗栓、抗脑缺血的作用;但补阳还五汤同时抑制血小板活化与下调GSK3β mRNA表达的确切原因仍待进一步探讨。
参考文献:
[1]张丹丹,李璐,陈煜.糖原合成酶激酶-3在炎症反应中的研究[J].胃肠病学和肝病学杂志,2013,22(11):1172.
[2]张慧,姜咏梅,尹琳.PI3K/AKT/GSK-3β信号在脑缺血预处理中的作用及对海马细胞凋亡的影响[J].华中科技大学学报(医学版),2011,40(4):408.
[3]Laurent P A,Severin S,Gratacap M P,et al.Class I PI 3-kinases signaling in platelet activation and thrombosis:PDK1/ Akt/GSK3 axis and impact of PTEN and SHIP1[J].Adv Biol Regul,2014,54:162.
[4]蔡俊,张继平,姚晖,等.补阳还五汤对急性脑缺血再灌注大鼠脑组织AKT和p-AKT蛋白表达的影响[J].中国实验方剂学杂志,2015,21(6):122.
[5]王日生,蔡俊,张继平.补阳还五汤对大鼠急性脑缺血再灌注损伤的保护作用及机制[J].实用医学杂志,2015,31(5):725.
[6]宫丽,张继平,李齐欢,等.补阳还五汤家兔含药血清对PAF诱导的家兔血小板聚集的影响[J].中国实验方剂学杂志,2009,15(7):60.
[7]Longa E Z,Weinstein P R,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84.
[8]周赛男,蔺晓源,易健,等.补阳还五汤对脑缺血大鼠神经功能及细胞形态的影响[J].中国实验方剂学杂志,2013,19 (20):251.
[9]朱原,蔡俊,徐愉林,等.补阳还五汤对脑缺血再灌注损伤大鼠PTEN mRNA的影响[J].中国实验方剂学杂志,2015,21(23):135.
[10]Chen H J,Shen Y C,Shiao Y J,et al.Multiplex brain proteomic analysis revealed the molecular therapeutic effects of Buyang Huanwu Decoction on cerebral ischemic stroke mice[J].PLoS One,2015,10(10):e0140823 .
[11]Ramirez S H,Fan S,Zhang M,et al.Inhibition of glycogen synthase kinase 3β(GSK3β)decreases inflammatory responses in brain endothelial cells[J].Am J Pathol,2010,176(2):881.
[12]Moore S F,van den Bosch M T,Hunter R W,et al.Dual regulation of glycogen synthase kinase 3(GSK3)α/β by protein kinase C(PKC)α and Akt promotes thrombin-mediated integrin αIIbβ3 activation and granule secretion in platelets[J].J Biol Chem,2013,288(6):3918.
[13]Moroi A J,Watson S P.Akt and MAPK enhance CLEC-2-mediated platelet activation by inhibition of GSK3α/β[J].J Thromb and Haemost,2015,13(6):1139.
[14]Schattner M.Platelets and galectins[J].Ann Transl Med,2014,2(9):85.
[15]曲娟,朱晓东,胡进.丹红注射液对短暂性脑缺血发作患者CD62p、CD63的影响[J].浙江中医杂志,2014,49(9):636.
[16]刘运涌,蔡菁,贺峰,等.前循环进展性脑梗死患者颈动脉硬化分析及血小板CD62p表达[J].中华老年心脑血管病杂志,2015,17(4):396.
【责任编辑:黄玲】
Effect of Buyang Huanwu Decoction on Glycogen Synthase Kinase 3β mRNA Expression in Cerebral Ischemia-reperfusion Injury Rat Model
LAI Riming1,ZHU Yuan2,ZHENG Lixian2,ZHANG Jiping3
(1.Zengcheng District Hospital of Traditional Chinese Medicine,Guangzhou 510000 Guangdong,China;
2.College of Traditional Chinese Medicine,Southern Medical University,Guangzhou 510515 Guangdong,China;
3.Foshan Hospital Affiliated to Southern Medical University,Foshan 528000 Guangdong,China)
Abstract:Objective To investigate the effect of Buyang Huanwu Decoction(BHD)on the expression of glycogen synthase kinase 3β(GSK3β)mRNA and CD63 in cerebral ischemia-reperfusion injury rat model.Methods Sixty adult male Sprague-Dawley rats at specific-pathogen free level were evenly randomized into 5 groups,shamoperation group,model group,clopidogrel group,high- and low-dose BHD groups.Clopidogrel group was intragastrically administrated with 6.8 mg·kg-1·d-1of clopidogrel,high- and low-dose BHD groups were given intragastric administration with 26,6.5 g·kg-1·d-1of BHD respectively.The other two groups were given normal saline.After pre-treatment for 14 days,transient focal cerebral ischemia-reperfusion injury model was established by right middle cerebral artery occlusion with thread.The plasma content of CD63 and the mRNA expression of GSK3β in hippocampus were determined.Results The cerebral infarction volume of model group was increased(P<0.05 compared with sham operation group),while was reduced by BHD and clopidogrel(P< 0.05).The expression levels of CD63 and GSK3β mRNA in model group were enhanced(P<0.05 compared with sham operation group),while were decreased in high-,low-dose BHD groups and clopidogrel group,particularly in high-dose BHD group.Conclusion The protective effect of BHD on acute cerebral ischemiareperfusion model is related with the down-regulation of GSK3β mRNA overexpression and with the inhibition of CD63 expression.
Key words:Buyang Huanwu Decoction/pharmacology,cerebral ischemia/TCD therapy;gene expression regulation;platelet activation;GSK3β mRNA;CD63;disease models,animal;Rats
中图分类号:R285.5
文献标志码:A
文章编号:1007-3213(2016)03 - 0362 - 05
DOI:10.13359/j.cnki.gzxbtcm.2016.03.019
收稿日期:2015-11-10
作者简介:赖日明(1963-),男,副主任中药师;E-mail:3355089934@qq.com
通讯作者:张继平(1964-),男,硕士研究生导师,研究员,主任中药师;E-mail:fszjping@163.com
基金项目:广东省自然科学基金项目(编号:S2013010012284);广东省中医药局建设中医药强省资助课题(编号:20132029)

