嘧菌酯与烯酰吗啉对葡萄霜霉病菌的毒力测定
谭玉娴,冯静,易图永,,(湖南农业大学植物保护学院,长沙408;植物病虫害生物学与防控湖南省重点实验室,长沙408;湖南省生物农药与制剂加工工程技术研究中心,长沙408)
嘧菌酯与烯酰吗啉对葡萄霜霉病菌的毒力测定
谭玉娴1,冯静1,易图永1,2,3
(1湖南农业大学植物保护学院,长沙410128;2植物病虫害生物学与防控湖南省重点实验室,长沙410128;3湖南省生物农药与制剂加工工程技术研究中心,长沙410128)
摘要:化学药剂长期连续使用会使葡萄霜霉病菌对部分药剂产生抗药性。通过采用离体叶盘法,测定嘧菌酯和烯酰吗啉及两者的混用对葡萄霜霉病菌的毒力作用。结果表明,95%嘧菌酯、98%烯酰吗啉及两者的5个配比(1:1、1:2、2:1、1:4、4:1)对葡萄霜霉病菌的EC50值分别为7.9003、1.7656、1.454、1.685、1.0117、1.9688、3.2009µg/mL。其中嘧菌酯:烯酰吗啉为2:1时对葡萄霜霉病菌生长的抑制作用较强,可以用于防治葡萄霜霉病的田间试验。
关键词:葡萄霜霉病菌;嘧菌酯;烯酰吗啉;农药混用;毒力测定
0 引言
葡萄霜霉病(grape downy mildew)是葡萄的重要病害之一,是由葡萄生单轴霉(Plasmopara viticola)引起的卵菌病害,它主要危害叶片、嫩梢、花序、幼果等幼嫩组织,会对葡萄的质量和产量有影响[1-3],造成经济上的损失。
使用化学药剂是防治葡萄霜霉病的常用方法,经常使用的药剂有波尔多液、百菌清、甲霜灵、霜脲氰、代森锰锌、嘧菌酯、霜霉威、烯酰吗啉、吡唑醚菌酯等[4-7]。化学药剂长期连续使用会使葡萄霜霉病菌对部分药剂产生抗药性,达不到预期的防治效果[8-9]。如长期单独使用甲霜灵,葡萄霜霉病菌对其普遍产生抗药性[10]。因此解决或延缓病菌抗药性的有效方法是将不同作用位点和不同作用机理的杀菌剂进行复配[11]。朱吕会等[12]选取烯酰吗啉和嘧菌酯2种单剂对番茄早疫病菌进行抑菌试验研究,发现复配后的药剂降低了烯酰吗啉的抗性风险。齐永志等[13]测定烯酰吗啉与百菌清复配对辣椒疫霉病菌的增效作用,发现复配不仅可以提高药效,还可以延缓病菌抗药性的产生。张蕊蕊等[14]针对烯酰吗啉和嘧菌酯不同配比对黄瓜霜霉病的联合毒力进行测定,发现通过合适比例的药剂混配可以有效延缓黄瓜霜霉病对嘧菌酯及烯酰吗啉抗药性的产生。烯酰吗啉和嘧菌酯对葡萄霜霉病都有很好的防效,目前未发现两者复配对葡萄霜霉病作用的报道,因此笔者采用离体叶盘法测定嘧菌酯和烯酰吗啉对葡萄霜霉病菌的毒力,并在此基础上进行不同比例的混用,以寻找能够增效的配比,为生产上使用提供依据。
1 材料与方法
1.1试验材料
1.1.1供试药剂95%嘧菌酯原药,中国农业生产资料集团公司提供;98%烯酰吗啉原药,中国农业生产资料集团公司提供;嘧菌酯与烯酰吗啉分别以1:1、1:2、2:1、1:4、4:1进行混合。
1.1.2供试病原菌葡萄霜霉病叶采自湖南省衡山县农
业科技示范园苗圃基地‘夏黑’上。
1.2试验方法
1.2.1药剂配制根据预备试验,设置6个浓度梯度,称取一定量的嘧菌酯和烯酰吗啉原药,分别按照嘧菌酯与烯酰吗啉的比例为1:1、1:2、2:1、1:4、4:1的配比,溶于适量丙酮中,再用无菌水稀释到所需要的浓度。
1.2.2试验方法用灭菌水洗净采集的感染葡萄霜霉病菌的病叶,用脱脂棉包扎叶柄后置于铺有湿润滤纸的培养皿中,放入培养箱中保湿培养。待其重新产生孢子囊后,用小刀将孢子囊轻轻刮到装有无菌水的培养皿中,配成浓度为1.7×106个/mL孢子囊悬浮液备用。
试验选择使用叶盘接种方法进行[15-22],将生长健康的葡萄叶片制成直径1.5cm的叶盘,将叶盘在不同浓度的药液中浸10 s,取出阴干,叶盘背面朝上置于湿润的滤纸上,每个叶盘上接种10 μL的葡萄霜霉病菌孢子囊悬浮液,置于光照培养箱(光照12 h,黑暗12 h,20℃)中6~8天,每个浓度处理15个叶盘,3个重复,以无菌水处理作空白对照。
1.3数据统计与分析
待对照叶盘发病均匀后进行分级调查发病情况。葡萄霜霉病分级标准[23](以叶片为单位)为:0级,无病斑;1级,病斑面积占整个叶面积的5%以下;3级,病斑面积占整个叶面积的6%~25%;5级,病斑面积占整个叶面积的26%~50%;7级,病斑面积占整个叶面积的51%~75%;9级,病斑面积占整个叶面积的76%以上。………………………………………………………(1)………………………………………………………(2)


用Excel软件分析数据,获得毒力回归方程、相关系数R2,计算出EC50值。药剂EC50值是用来衡量药剂间毒力大小的重要指标[24]。根据孙云沛[25]的方法计算出共毒系数(CTC)。共毒系数在120以上为增效作用,80~120之间为相加作用,小于80为拮抗作用。

理论毒力指数(TTI)=A的毒力指数×A在混用中的含量+B的毒力指数×B在混用中的含量…………(4)
共毒系数(CTC)=(ATI/TTI)×100………………(5)
2 结果与分析
根据嘧菌酯与烯酰吗啉不同配比的各浓度梯度防治效果查询生物统计几率值换算表,用Excel软件分析数据,算出杀菌剂相应的EC50。由表1可知,嘧菌酯、烯酰吗啉及它们的5个配比(1:1、1:2、2:1、1:4、4:1)对葡萄霜霉病的EC50值分别为7.9003、1.7656、1.454、1.685、1.0117、1.9688、3.2009µg/mL。
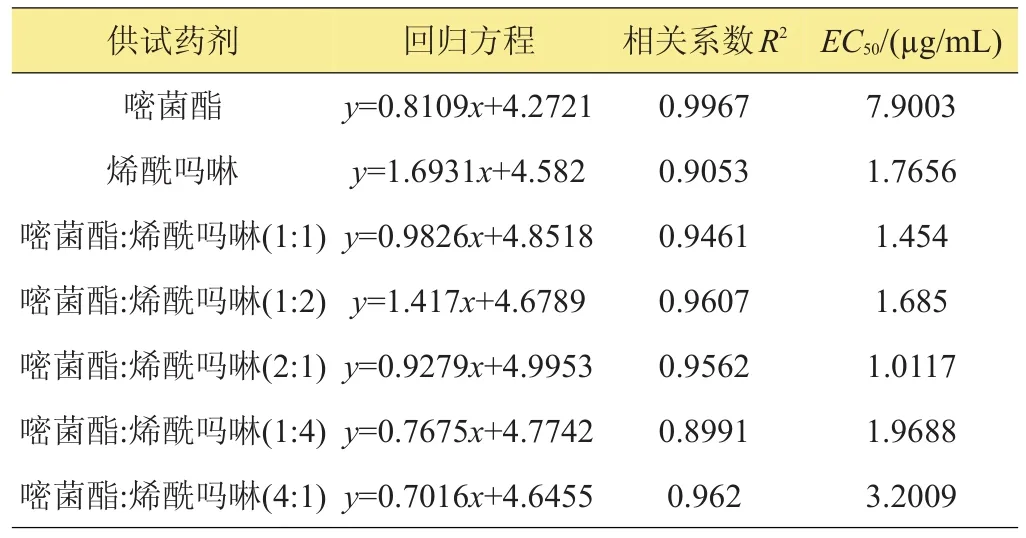
表1 嘧菌酯、烯酰吗啉混用对葡萄霜霉病菌的毒力测定结果
由表2可知,嘧菌酯与烯酰吗啉复配的共毒系数在106.17~361.85之间,当嘧菌酯与烯酰吗啉的质量分数比为2:1时增效作用最佳。
3 结论与讨论
葡萄霜霉病是葡萄的重要病害,在国内发生普遍,目前化学防治仍是葡萄霜霉病防治的有效手段。烯酰吗啉为高效内吸性杀菌剂,其主要作用机制是影响细胞壁分子结构的重排,干扰病菌细胞壁聚合体的组装,从而干扰细胞壁的形成[26]。嘧菌酯为甲氧基丙烯酸酯类杀菌剂,主要作用机制是抑制线粒体呼吸链中细胞色素间的电子转移,从而抑制ATP的产生,抑制孢子萌发、菌丝生长和孢子形成[27],与目前已有杀菌剂无交互抗性。法国科学家[28]1994年在田间检测到葡萄霜霉病对烯酰吗啉的抗性菌株,罗彦平等[29]也证明通过测定新疆葡萄霜霉病菌对杀菌剂的敏感性,发现烯酰吗啉、嘧菌酯可以作为霜霉病发生期的主要治疗剂,但不要连续使用,因此依靠单一药剂防治葡萄霜霉病很难适应葡萄生产的需求。

表2 嘧菌酯和烯酰吗啉混用对葡萄霜霉病菌的联合毒力
将2种作用机理不同的药剂嘧菌酯和烯酰吗啉进行最佳配比筛选研究,通过室内毒力测定检测对葡萄霜霉病的防治效果。根据试验结果,嘧菌酯与烯酰吗啉质量分数比为2:1时对葡萄霜霉病菌生长的抑制作用较强。这表明嘧菌酯和烯酰吗啉通过合适比例的混配可以有效延缓葡萄霜霉病菌对2种药剂的抗性发展。本研究只在室内比较单一用药和混配用药对病菌的毒力,其机理、作用方式和田间药效等还需进一步研究验证。
参考文献
[1]姚潇.葡萄病害防治技术[J].内蒙古农业科技,2006(6):85.
[2]高必达主编.园艺植物病理学[M].北京:中国农业出版社,2005.
[3]Thind T S,Arora J K,Mohan C,et al.Epidemiology of Powedery Milde,Downy Mildew and Anthracnose Diseases of Grapevine[J]. Diseases of Fruits and Vegetables,2004(1):621-638.
[4]张松强,王立如.田间药剂防治葡萄霜霉病的效果[J].安徽农学通报,2007,13(12):169-170.
[5]Cadle-Davidson L.Variation within and between Vitis spp.for foliar resistance to the downy mildew pathogen plasmoparaviticola[J]. Plant disease,2008,92(11):1577-1584.
[6]朱卫刚,胡伟群,刘燕君,等.新型杀菌剂嘧菌酯对葡萄霜霉病室内生物活性评价[J].中国南方果树,2011,40(4):80-81.
[7]李艳琼.5种杀菌剂对葡萄霜霉病的控制效果[J].甘肃农业大学学报,2011,46(6):62-65.
[8]袁善奎,周明国.植物病原菌抗药性遗传研究[J].植物病理学报,2004,34(4):289-295.
[9]闫秀琴,刘慧平,韩巨才.我国植物病原菌抗药性研究进展[J].农药,2001,40(12):4-6.
[10]毕秋艳,马志强,韩秀英,等.葡萄霜霉病菌对甲霜灵抗药性治理及其田间抗药菌株遗传稳定性分析[J].植物病理学报,2014,44(3): 302-308.
[11]毕秋艳,杨晓津,马志强,等.葡萄霜霉病有效药剂筛选及药效评价[J].植物保护,2014,40(3):199-203.
[12]朱吕会,白索柱.烯酰吗啉-嘧菌酯复配型杀菌剂的杀菌性能研究[J].齐齐哈尔大学学报,2010,26(5):52-54.
[13]齐永志,张小风,王文桥,等.烯酰吗啉与百菌清复配对辣椒疫霉菌的增效作用[J].华北农学报,2010,25(增刊):279-284.
[14]张蕊蕊,胡伟群,朱卫刚,等.嘧菌酯与烯酰吗啉混配对防治黄瓜霜霉病的增效作用[J].农药,2014,53(6):436-438.
[15]Liu S M,Sykes S R,Cligeleffer P R.A method using leafed singlenode cuttings to ecaluste downy mildew resistance in grapevine[J]. Vitis-Geilweilerhof,2003,42(4):173-180.
[16]Liu S M,Sykes S R,Cligeleffer P R.Variation between and within graoevine families in reaction to leaf inoculation with downy mildewsporangiaundercontrolledconditions[J].Vitis-Geilweilerhof,2008,47(1):55.
[17]Brown M V,Moore J N,Fenn P,et al.Comparison of leaf disk,greenhouse,and field screening procedures for evaluation of grape seeding for downy mildew resistance[J].Hort-Science,1999,34(2): 331-333.
[18]Boso Alonso S,Kassemeyer H H.Different susceptibility of European grapevine cultivars for downy mildew[J].Vitis,2008,47(1):39-49.
[19]Sotolar R.Comparison of grape seedlings population against downy mildewbyusingdifferentprovocationmethods[J].Notulae Botanicae HortiAgrobotanici Cluj-Napoca,2007,35:61-68.
[20]Staudt G,Kassemeyer H H.Ecaluation of downy mildew resistance in various accessions of wild Vitis specis[J].Vitis,1995,34(4):225-228.
[21]Tooly P W,Sweigard J A,Fry w E,et al.Fitness and virulence of Phytophthorainfestansisolatesfromsexualpopulations[J]. Phytopathology,1986,76:1209-1212.
[22]方中达.植病研究方法(第3版)[M].北京:中国农业出版社,1998:60. [23]农业部农药检定所.农药田间药效试验准则[S].北京:中国标准出版社,2000.
[24]刘霞,路永贵,闫当萍.EXCEL在农药毒力测定中的应用[J].中国农学通报,2009,25(19):206-208.
[25]Sun Yun-pei,Johnson E R.Analysis of Joint Action of Insecticides against House Flies[J].Journal of Economic Entomology,1960,53(5):887-892.
[26]黄青春,叶钟音.烯酰吗啉(DMM)的特性及其作用机制[J].农药科学与管理,2000,21(5):28-31.
[27]思彬彬,杨卓.甲氧基丙烯酸酯类杀菌剂作用机理研究进展[J].世界农药,2007,29(6):5-9.
[28]Albert G Heinen H.Howdoes dimethomorph kill fungalcellsa time lapsevideostudywithPhytophthorainfestans[M].Mosern Fungicides andAntifungal Compounds,1995:141-146.
[29]罗彦平,王强,刘琳,等.新疆葡萄霜霉病对4种杀菌剂的敏感性研究[J].新疆农业科学,2013,50(5):851-856.
Toxicity Determination of Azoxystrobin and Dimethomorph Against Plasmopara viticola
Tan Yuxian1,Feng Jing1,Yi Tuyong1,2,3
(1College of Plant Protection,Hunan Agricultural University,Changsha 410128,Hunan,China;2Hunan Provincial Key Laboratory for Biology and Control of Plant Diseases and Plant Pests,Changsha 410128,Hunan,China;
3Hunan Provincial Engineering&Technology Research Center for
Biopesticide and Formulation Processing,Changsha 410128,Hunan,China)
Abstract:Long-term continuous use of chemicals will cause drug resistance of Plasmopare viticola.By using leaf disc method,the toxicity of azoxystrobin,dimethomorph and their mixtures against Plasmopare viticola were tested.The results showed that the EC50of 95%azoxystrobin,98%dimethomorph and their five ratios(1:1,1:2,2:1,1:4,4:1)was respectively 7.9003,1.7656,1.454,1.685,1.0117,1.9688,3.2009 μg/mL.The mixture of azoxystrobin and dimethomorph at the ratio of 2:1 had very strong inhibiting effect on Plasmopare viticola and could be used to control grape downy mildew in field experiment.
Key words:Plasmopare viticola;Azoxystrobin;Dimethomorph;Pesticides Mixture;Toxicity Determination
中图分类号:S482.2
文献标志码:A论文编号:cjas16030027
基金项目:农业部公益行业计划“果树霜霉病综合防控技术研究与示范”(201203035)。
第一作者简介:谭玉娴,女,1990年出生,湖南衡山人,在读研究生,研究方向:植物病理学。
通信地址:410128湖南农业大学植物保护学院,Tel:0731-84617025,E-mail:359201781@qq.com。 410128湖南农业大学植物保护学院,Tel:0731-84617025,E-mail:yituyong@hunau.net。
通讯作者:易图永,男,1971年出生,湖南怀化人,教授,博士,研究方向:植物病理学。
收稿日期:2016-03-30,修回日期:2016-04-13。

