B.methylotrophicus SWU6菌株产纤维素酶发酵条件的优化*
吴晶晶 徐伟芳 王爱印 周 敏 黄涛杨 谢 洁
(西南大学生物技术学院,重庆 400716)
B.methylotrophicusSWU6菌株产纤维素酶发酵条件的优化*
吴晶晶徐伟芳王爱印周 敏黄涛杨谢 洁
(西南大学生物技术学院,重庆400716)
摘要前期从自然界土壤中分离筛选到一株纤维素酶产生菌Bacillus methylotrophicus SWU6菌株,为提高该菌株发酵产酶能力,本研究采用3,5-二硝基水杨酸显色法(DNS)对该菌株产酶所需碳源、氮源、温度、pH值、装瓶量、接种量等发酵条件进行优化,并比较优化前后等量发酵上清液中CMCase酶活大小。结果表明:SWU6菌株产纤维素酶的最适碳源为淀粉,最适氮源为牛肉膏,最适培养温度为50℃,培养基最适初始pH值为5.0,最适装瓶量为20%,最适接种量为2%;在最优发酵产酶条件下,SWU6菌株发酵上清液中的CMCase酶活达到454.69 U/mL,明显高于优化前利用基础培养基发酵所产的CMCase酶活,且酶活提高约3倍。通过发酵条件优化后,SWU6菌株单位体积发酵液显示出了更强的纤维素酶活性。
关键词甲基营养型芽孢杆菌;纤维素酶;发酵条件;优化
中国是一个农业发展大国,也是秸秆资源最为丰富的国家之一,每年产生农作物秸秆总量达6.4亿多吨,且有不断上升趋势[1]。农作物秸秆中富含纤维素类可再生资源,深度开发秸秆不仅可以解决我国的能源危机,亦是科学发展的必然趋势[2]。然而,由于纤维素难以被动物直接消化利用,目前对于秸秆农作物的处理,人们通常还是采用直接就地焚烧的方式,这不仅造成可再生资源的浪费,同时造成环境污染[1]。为改变现状,开发纤维素酶降解农作物秸秆,实现废弃资源的生物利用,已逐渐成为该领域的研究热点之一[3]。
纤维素酶是指能降解纤维素产生葡萄糖的酶系总称,包括内切葡聚糖酶、外切葡聚糖酶及葡萄糖苷酶[4],其来源十分广泛,原生动物、微生物(细菌、真菌、放线菌等)都具有合成和分泌纤维素酶的能力[5]。目前,自然界中产纤维素酶的微生物主要为青霉、曲霉和木霉[6-8],但利用这些微生物生产纤维素酶具有酶活低,成本高的特点[9]。因此,筛选纤维素酶高产菌株,并优化其产生纤维素酶的发酵条件,将有助于解决人类面临的资源、环境、能源等问题[10-12]。
本研究是在前期筛选得到一株纤维素酶高产菌株甲基营养型芽孢杆菌SWU6的基础上[13],通过测定该菌株发酵上清中内切葡聚糖酶(CMCase)酶活大小,研究碳源、氮源、培养温度、初始 pH值、装瓶量、接种量等单因素对其发酵产酶的影响,优化该菌株产生纤维素酶的最佳发酵条件[14]。
1材料和方法
1.1材料
1.1.1样品
前期研究筛选获得的甲基营养型芽孢杆菌SWU6菌株。
1.1.2培养基配方
基础发酵培养基:蛋白胨10.0g,酵母粉10.0g、CMC-Na 10.0g、NaCl 1.5g、KH2PO41.0g、pH 7.0,蒸馏水1 000mL,121℃灭菌20min。液体发酵培养基[13]:蛋白胨10.0g、酵母粉10.0g、CMC-Na 10.0g、NaCl 1.5g、KH2PO41.0g、MgSO4·7H2O 0.3g、pH 7.0,蒸馏水1 000 mL,121℃灭菌20min。
1.1.3主要试剂配置方法
DNS试剂:6.3g 3, 5-二硝基水杨酸(DNS)、20.9g氢氧化钠、182.0g酒石酸钾钠、5mL苯酚、5.0g无水亚硫酸钠,定容至1 000mL,贮于棕色瓶中,放置一周后使用,使用之前需要过滤,需要特别注意药品溶解温度及加入顺序[14]。
0.2M醋酸醋酸钠缓冲液(pH4.8):取40mL 0.2M醋酸和60mL的0.2M醋酸钠(将2.721 8g醋酸钠溶于95mL蒸馏水,定容至100mL)混匀即可[15]。
1.2实验方法
1.2.1葡萄糖标准曲线绘制
参照文献[13]所述的方法进行葡萄糖标准曲线的绘制。
1.2.2纤维素酶活性的测定
取一定量的发酵液倒入离心管中,4℃、8 000r/min离心10min,取上清液即为粗酶液。采用DNS法[16]进行酶活测定:用0.2M pH4.8的醋酸缓冲液配置1% CMC-Na溶液,取该底物溶液1mL,加入目的菌株发酵上清液1mL (对照管加入灭活的发酵上清液),充分混匀后置于50℃水浴锅中酶促反应30min,随后迅速加入DNS试剂3mL,沸水浴10min后,流水冷却至室温,加入去离子水定容至25mL。用对照管调零,在540nm测定吸光值,根据葡萄糖标准曲线,以三次平行测定平均值计算还原糖生成量。以每毫升发酵上清液酶促反应30min释放1μg葡萄糖的量为一个酶活单位(U)。
1.2.3发酵条件优化
1.2.3.1碳源对SWU6菌株纤维素酶活的影响
分别选用羧甲基纤维素钠、葡萄糖、果糖、乳糖、蔗糖、可溶性淀粉、麦芽糖作为唯一碳源代替基础发酵培养基中的碳源。取100mL三角瓶,均以30%装瓶量装入相应培养基中(设置三个重复),接种3%种子液,28℃,180r/min振荡培养24h[13]后,测定发酵上清液纤维素酶活。
1.2.3.2氮源对SWU6菌株纤维素酶活的影响
分别选用蛋白胨、尿素、硫酸铵、硝酸铵、牛肉膏、硝酸钾、草酸铵作为唯一氮源代替基础发酵培养基中的氮源。取100mL三角瓶,均以30%装瓶量装入相应培养基中(设置三个重复),接种3%种子液,28℃,180r/min振荡培养24h后,测定发酵上清液纤维素酶活。
1.2.3.3培养温度对SWU6菌株纤维素酶活的影响
取100mL三角瓶,以装瓶量30%装入基础发酵培养基,接种3%种子液,分别置于20℃、25℃、28℃、30℃、32℃ 、37℃、40℃、42℃、45℃、48℃、50℃和53℃,共计12个温度处理(设置三个重复),180r/min下振荡培养24h后,测定发酵上清液纤维素酶活。
1.2.3.4初始pH对SWU6菌株纤维素酶活的影响
取100mL三角瓶,以装瓶量30%装入基础发酵培养基,分别调节pH至5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5,各设置3个重复,并接入3%种子液,28℃,180r/min振荡培养24h,测定发酵上清液纤维素酶活。
1.2.3.5装瓶量对SWU6菌株纤维素酶活的影响
取100mL三角瓶,分别按10%、20%、30%、40%的装瓶量装入基础发酵培养基(设置三个重复),接种3%种子液,28℃,180r/min下振荡培养24h,测定发酵上清液纤维素酶活。
1.2.3.6接种量对SWU6菌株纤维素酶活的影响
取100mL三角瓶,以装瓶量30%装入基础发酵培养基,以1%、2%、3%、4%、5%的接种量接入SWU6菌株的种子液(设置三个重复),28℃,180r/min下振荡培养24h后,测定发酵上清液纤维素酶活。
1.2.3.7优化验证
利用优化后的发酵培养基组分与发酵条件对菌株SWU6进行发酵培养,并进行发酵上清液纤维素酶活性(CMCase酶活)测定,重复三次,取平均值。将基础培养基发酵上清液纤维素酶活性与优化发酵条件后的发酵上清液纤维素酶活性进行比较。
2结果与分析
2.1纤维素酶活性的测定
根据葡萄糖标准曲线计算回归方程为:y=0.646 8x+0.044 4,R2=0.986 8。
2.2SWU6产纤维素酶的发酵条件优化
2.2.1碳源对SWU6菌株CMCase酶活的影响
将SWU6菌株在含不同碳源的培养基中进行培养,分别测定发酵液CMCase活力。由图1可得,SWU6菌株在7种不同碳源发酵培养基中的产纤维素酶活力依次是淀粉>麦芽糖>蔗糖>果糖>乳糖>果糖>羧甲基纤维素钠>无碳源,碳源为淀粉时,酶活最强,最高酶活力215.10U/mL。
2.2.2氮源对SWU6菌株CMCase酶活活性的影响
将SWU6菌株在不同氮源培养基中进行培养,分别测定发酵液CMCase活力。由图2可得,SWU6菌株在7种不同氮源发酵培养基中的产纤维素酶活力依次是牛肉膏>蛋白胨>硝酸钾>硫酸铵>硝酸铵>无氮源>草酸铵>尿素,牛肉膏为氮源时,酶活最强,最高酶活力为116.20U/mL。

图1 SWU6菌株不同碳源

图2 SWU6菌株不同氮源
2.2.3培养温度对SWU6菌株CMCase酶活活性的影响
将SWU6菌株在不同温度下进行培养(图3):在20-50℃范围内,随着温度的升高,发酵上清中的纤维素酶活整体呈现上升趋势;培养温度为50℃时,酶活最高,最高酶活力为352.60U/mL;当培养温度继续升高,发酵上清中的纤维素酶活显著下降,故SWU6菌株的最适培养温度为50℃。
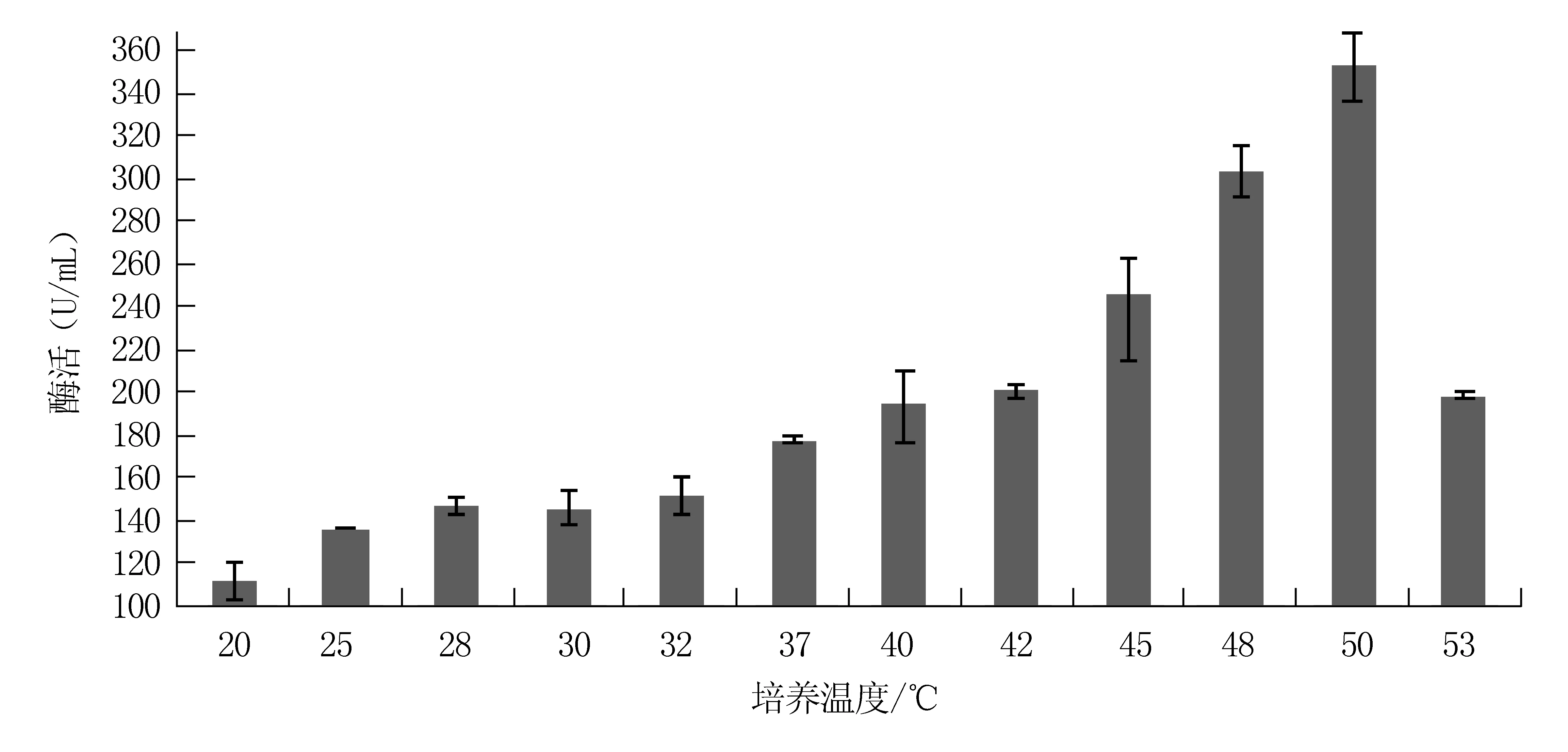
图3 培养温度对SWU6菌株发酵上清液纤维素酶活的影响
2.2.4初始pH对SWU6菌株CMCase酶活活性的影响
将SWU6菌株在不同起始pH下进行培养,分别测定发酵液CMCase活力。由图4可得,SWU6菌株在6种不同pH下进行发酵的产纤维素酶活力依次是pH 5.0>pH 5.5>pH 6.0>pH 7.5>pH 7.0>pH 6.5>pH 8.0>pH 8.5,起始pH为5.0时,酶活最高,最高酶活力为174.19U/mL。因此,SWU6菌株的最适起始pH为5.0。

图4 SWU6菌株不同起始pH
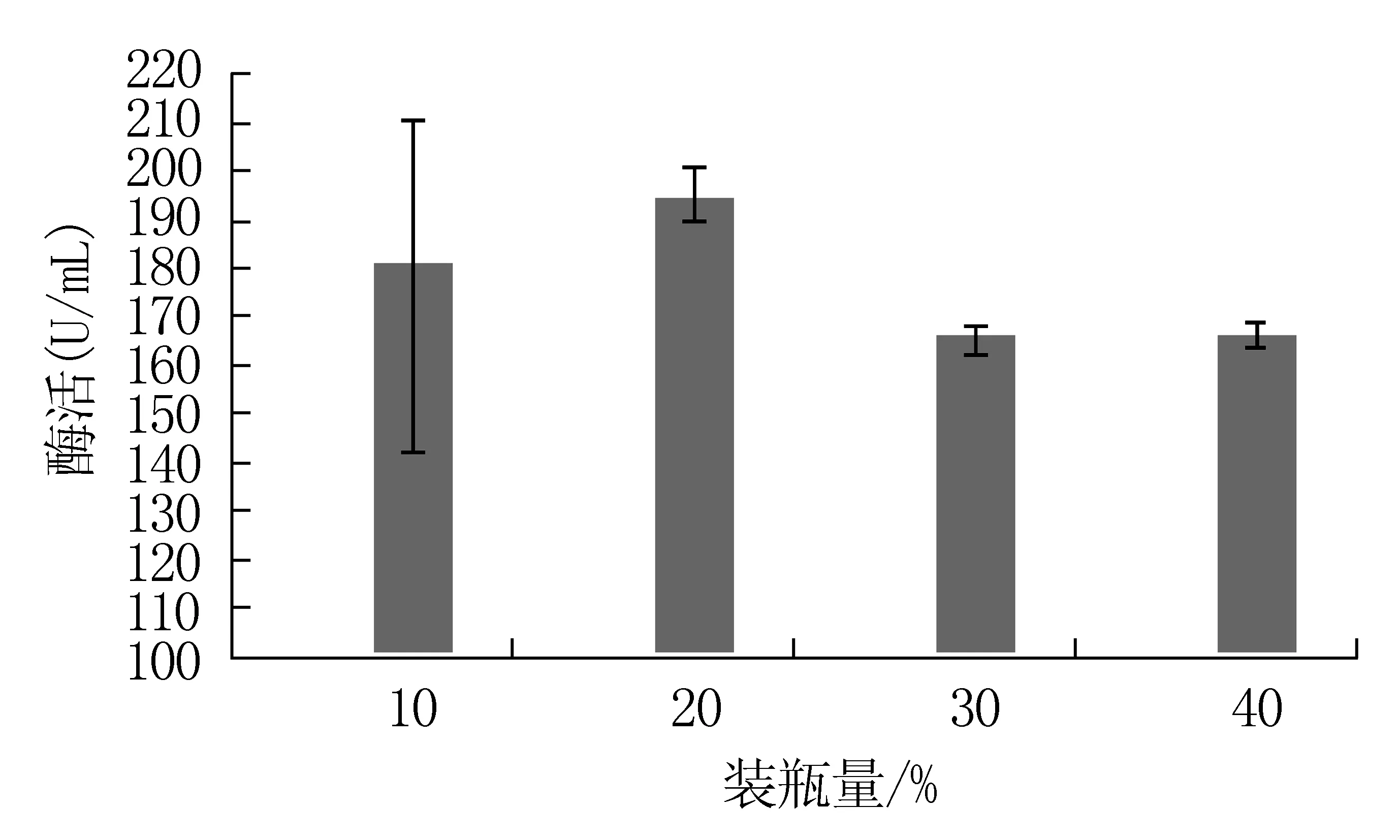
图5 SWU6菌株不同装瓶量
2.2.5不同装瓶量对SWU6菌株CMCase酶活活性的影响
将SWU6菌株在不同体积的发酵培养基中进行发酵培养,分别测定发酵液CMCase活力。由图5可得,SWU6菌株在4种体积发酵培养基中进行发酵的产纤维素酶活力依次是20%>10%>40%>30%,发酵培养基体积为20%时,酶活最高,最高酶活力为194.67U/mL。因此,SWU6菌株的最适装瓶量为20%。
2.2.6不同接种量对SWU6菌株CMCase酶活活性的影响
将SWU6菌株在接种不同体积种子液的发酵培养基中进行发酵培养,分别测定发酵液CMCase活力。由图6可得,SWU6菌株在5种接种量不同的发酵培养基中进行发酵的产CMCase活力依次是2%>1%>3%>4%>5%,接种量为2%时,酶活最高,最高酶活力为177.21U/mL。因此,SWU6菌株的最适接种量为2%。
综上所述,最适发酵条件培养基的碳源为可溶性淀粉,氮源为牛肉膏,培养温度为50℃,起始pH值为5.0,装瓶量为20%,接种量为2%。
2.3优化验证实验
在最优发酵产酶条件下, SWU6菌株发酵上清液中纤维素酶酶活大小为454.69U/mL,SWU菌株在基础培养基中发酵上清液的纤维素酶酶活大小为115.55U/mL,优化后发酵上清液纤维素酶酶活比原发酵培养基提高339.14U/mL,约提高3倍(图7)。

图6 SWU6菌株不同接种量
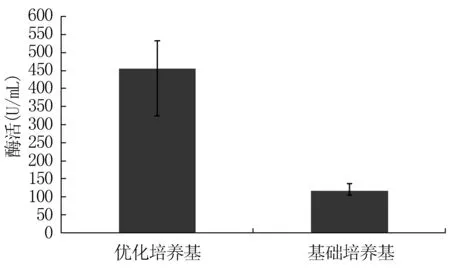
图7 优化后菌株SWU6菌株和
3讨论
对于微生物发酵过程而言,无论它的目的产物是酶或其它微生物代谢产物,还是菌体本身,都与微生物所处的环境密切相关,其中最重要的是发酵培养基组份和培养条件,它们对发酵产物的产量有非常重要的影响。因此对其发酵培养基和培养条件进行优化是提高产酶的重要方法之一[17]。本研究以纤维素酶产生菌株SWU6菌株为目的菌株,对纤维素酶产生菌株SWU6菌株发酵培养基进行了碳源、氮源、培养温度、起始pH、装瓶量、接种量等6个方面进行了培养基组分和发酵参数的优化,获得了该菌株产酶的较优条件。后续研究将通过正交实验进一步优化该菌株的产酶条件,为富含纤维素的秸秆、蚕沙等生物质的降解提供待选菌株。
参考文献
[1]韩鲁佳, 闫巧娟, 刘向阳, 等. 中国农作物秸秆资源极其利用现状[J]. 农业工程学报,2002,18(3):87-91.
[2]李素波. 纤维素酶高产菌株选育及发酵条件的优化[D]. 兰州: 兰州大学,2008.
[3]柴明艳. 一株高产纤维素酶菌的筛选及发酵条件优化[J]. 湖北农业科学,2014,53(13):3141-3144.
[4]刘燕,张宏福,孙哲. 纤维素酶的分子生物学与基因工程研究进展[J]. 饲料工业,2007,28(18):11-14.
[5]李争明,张娟,邓中洋,等. 纤维素酶产生菌的筛选、鉴定及发酵产酶条件优化[J]. 生物技术通报,2015,31(5):146-152.
[6]杨丽娜. 一株产纤维素酶菌株的筛选、鉴定及发酵条件优化[D]. 陕西: 西北农林科技大学,2013.
[7]REESE E T,MANDELS M. Stability of the cellulase of Trichoderma reesei under use conditions[J]. Biotechnology and bioengineering,1980,2(2):323-335.
[8]曲音波,高培基,王祖农. 斜卧青霉纤维素酶系的酶学研究[J]. 微生物学报,1988,28(2):121-130.
[9]CHRISTIAN P, KUBICEK. The cellulase proteins ofTrichodermareesei:structure,multiplicity,mode of action and regulation of formation[M] // Enzymes and Products from Bacteria Fungi and Plant Cells. American: Springer Berlin Heidelberg,1992:1-27.
[10]姜绍通,吴绵长,杨培周,等. 纤维素酶产生菌的诱变选育及发酵条件优化[J]. 生物工程(食品科学),2011,32(11):192-197.
[11]MAYA JACOB JOHN,SABU THOMAS. Biofibres and biocomposites[J]. Carbohydrate Polymers,2008,71:343-364.
[12]PIERO VENTURI,GIANPIETRO VENTURI. Analysis of energy comparison for crops in European agricultural systems[J]. Biomass and Bioenergy,2003,25:235-255.
[13]吴晶晶,王爱印,周敏,等. 一株纤维素酶产生菌SWU6菌株的筛选鉴定[J]. 蚕学通讯,2014,125:7-13.
[14]李争明,卢凡. 纤维素酶产生菌的筛选、发酵产酶条件优化及酶学特性研究[D]. 武汉:湖北工业大学,2014.
[15]方心芳. 应用微生物学实验法[M]. 中国轻工业出版社. 1993年01月第1版.
[16]MILLER G L. Use of dinitionsalicylic acid reagent for determination of reducing sugar[J]. Analylical Chemistry,1959,31(3):426-428.
[17]乐文民. 中性纤维素酶产生菌的筛选及发酵条件初步优化[D]. 无锡:江南大学,2014.
In a preliminary study, the strainBacillusmethylotrophicusSWU6 was screened and identified, which is a cellulase-producing bacterium. In order to improve its capacity of enzyme production, the present research optimized the amount of carbon and nitrogen, temperature, pH, bottling amount and inoculation amount by the 3,5-dinitrosalicylic acid colorimetric method (DNS), and the CMCase activity in the supernatant before optimization and after optimization was compared. The result showed that optimum carbon source, nitrogen source, fermentation time, initial temperature and pH of the medium, media amount and inoculation amount for enzyme production of this strain were starch, beef extract, 24 hours, 50℃ and 5.0, 20% and 2%, respectively. After optimization, the CMCase activity of the strain reached 454.69 U/mL, which was three times higher than it was before optimization. And higher cellulase activity was exhibited in the same volume of fermentation broth of the strain SWU6 after fermentation optimization.
Key wordsBacillusmethylotrophicus; Cellulase; Fermentation condiition; Optimization
The Optimization of Fermentation Conditions for SWU6-a Strain of the Cellulase-Producing BacteriumBacillusmethylotrophicus
WU Jing-jingXU Wei-fangWANG Ai-yin ZHOU MinHUANG Tao-yangXIE Jie
(CollegeofBiotechnology,SouthwestUniversity,Chongqing400716,China)
ABSTRACT
通讯作者:谢洁,博士,副教授,硕士生导师。Email:healthjie@163.com
资助项目:西南大学本科生科技创新基金项目(No.1331002)。

