野生型PTEN基因增强青蒿琥酯抑制K562细胞的作用
成志勇, 徐 倩, 赵亚玲, 付建珠, 谷 蕾, 李 密, 梁丽青, 刘 芳
(1保定市第一医院血液内科, 河北 保定 071000; 2承德医学院,河北 承德 067000)
野生型PTEN基因增强青蒿琥酯抑制K562细胞的作用
成志勇1△,徐倩1, 2,赵亚玲1, 2,付建珠1, 2,谷蕾1,李密1,梁丽青1,刘芳1
(1保定市第一医院血液内科, 河北 保定 071000;2承德医学院,河北 承德 067000)
[摘要]目的: 探讨野生型PTEN转染人白血病K562细胞系对青蒿琥酯敏感性的影响及其分子作用机制。方法: 将野生型PTEN以腺病毒为载体转染(感染复数为200)人白血病K562细胞(Ad-WT-PTEN),同时以转染空载体腺病毒(Ad)及未转染细胞为对照组,与青蒿琥酯(ART)联合作用,观察野生型PTEN增强青蒿琥酯抑制K562细胞的作用。根据IC50计算PTEN对青蒿琥酯的增敏倍数。以四甲基偶氮唑蓝(MTT)法检测细胞活力,流式细胞术检测细胞凋亡率,real-time PCR检测PTEN 的mRNA水平,Western blot检测PTEN、蛋白激酶B(Akt)及磷酸化Akt(p-Akt)的蛋白水平;caspase活性检测试剂盒检测caspase-3/7的活性。结果: Ad-WT-PTEN转染K562细胞后,对青蒿琥酯敏感性明显增加,依据IC50计算增敏倍数为2.25倍。至第3天,Ad-WT-PTEN +ART组较Ad+ART组细胞活力下降、凋亡率升高。Ad-WT-PTEN转染K562细胞后PTEN 的mRNA及蛋白表达明显增加,p-Akt水平及caspase-3/7活性下调,以PTEN及青蒿琥酯联合作用组下调尤为明显。结论: 野生型PTEN可能通过降低K562细胞Akt磷酸化的水平,并增加caspase-3/7活性,增强细胞对青蒿琥酯的敏感性。
[关键词]PTEN基因; 青蒿琥酯; Akt; Caspase-3/7
青蒿琥酯(artesunate,ART)为青蒿素衍生物,对多种肿瘤细胞具有很好的靶向性,同时毒副作用小,对正常组织细胞毒性低[1]。研究显示,青蒿琥酯能够抑制多种造血系统肿瘤如白血病、淋巴瘤、骨髓瘤细胞增殖,并诱导凋亡[2-3]。青蒿素衍生物与吡柔比星、多柔吡星、氟尿嘧啶等多种化疗药物具有协同作用[4-5],但其作用机制尚不清楚。
PTEN作为抑癌基因,在调控肿瘤细胞或正常细胞生长、凋亡、黏附、浸润、迁移等方面具有重要病理、生理作用。它通过抑制Akt介导的信号通路的磷酸化发挥抗肿瘤作用。在包括造血系统肿瘤在内的多种恶性肿瘤细胞中存在PTEN表达下调[5-7],并与肿瘤预后不良密切相关[6]。PTEN基因能够增强肿瘤细胞对多种化疗药物的敏感性[5],但未见与中药提取物之间的相互作用研究。
青蒿琥酯与抑癌基因PTEN均能够抑制肿瘤细胞,而二者之间是否具有相互协同抗肿瘤作用目前尚未见相关报道。本研究将二者联合作用于白血病K562细胞,探讨了二者相互协同抗白血病作用及可能的作用机制。
材料和方法
1药物与试剂
ART为桂林南药股份有限公司产品。使用前溶于磷酸盐缓冲液(PBS)中配成1 g/L,放置于-20 ℃保存。所选用的青蒿琥酯终浓度分别为0、12.5、25和50 mg/L。
碘化丙啶(propidium iodide,PI)、噻唑蓝(methyl thiazolyl tetrazolium,MTT)、引物(北京赛百盛);PTEN抗体、Akt及 p-Akt(Ser473)抗体(Santa Cruz);山羊抗鼠Ⅱ抗(北京鼎国生物);caspase-3/7活性检测试剂盒(Promega)。
2细胞
人慢性粒细胞白血病K562细胞在RPMI-1640培养基(含10%新生牛血清)中培养,放置37 ℃、5% CO2培养箱孵育。293A 细胞在含10%胎牛血清的高糖DMEM 中培养,培养条件同K562细胞。
3方法
3.1腺病毒转染以感染复数(multiplicity of infection,MOI)为200,加入含有PTEN基因或空载体腺病毒转染人白血病K562细胞,在37 ℃、5% CO2培养箱内培养2 h,加入含10%胎牛血清的RPMI-1640培养基,继续培养48 h,用流式细胞术检测表达绿色荧光的K562细胞比例,计算腺病毒转染效率。
3.2实验分组 阴性对照(negative control,NC)组:未加用青蒿琥酯,同时未转染腺病毒; ART组:青蒿琥酯作用K562细胞组; 空载体腺病毒(Ad)组:细胞转染空载体腺病毒; Ad-WT-PTEN组:细胞转染野生型PTEN基因组; Ad+ART组:细胞转染空载体腺病毒同时联合青蒿琥酯作用组; Ad-WT-PTEN+ART组:细胞转染野生型PTEN基因同时联合青蒿琥酯作用组。
3.3细胞形态学检测将不同处理组细胞培养3 d后,离心细胞后,PBS清洗,涂片后Wright染色,于光学显微镜下观察细胞形态。
3.4MTT法检测K562细胞活力选取处于对数生长期的K562细胞 1×107/L,加入96孔板。不同处理组在不同时点加入MTT,继续孵育4 h,然后离心去上清,加入DMSO振荡,酶标仪检测各处理组的490 nm处吸光度(A)值,绘制细胞生长曲线。细胞活力=1-(对照组A-实验组A)/对照组A×100%。计算药物的IC50(半数抑制浓度)。实验每组重复3次,计算PTEN基因对青蒿琥酯增敏倍数=ART与Ad联合作用的IC50/ART与Ad-WT-PTEN联合作用的IC50。
3.5流式细胞术检测凋亡收集处理不同处理组不同作用时间的细胞,每组1×106个,用70%乙醇固定,4 ℃过夜;加入RNA酶, 于37 ℃水浴15~30 min,加入碘化丙啶,流式细胞术检测细胞凋亡率。
3.6定量RT-PCR收集不同组细胞,应用1×PBS清洗2次。TRIzol提取总RNA定量,然后逆转录合成cDNA。PCR反应体系总量为25.0 μL,其中 cDNA 模板 2 μL,上、下游引物各为0.5 μL, 20×SYBR染料 1.25 μL,RealMasterMix 10 μL。扩增条件为94 ℃ 5 min,94 ℃ 45 s,60 ℃ 1 min, 30个循环。根据2-ΔΔCt计算所检测基因相对表达量,每组数据重复3次,取平均值。PTEN的上游引物序列为5’-TTG TCA TTA TCC GCA CGC TC-3’,下游引物序列为5’-ATA CCA GGA CCA GAG GAA ACC-3’ (产物 101 bp);β-actin的上游引物序列为5’-AAT GTC ACG CAC GAT TTC CCG C-3’,下游引物序列为5’-CTG GCA CCA CAC CTT CTA CAA T-3’(产物 382 bp)。
3.7Western blot检测PTEN及p-Akt的蛋白水平收集每组107细胞,1×PBS洗涤2次。将沉淀溶于200 μL细胞裂解液中4 ℃裂解1 h。4 ℃、 12 000 r/min离心20 min。取上清溶解蛋白质,并测定蛋白含量。配制8%的分离胶和5%的浓缩胶取蛋白样品,加入上样缓冲液混匀,充分变性蛋白。120 V恒压电泳。将凝胶、PVDF膜和滤纸浸入转膜缓冲液中。4 ℃、100 V恒压,转膜约2 h。转膜完毕,取出PVDF膜浸入封闭液,37 ℃封闭1 h。取出封闭好的膜,加入适量用1×TBS稀释好的 I 抗,4 ℃过夜。用1×TBS漂洗膜5 min×3次,加入适量用1×TBS稀释好的 II 抗(辣根酶标抗鼠IgG),37 ℃孵育1 h。TBS漂洗膜5 min×3次。将膜置于培养皿中,加入发光剂,显色。后进行显影、定影及灰度扫描分析。
3.8流式细胞术检测p-Akt取对不同处理组细胞作用48 h后,收集各组细胞,用1×PBS清洗2遍,在含2%甲醛中固定10 min,于90%甲醇中4 ℃孵育15 min,各取细胞悬液100 μL,分为实验组与对照组,其中实验组分别加入PE标记的p-Akt抗体各5 μL,对照组加入IgG 5 μL,各组轻轻混匀,室温避光反应30 min,立即在流式细胞仪上检测,计数10 000细胞,以对照组作为阴性对照,CellQuest软件分析,表达水平以平均荧光强度表示。
3.9Caspase-3/7的活性检测以MOI=100转染1~3 d后,选取96孔板,每组设置3个复孔,取不同转染组的K562细胞5 000个(100 μL),同时将caspase-3/7底物与缓冲液相混合,取100 μL加入孔板,混合孵育4 h,选取波长405 nm处吸光度数值,数值愈高,caspase活化程度则愈高。
4统计学处理
所有数据用SPSS 11.0计算,计量资料以均数±标准差(mean±SD)表示,多组均数比较进行单因素方差分析及q检验,计数资料采用χ2检验,以P<0.05为差异有统计学意义。
结果
1不同处理组光镜下细胞形态学变化
本研究观察了对照组、Ad+12.5 mg/L ART组和Ad-WT-PTEN+12.5 mg/L ART组,上述3种处理方法作用K562细胞3 d后,观察光镜下不同处理组的细胞形态变化。结果显示未应用任何药物的对照组K562细胞呈圆形,体积大,核染色质疏松;Ad+ART处理组的部分细胞体积缩小,核染色质轻度浓缩、边集;而Ad-WT-PTEN+ART组细胞大部分出现典型的凋亡变化,细胞体积明显缩小,核染色质浓缩,部分出现核碎裂及核溶解,见图1。

Figure 1.The morphologic changes of the K562 cells with different treatments for 3 d (Wright staining, ×400).
图1不同处理组3 d后K562细胞形态的变化
2野生型PTEN对白血病K562细胞活力的影响
腺病毒感染K562细胞后,应用流式细胞术检测K562细胞转染效率为(81.2±5.4)%。以MOI=200转染K562细胞后,MTT法检测K562细胞对照组、Ad组及Ad-WT-PTEN组的细胞活力,结果显示转染PTEN基因后0~3 d,各组之间无明显差异,4~7 d出现明显差异,第5天时细胞活力下降最大,为61.33%,明显低于Ad组的94.69%(P<0.05),而Ad组与NC组比较差异均无统计学意义。
3K562细胞转染野生型PTEN对青蒿琥酯敏感性的影响
PTEN对K562细胞生长曲线的实验发现,在最初转染野生型PTEN 3 d内,细胞活力与对照组无明显差异,因此我们检测了野生型PTEN联合不同浓度青蒿琥酯作用3 d内对K562细胞活力的影响,结果显示在干预后1~3 d,以NC组为对照,各组细胞活力为Ad组>Ad-WT-PTEN组>Ad+ART组> Ad-WT-PTEN+ART组,其中NC组、Ad组及Ad-WT-PTEN组比较差异无统计学意义,Ad-WT-PTEN+ART组的细胞活力明显高于其它各组(P<0.05)。其中第3天,Ad-WT-PTEN+12.5 mg/L ART组的细胞活力为明显低于Ad+12.5 mg/L ART组(P<0.01),见图2。
在干预3 d 后,MTT 检测结果显示ART与Ad联合作用的IC50为31.89 mg/L,ART与Ad-WT-PTEN联合作用的IC50为14.14 mg/L,因此PTEN基因对青蒿琥酯的增敏倍数为2.25。
4转染野生型PTEN联合青蒿琥酯对K562细胞凋亡率影响
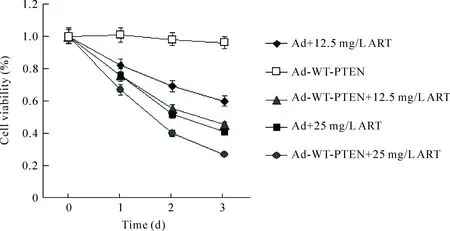
Figure 2.The effects of Ad-WT-PTEN or Ad transfection on the viability of the K562 cells treated with different concentrations of ART. Mean±SD.n=3.
图2不同浓度ART对转染Ad-WT-PTEN或Ad的K562细胞活力的影响
流式细胞凋亡检测结果显示干预后3 d,Ad+12.5 mg/L ART组及Ad-WT-PTEN+12.5 mg/L ART 组均出现典型的亚二倍体凋亡峰,后者细胞凋亡率高于前者(P<0.01),二者均高于Ad组及Ad-WT-PTEN组(P<0.01),结果见图3、表1。
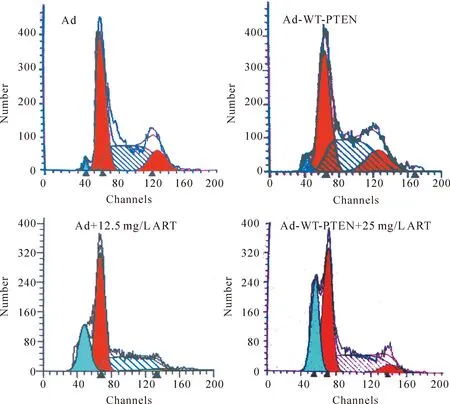
Figure 3.The apoptotic rate of the K562 cells with different treatmens for 3 d.
图3流式细胞术检测不同组处理K562细胞3 d后的细胞凋亡情况
5PTEN基因转染对K562细胞PTEN mRNA/蛋白及p-Akt蛋白水平的影响
以MOI为200转染K562细胞第3天,PTEN的mRNA和蛋白表达水平最高,3组mRNA水平分别为23.58±4.52、0.575±0.226和0.650±0.516。Ad-WT-PTEN组及Ad组mRNA及蛋白表达水平明显高于未转染对照组的mRNA及蛋白水平(P<0.01)。细胞内总Akt水平无明显变化,而Ad-WT-pTEN组p-Akt水平显著低于Ad组(P<0.05),见图4。

Figure 4.The protein levels of PTEN, p-Akt and total Akt in K562 cells transfected with or withoutPTENgene after 3 d. Mean±SD.n=3.*P<0.05vsAd-WT-PTEN group.
图4K562细胞转染或未转染PTEN第3 d 未转染组、Ad组及Ad-WT-PTEN组PTEN、p-Akt及总Akt蛋白水平的变化
6Caspase-3/7活性的检测
不同处理组干预K562细胞后,PTEN转染联合ART组的caspase-3/7活性均高于空载体腺病毒转染联合ART组(P<0.05),并呈现时间依赖性及剂量依赖性,见表1。
表1不同浓度ART作用K562细胞3 d后细胞凋亡率以及作用12 h和24 h后凋亡蛋白caspase-3/7活性的变化
Table 1.The apoptotic rate of the K562 cells with different treatmens after 3 d and the caspase-3 and -7 activity in the K562 cells after treated with different concentrations of ART at 12 h or 24 h (Mean±SD.n=3)

GroupApoptoticrate(%)Caspase-3/7activity12h24hAd1.93±0.850.245±0.0220.256±0.027Ad-WT-PTEN3.12±1.510.252±0.0260.271±0.029Ad+12.5mg/LART19.60±2.10*0.295±0.023*0.321±0.035*Ad-WT-PTEN+12.5mg/LART30.20±3.10*0.368±0.032*0.441±0.046*Ad+25mg/LART26.58±2.80*0.312±0.030*0.384±0.039*Ad-WT-PTEN+25mg/LART43.15±4.50*0.392±0.036*0.531±0.042*
*P<0.05vsAd group and Ad-WT-PTEN group.
讨论
青蒿琥酯具有抗肿瘤活性,能抑制多种实体肿瘤细胞如肝癌、胃癌、乳腺癌、结肠癌等细胞增殖,并诱导凋亡[1]。目前研究显示,青蒿琥酯亦能够抑制多种造血系统肿瘤,如淋巴瘤、白血病、骨髓瘤等细胞增殖,并诱导凋亡[2-3]。
本研究表明青蒿琥酯能够明显抑制白血病K562细胞增殖,并诱导细胞凋亡。其作用机制可能包括降低白血病细胞内线粒体膜电位;激活caspase介导的凋亡通路,诱导凋亡基因如bcl-2、bax、p53等表达[8]。
PI3K/Akt是细胞内重要信号通路,其磷酸化后,激活下游NF-κB及Bcl-2表达,进一步灭活caspase,在细胞增殖、凋亡、多药耐药中发挥重要的生理、病理功能[1],在包括恶性血液病在内的多种肿瘤中存在此信号通路的异常活化[5-6]。本研究亦表明在K562细胞中存在高强度p-Akt的活化。
PTEN通过其脂质磷酸酶活性调控Akt去磷酸化发挥抗肿瘤作用[3, 5, 9],将野生型PTEN转染白血病K562细胞系后,能增加细胞对阿霉素[5]的敏感性。本研究显示,野生型PTEN过表达的K562细胞p-Akt水平明显减低,支持PTEN对PI3K/Akt通路的去磷酸化作用。
研究发现青蒿琥酯具有较强的抑制实体肿瘤中PI3K/Akt信号通路的作用,并能上调抑癌基因PTEN表达[8]。因此青蒿琥酯能增强多种化疗药物如多柔吡星、利妥昔单抗等抗肿瘤活性[4-5, 10]。
青蒿琥酯及PTEN均能够抑制PI3K/Akt通路活性,提示二者在抗肿瘤作用机制中具有协同累加作用,本研究结果表明,野生型PTEN过表达的K562细胞对青蒿琥酯敏感性明显增加,对其增敏倍数为2.25倍。二者联合干预组细胞凋亡率亦明显高于单独干预组。而p-Akt水平及caspase-3/7活性在二者联合作用组较单独作用组有明显下调,因此本研究提示青蒿琥酯与野生型PTEN可能通过相互协同作用,共同降低K562细胞Akt磷酸化水平,并增加caspase-3/7活性,进而抑制细胞增殖,最终达到诱导白血病K562细胞凋亡作用。
青蒿琥酯具有高效低毒的抗肿瘤活性,对肿瘤细胞具有较强靶向作用,与其它抗肿瘤药物具有相互协同作用[4-5, 10]。其与PTEN基因联合作用,通过降低p-Akt及抑制caspase活性促进白血病细胞凋亡,在抗白血病治疗中具有广泛的应用前景。
[参考文献]
[1]刘志龙,曹明溶,李强,等. 青蒿琥酯对人肝癌HepG2细胞增殖和凋亡的影响及联合化疗药物的抗肝癌效应[J]. 中国病理生理杂志, 2012, 28(2): 287-291.
[2]Holien T, Olsen OE, Misund K, et al. Lymphoma and myeloma cells are highly sensitive to growth arrest and apoptosis induced by artesunate[J]. Eur J Haematol, 2013, 91(4):339-346.
[3]王素云,刘志妙,郝洪岭,等. 青蒿琥酯引起骨髓瘤细胞RPMI8226 G2/M期阻滞[J]. 第二军医大学学报, 2013, 34(7):794-796.
[4]Hou J, Wang D, Zhang R, et al. Experimental therapy of hepatoma with artemisinin and its derivatives:invitroandinvivoactivity, chemosensitization, and mechanisms of action[J]. Clin Cancer Res, 2008, 14(17):5519-5530.
[5]成志勇,梁文同,王素云,等. PTEN/NF-κB/caspase信号通路对K562/ADM细胞阿霉素耐药逆转机制的研究[J]. 中国生物工程杂志, 2013, 34(2):142-147.
[6]Wang SY, Hao HL, Deng K, et al. Expression levels of phosphatase and tensin homolog deleted on chromosome 10 (PTEN) and focal adhesion kinase in patients with multiple myeloma and their relationship to clinical stage and extramedullary infiltration[J]. Leuk Lymphoma, 2012, 53(6):1162-1168.
[7]成志勇,颜晓燕,李琳,等. 青蒿琥酯经10号染色体缺失的磷酸酶基因通路诱导K562细胞凋亡的作用机制研究[J]. 中国临床药理学杂志, 2015, 31(11):44-48.
[8]Thanaketpaisarn O, Waiwut P, Sakurai H, et al. Artesunate enhances TRAIL-induced apoptosis in human cervical carcinoma cells through inhibition of the NF-κB and PI3K/Akt signaling pathways[J]. Int J Oncol, 2011, 39(1):279-285.
[9]Martelli AM, Evangelisti C, Chappell W, et al. Targeting the translational apparatus to improve leukemia therapy: roles of the PI3K/PTEN/Akt /mTOR pathway[J]. Leukemia, 2011, 25(7):1064-1079.
[10]Sieber S, Gdynia G, Roth W, et al. Combination treatment of malignant B cells using the anti-CD20 antibody rituximab and the anti-malarial artesunate[J]. Int J Oncol, 2009, 35(1):149-158.
(责任编辑: 林白霜, 罗森)
Wild-type PTEN gene enhances the inhibitory effect of artesunate on K562 cell growth
CHENG Zhi-yong1, XU Qian1, 2, ZHAO Ya-ling1, 2, FU Jian-zhu1, 2, GU Lei1, LI Mi1,LIANG Li-qing1,LIU Fang1
(1DepartmentofHematology,TheNo.1HospitalofBaoding,Baoding071000,China;2ChengdeMedicalCollege,Chengde067000,China.E-mail:dzczy@sohu.com)
[ABSTRACT]AIM: To investigate the effect of wild-type PTEN transfection on the sensitivity of human leukemia K562 cells to artesunate (ART) and its molecular mechanism. METHODS: The adenovirus containing wild-type PTEN (Ad-WT-PTEN) or empty vectors (Ad) were transfected into K562 cells [with multiplicity of infection (MOI)=200]. The untransfected cells served as normal control. The effect of wild-type PTEN on the inhibition of K562 cell growth by ART was observed. The sensitizing ratio of PTEN combined with ART based on IC50was calculated. The viability of K562 cells was detected by MTT assay. The apoptosis was analyzed by flow cytometry. The mRNA level of PTEN was assessed by real-time PCR. The protein expression of PTEN, p-Akt and Akt was detected by Western blot. The activity of caspase-3/7 was measured by caspase activity kits. RESULTS: The sensitivity of K562 cells to ART was significantly increased by 2.25 folds after transfected with PTEN based on the IC50. The cell viability in Ad-WT-PTEN+ART group was significantly lower than that in Ad+ART group after transfection for 3 d (P<0.01). The apoptotic rate in Ad-WT-PTEN+ART group was significantly higher than that in Ad+ART group (P<0.01). The expression of PTEN at mRNA and protein levels in the K562 cells after transfection with PTEN was significantly increased, and the protein level of p-Akt and caspase-3/7 activity were down-regulated, particularly in PTEN combined with ART group. CONCLUSION: The wild-type PTEN gene enhances the sensitivity of the K562 cells to ART by down-regulating the level of p-Akt and up-regulating the caspase-3/7 activity.
[KEY WORDS]PTEN gene; Artesunate; Akt; Caspase-3/7
[文章编号]1000- 4718(2016)01- 0112- 06
[收稿日期]2015- 05- 28[修回日期] 2015- 11- 05
通讯作者△Tel: 0312-2096685; E-mail: dzczy@sohu.com
[中图分类号]R730.23; R733
[文献标志码]A
doi:10.3969/j.issn.1000- 4718.2016.01.019

